
探讨寄生胎(fetus-in-fetu,FIF)的临床特点、诊断及治疗,提高对FIF的认识。
对在南京大学医学院附属鼓楼医院出生的1例新生儿FIF的临床资料进行回顾性分析,以“寄生胎”、 “胎中胎”、“双胎畸形”、“畸胎瘤”和“fetus-in-fetu”、“parasitic twin”、“teratoma”为关键词对中国知网、维普、万方数据库、生物医学文献数据库及Embase生物医学全文数据库自2009年至2019年收录的文献进行检索,总结1周岁内发现的FIF患儿临床特征和诊疗要点。
本例患儿为足月女婴,母孕期超声检查提示胎儿骶尾部不规则混合性肿块,生后见肿块上有不完整的肢体形状,手术切除后恢复好,随访至4月龄生长发育正常。文献检索共收集53篇文献,包括本例共57例,其中男24例(42.1%),女30例(52.6%),未描述性别3例(5.3%);产前诊断11例(19.3%);寄生部位在腹膜后26例(45.6%);合并其他出生缺陷7例(12.3%);术后预后好45例(78.9%)。
FIF系罕见疾病,多见于腹膜后,产前诊断较难,应与畸胎瘤鉴别,治疗后预后较好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
寄生胎(fetus-in-fetu,FIF)是一种罕见的出生缺陷,活产儿发生率约1/500万。FIF表现为一具完整胎体的某部分寄生有另一具或几具不完整的胎体,是单卵双胎发育异常所致[1]。以往FIF均在新生儿生后由儿科医生检查发现并处理,随着产前超声诊断技术的进步和胎儿医学的发展,越来越多的FIF在产前得以发现,新生儿科医生的工作前移。本文报道1例本院出生的FIF新生儿病例,并复习相关文献,探讨FIF的临床特点和诊疗要点,以提高临床医生对该病的认识。
1.临床资料:患儿女,生后1 d,因“骶尾部巨大不规则肿块”转儿外科治疗。患儿系第2胎第1产,胎龄39+2周,出生体重4 080 g。其母30岁,孕期体健,无不良孕产史。孕23+1周中孕结构筛查发现胎儿骶尾部20 mm×20 mm×20 mm混合性回声,液性为主;孕27+5周增大为59 mm×55 mm×60 mm,内见部分液性暗区,其内似见长骨样结构,长度分别为27、18 mm,包膜完整,厚2 mm,部分位于盆腔骶骨前方未进入腹腔,部分向外生长,临床诊断为胎儿骶尾部畸胎瘤Ⅱ型,羊水穿刺和染色体微阵列分析未见异常,继续妊娠。其间,胎儿生长符合胎龄,肿块逐渐增大。孕39+1周,超声下见胎儿骶尾部肿物增至123 mm×82 mm×91 mm,形状不规则,因不具备阴道分娩条件,遂于胎龄39+2周行剖宫产娩出。
入院查体:骶尾部及右臀部包裹形状不规则肿块,肛门受压前移,肿块色泽红润,被正常皮肤包裹,表面可见破溃,无出血,可见发育不成熟的女性外阴、脐血管、双下肢、一侧上肢、手指、脚趾等(图1),临床诊断为FIF。
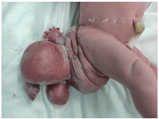

2.诊疗经过:术前新生儿腰骶部磁共振成像(magnetic resonance imaging,MRI)示骶尾部混杂信号包块影,椎管内、脊髓圆锥显示欠清,诊断FIF。心脏彩超示房间隔缺损(继发孔)房水平左向右分流。血甲胎蛋白(alpha fetoprotein,AFP)>1 210.0 ng/ml,神经元烯醇化酶(neurone specific enolase,NSE)88.94 ng/ml,癌胚抗原(carcino-embryonic antigen,CEA)3.51 ng/ml。血常规正常。患儿生后1月龄行骶尾部肿物切除术,术后恢复好,病理符合骶尾部FIF。2月龄复查AFP>321.9 ng/ml,NSE 18.81 ng/ml,CEA 2.47 ng/ml。随访至4个月,生长发育良好。
1.检索结果:以“寄生胎”、“胎中胎”、“双胎畸形”、“畸胎瘤”和“fetus-in-fetu”、“parasitic twin”、“teratoma”为关键词对中国知网、维普、万方数据库、生物医学文献数据库及Embase生物医学全文数据库自2009年至2019年收录的文献进行检索,剔除重复文献和缺乏病理诊断文献,纳入研究对象为1周岁内FIF患儿,共收集中文文献17篇[2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18],英文文献36篇[19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54],加上本例共57例患儿。其中男24例(42.1%),女30例(52.6%),未描述性别3例(5.3%);记录分娩方式31例,其中剖宫产18例(58.1%),顺产13例(41.9%);合并其他结构畸形7例(12.3%),其中合并畸胎瘤、无肛、脐膨出、舌骨缺损并室间隔缺损各1例,脐膨出合并房间隔缺损、动脉导管未闭1例,右心室双出口合并室间隔缺损1例,合并单侧腹股沟型隐睾、动脉导管未闭、腹壁疝及右侧双骨盆等多发畸形1例;经手术切除后预后良好45例(78.9%);死亡5例(8.8%),1例因早产儿呼吸窘迫综合征生后死亡, 2例颅内FIF于术中死亡, 1例因败血症及贫血死亡,1例合并严重先天性心脏病于术后死亡;术后发生严重并发症4例(7.0%),1例因肿块牵拉导致胆总管损伤,1例左侧腹膜后FIF致同侧睾丸萎缩,1例口腔FIF术后仍存在喂养困难,1例颅内FIF有癫痫等神经系统症状。见表1。
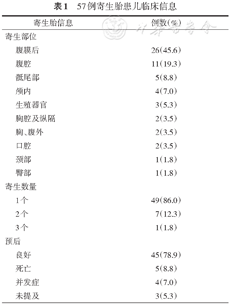
57例寄生胎患儿临床信息
57例寄生胎患儿临床信息
| 寄生胎信息 | 例数(%) |
|---|---|
| 寄生部位 | |
腹膜后 | 26(45.6) |
腹腔 | 11(19.3) |
骶尾部 | 5(8.8) |
颅内 | 4(7.0) |
生殖器官 | 3(5.3) |
胸腔及纵隔 | 2(3.5) |
胸、腹外 | 2(3.5) |
口腔 | 2(3.5) |
颈部 | 1(1.8) |
臀部 | 1(1.8) |
| 寄生数量 | |
1个 | 49(86.0) |
2个 | 7(12.3) |
3个 | 1(1.8) |
| 预后 | |
良好 | 45(78.9) |
死亡 | 5(8.8) |
并发症 | 4(7.0) |
未提及 | 3(5.3) |
2.诊断及手术时机:57例患儿均经病理学检查证实FIF诊断。产前发现肿块33例(57.9%),产前诊断FIF 11例(19.3%),中孕期诊断2例,晚孕期诊断9例。31例出生后即行手术治疗,1例因早产、低出生体重入住重症监护室延迟手术,1例生后监测肿块增大出现腹胀症状于生后45 d手术。3例产时发现肿块,1例颈部和1例口腔FIF患儿生后立即手术,1例臀部FIF患儿因社会经济原因11月龄手术。生后发现21例,最早出生2 d发现,最迟出生10月龄诊断,其中以腹胀、呕吐等胃肠道症状为首发症状18例。
3.骶尾部患儿情况分析:比较5例(包括本例)骶尾部FIF临床资料,见表2。

新生儿骶尾部寄生胎文献复习
FIF多发生于单绒毛膜双胎,在胚胎发育的极早阶段,受精卵内细胞群分裂为2团或3团以上,其中1团或几团由于各种原因发育受限或停止,被包入发育正常的内细胞群所形成的胚体内,从而形成单个或多个寄生胎。有学者认为单卵双绒毛膜双羊膜囊双胎在受精卵分裂早期也会产生一胎被包裹入另一胎体内的现象[22]。1935年Wills[55]提出FIF的诊断需要中轴骨的存在。然而,并不是所有的FIF都有可辨别的脊柱。Spencer[56]提出,FIF 需要至少具有以下特征之一:(1)包裹在分离的囊中;(2)有部分或完全覆盖的正常皮肤;(3)具有可识别的解剖结构;(4)有血管与宿主相连;(5)联体双胎或包含神经管或胃肠系统。本病例缺乏中轴骨,符合当前FIF的诊断标准,但产前未明确诊断。
FIF和畸胎瘤具有许多相似特征,甚至可能同时出现[44]。FIF寄生部位以腹膜后和腹腔最常见,其次为骶尾部,而畸胎瘤的好发部位为骶尾部。影像学上,FIF与畸胎瘤特征相似,难以鉴别,产前超声诊断率不足20%。FIF的特征为可见成形的脊椎或四肢,而畸胎瘤为散在的不规则钙化或骨化影。有学者指出[20],胎儿MRI有助于产前诊断FIF,且能清晰显示FIF与周围组织及血管的关系,为制定手术方案提供良好的依据[39]。CT也有助于FIF与畸胎瘤的诊断及鉴别诊断,但CT具有潜在辐射风险,更适用于术前诊断[42]。FIF的最终确诊需要病理学检查发现发育成熟或不成熟的器官组织。本研究中FIF合并畸胎瘤1例,产前诊断率为19.3%;本例患儿产前超声诊断为畸胎瘤,生后结合MRI及病理结果明确诊断FIF。
FIF并发症的发生主要与肿块的位置、大小相关,一般腹部、骶尾部FIF并发症较少,预后较好,颅内FIF压迫脑组织、口腔FIF压迫气道,可造成胎儿和新生儿死亡。早期诊断为孕期管理和妊娠选择提供依据,若合并染色体异常、其他结构畸形,可能发生严重并发症、预后差的FIF,产妇可选择早期终止妊娠。其次,分娩方式的选择一般基于产前影像学对肿块大小、形状的描述,从而进行个体化选择,腹膜后、腹腔内FIF肿块大小不超过5 cm,胎儿估计出生体重小于或符合胎龄的,可以选择自然分娩[9,13,36, 37,43,53];肿块较大[20]、外生形状不规则[19],特别是有明显肢体的肿块、口腔FIF,或估计胎儿出生体重较大[3,7,23,38],一般选择剖宫产。对于肿块生长较快,形状复杂的FIF胎儿,建议产妇到产前诊断能力和影像学专科能力较强的医院定期产检;对于危险程度较高的胎儿,如口腔FIF患儿生后需立即气管插管建立通气[19],建议产妇到新生儿抢救能力强的医院分娩,增加患儿救治成功率。
绝大多数FIF为良性[47],唯一有效的治疗方法是手术切除,多数患儿术后预后良好,FIF患儿的预后与肿块的大小、部位、局部压力等因素有关,手术时机的选择不影响预后。FIF宿主血清中AFP的含量有一定的升高,且有母体含量同时升高的报道。AFP及β人体绒毛膜促性腺激素等肿瘤标志物可作为患儿诊断、随访观察、确定FIF恶性复发的依据。本研究中患儿切除肿物1个月后随访AFP明显下降。
综上,在FIF的临床管理中,新生儿科医生应提前参与到妊娠和分娩期管理中,作为胎儿到新生儿过渡阶段的桥梁,连接母胎医学专家、影像科医生与儿外科、麻醉科医生、护理团队以及孕产妇家庭,为产妇和患儿提供充分的评估、精准的咨询建议和完整的诊疗方案。
所有作者均声明不存在利益冲突



























