
分析新生儿牛奶蛋白过敏性直肠结肠炎(allergic proctocolitis,AP)的临床特点,提高对本病的诊治水平。
回顾性分析2018年1月至2020年6月湖北省妇幼保健院新生儿科收治的牛奶蛋白AP患儿资料,包括临床表现、相关实验室及影像学检查、电子结肠镜与组织病理学检查、皮肤点刺试验结果,以及诊疗经过与转归情况。
共纳入11例AP患儿。首发症状最常见血便,其次是腹胀、腹泻、呕吐。11例均出现血便,腹胀5例,腹泻3例,呕吐3例,发热、反应低下、呼吸暂停各1例。混合喂养4例,人工喂养7例,发病日龄3~12 d(平均8.1 d)。便常规均提示潜血阳性,2例有白细胞、红细胞,便培养均阴性。血炎性指标正常9例, 超敏C反应蛋白、降钙素原增高2例,嗜酸性粒细胞比例增高8例,皮肤点刺试验阳性3例。胸腹立卧位X线片正常4例,局部肠管充气、扩张3例,局部肠壁水肿、增厚2例,肠管排列与走行僵硬、肠壁透亮影2例。腹部超声正常2例,肠胀气6例,肠胀气伴少量腹腔积液或肠蠕动差3例。11例肠镜检查均可见肠黏膜充血、水肿,伴肠黏膜糜烂8例、黏膜出血5例、溃疡灶5例。组织病理学示结肠黏膜间质可见炎性细胞浸润,局灶区间可见嗜酸性粒细胞浸润,5~30个/HPF。起病后均调整为深度水解配方奶或氨基酸配方奶喂养,3~7 d(平均4.3 d)后症状消失。
新生儿AP可发生在生后第1周内,血便是主要临床症状,缺乏特异性临床特征及检查手段,临床需依据症状、实验室与影像学检查结果、诊断性回避牛奶蛋白后症状明显改善、结肠镜及病理活检特征性改变并排除其他病因后诊断。回避过敏原是主要干预措施,预后良好。

过敏性直肠结肠炎(allergic proctocolitis,AP)是由非IgE免疫介导、直肠和结肠炎性改变为特征的消化道食物过敏反应,是婴幼儿腹泻和血便的重要原因之一。AP可发生于新生儿期和婴儿期任何时候,可在生后第1周甚至生后几小时内发病,生后6个月内发病最为常见[1]。新生儿AP发病率尚不清楚,临床缺乏特异性症状和确诊检查手段,主要表现为血便,亦可出现腹胀、呕吐、腹泻、反应低下、呼吸暂停等,部分患儿易被诊为急性胃肠道感染、新生儿坏死性小肠结肠炎、败血症以及外科急腹症等严重疾病。本研究对11例临床诊断为新生儿AP的病历资料进行回顾分析,总结新生儿AP的诊治要点,希望提高新生儿科医生对本病的诊治水平、减少误诊误治。
选择2018年1月至2020年6月湖北省妇幼保健院新生儿科收治的牛奶蛋白AP的患儿进行回顾性分析。AP主要参照《中国婴幼儿牛奶蛋白过敏诊治循证建议》,结合患儿症状、实验室与影像学检查结果、诊断性回避牛奶蛋白后症状明显改善、结肠镜及病理活检特征性改变并排除其他病因后诊断。排除急性胃肠道感染、新生儿坏死性小肠结肠炎、败血症以及外科急腹症等严重疾病患儿。
1.资料收集:通过查阅病历资料,记录患儿性别、胎龄、发病日龄、喂养情况、首发症状、主要症状、外周血嗜酸性粒细胞计数、超敏C反应蛋白、降钙素原、便常规+潜血、皮肤点刺试验、电子结肠镜与组织病理学检查结果,以及诊疗经过、转归情况。
2.皮肤点刺试验:采用一次性点刺针,试剂变应原点刺液包括组胺(阳性对照)、生理盐水(阴性对照)、患儿母乳、足月儿配方奶、早产儿配方奶、部分水解配方奶及深度水解配方奶。判断标准:无反应或与阴性对照相同为(-);以变应原与组胺(阳性对照)所致风团面积的比值确定反应级别,比值≥1/4为(+),比值≥1/2为(++),比值=1为(+++),比值>1为(++++)。
3.电子结肠镜与组织病理学检查:采用小儿电子纤维结肠镜(OLYMPUS PCF-260AI),检查前常规灌肠清洁肠道,在镇静状态下完成检查。AP组织病理学诊断标准[2]:内镜下表现为肠黏膜水肿、充血、糜烂、出血、溃疡。肠组织病理主要表现为固有层嗜酸性粒细胞浸润≥6个/HPF,附近常伴淋巴样聚集;隐窝上皮或黏膜肌层嗜酸性粒细胞浸润≥1个/HPF;或隐窝脓肿中有嗜酸性粒细胞和中性粒细胞同时存在。符合内镜下表现,以及病理检查表现中一条以上即可诊断。
符合新生儿AP诊断标准患儿共11例,其中男6例,女5例;足月儿8例,早产儿3例;出生时均无明显窒息史;发病日龄3~12 d(平均8.1 d);7例发病时一般状况良好,2例(病例2、病例10)出现反应低下、发热、呼吸暂停等败血症表现,2例(病例4、病例9)表现为坏死性小肠结肠炎临床改变;11例均无明确家族过敏史。见表1。
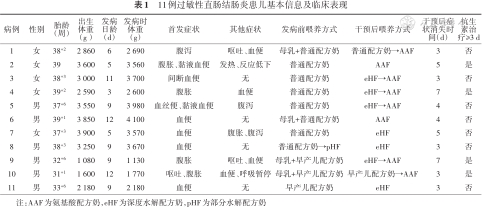
11例过敏性直肠结肠炎患儿基本信息及临床表现
11例过敏性直肠结肠炎患儿基本信息及临床表现
| 病例 | 性别 | 胎龄(周) | 出生体重(g ) | 发病日龄(d) | 发病时体重(g) | 首发症状 | 其他症状 | 发病前喂养方式 | 干预后喂养方式 | 干预后症状消失时间(d) | 抗生素治疗≥3 d |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 女 | 38+2 | 2 860 | 6 | 2 690 | 腹泻 | 呕吐、血便 | 母乳+普通配方奶 | 普通配方奶→AAF | 3 | 否 |
| 2 | 女 | 39 | 3 600 | 5 | 3 560 | 腹胀、黏液血便 | 发热、反应低下 | 普通配方奶 | AAF | 5 | 是 |
| 3 | 女 | 38+3 | 3 000 | 11 | 3 700 | 间断血便 | 无 | 普通配方奶 | eHF→AAF | 3 | 否 |
| 4 | 女 | 39+2 | 2 590 | 3 | 2 600 | 腹胀 | 血便 | 普通配方奶 | eHF→AAF | 7 | 是 |
| 5 | 男 | 37+6 | 3 550 | 9 | 3 980 | 血丝便、黏液血便 | 腹泻 | 普通配方奶 | eHF→AAF | 4 | 否 |
| 6 | 男 | 39+1 | 3 850 | 12 | 4 100 | 血便 | 无 | 母乳+普通配方奶 | AAF | 4 | 否 |
| 7 | 女 | 37+3 | 3 900 | 5 | 3 570 | 血便 | 腹胀、腹泻 | 普通配方奶 | eHF | 5 | 否 |
| 8 | 男 | 38+3 | 3 250 | 9 | 3 670 | 血便 | 无 | 普通配方奶→pHF | eHF | 3 | 否 |
| 9 | 男 | 32+6 | 1 080 | 9 | 1 130 | 腹胀 | 呕吐、血便 | 母乳+早产儿配方奶 | eHF→AAF | 7 | 是 |
| 10 | 男 | 31+1 | 1 600 | 12 | 1 770 | 呕吐、腹胀 | 血便、呼吸暂停 | 母乳+早产儿配方奶 | 早产儿配方奶→AAF | 3 | 是 |
| 11 | 男 | 33+6 | 2 180 | 9 | 2 180 | 血便 | 无 | 早产儿配方奶 | eHF | 3 | 否 |
注:AAF为氨基酸配方奶,eHF为深度水解配方奶,pHF为部分水解配方奶
11例AP患儿中,首发症状最常见的是血便,表现为大便带鲜血丝或黏液血便,其次是腹胀、腹泻、呕吐;主要临床表现均有血便,腹胀5例,腹泻、呕吐各3例,发热和反应低下、呼吸暂停各1例;均生长发育良好,无营养不良、脱水、酸中毒等表现,未见皮疹、肛裂及肛周湿疹;混合喂养4例,人工喂养7例;发病后调整为深度水解配方奶(extreme hydrolysis formula,eHF)或氨基酸配方奶(amino acid formulation,AAF)喂养,3~7 d(平均4.3 d)后症状消失;发病后均预防使用抗生素治疗,4例抗生素治疗时间≥3 d。见表1。
11例AP患儿便常规潜血均阳性,2例有白细胞、红细胞,便培养均为阴性。9例患儿血炎性指标正常,2例超敏C反应蛋白、降钙素原增高,8例嗜酸性粒细胞比例增高,所有患儿肝功能、肾功能、心肌酶谱及凝血功能均未见明显异常。见表2。
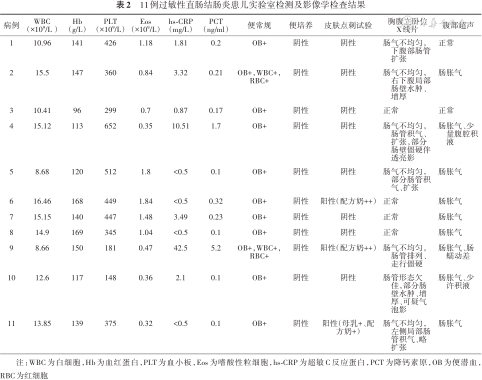
11例过敏性直肠结肠炎患儿实验室检测及影像学检查结果
11例过敏性直肠结肠炎患儿实验室检测及影像学检查结果
| 病例 | WBC (×109/L ) | Hb (g/L) | PLT (×109/L) | Eos (×109/L) | hs-CRP(mg/L) | PCT (ng/ml) | 便常规 | 便培养 | 皮肤点刺试验 | 胸腹立卧位 X线片 | 腹部超声 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 10.96 | 141 | 426 | 1.18 | 1.81 | 0.2 | OB+ | 阴性 | 阴性 | 肠气不均匀,下腹部肠管 扩张 | 正常 |
| 2 | 15.5 | 147 | 360 | 0.84 | 3.32 | 0.21 | OB+,WBC+,RBC+ | 阴性 | 阴性 | 肠气不均匀,右下腹局部肠壁水肿、增厚 | 肠胀气 |
| 3 | 10.41 | 96 | 299 | 0.7 | 0.87 | 0.17 | OB+ | 阴性 | 阴性 | 正常 | 正常 |
| 4 | 15.12 | 113 | 652 | 0.35 | 10.51 | 1.7 | OB+ | 阴性 | 阴性 | 肠气不均匀,肠管积气、扩张,部分肠壁僵硬伴透亮影 | 肠胀气、少量腹腔积液 |
| 5 | 8.68 | 120 | 512 | 1.8 | <0.5 | 0.1 | OB+ | 阴性 | 阴性 | 肠气不均匀,部分肠管积气、扩张 | 肠胀气 |
| 6 | 16.46 | 168 | 449 | 1.84 | <0.5 | 0.32 | OB+ | 阴性 | 阳性(配方奶++) | 正常 | 肠胀气 |
| 7 | 15.15 | 140 | 447 | 1.48 | 3.49 | 0.23 | OB+ | 阴性 | 阴性 | 正常 | 肠胀气 |
| 8 | 14.9 | 169 | 345 | 1.04 | <0.5 | 0.1 | OB+ | 阴性 | 阴性 | 正常 | 肠胀气 |
| 9 | 8.66 | 150 | 181 | 0.47 | 42.5 | 5.2 | OB+,WBC+,RBC+ | 阴性 | 阳性(配方奶++) | 肠气不均匀,肠管排列、走行僵硬 | 肠胀气、肠蠕动差 |
| 10 | 12.6 | 117 | 148 | 0.36 | 2.1 | 0.1 | OB+ | 阴性 | 阴性 | 肠管形态欠佳,部分肠壁水肿、增厚、可疑气泡影 | 肠胀气、少许积液 |
| 11 | 13.85 | 139 | 375 | 0.32 | <0.5 | 0.1 | OB+ | 阴性 | 阳性(母乳+、配方奶+) | 肠气不均匀,左侧局部肠管积气、略扩张 | 肠胀气 |
注:WBC为白细胞,Hb为血红蛋白,PLT为血小板,Eos为嗜酸性粒细胞,hs-CRP为超敏C反应蛋白,PCT为降钙素原,OB为便潜血,RBC为红细胞
胸腹立卧位X线片正常4例,局部肠管充气、扩张3例,局部肠壁水肿、增厚2例,肠管排列与走行僵硬、肠壁透亮影2例。腹部超声正常2例,肠胀气6例,肠胀气伴少量腹腔积液或肠蠕动差3例。见表2。
11例患儿皮肤点刺试验结果显示:阴性8例,阳性3例。见表2。
11例电子结肠镜检查均可见直肠结肠黏膜充血、水肿,肠黏膜糜烂8例,黏膜出血、溃疡灶各5例(图1)。组织病理学改变表现为肠黏膜炎性改变,结肠黏膜间质可见炎性细胞浸润,局灶区间质可见嗜酸性粒细胞浸润:5~30个/HPF不等(图2)。
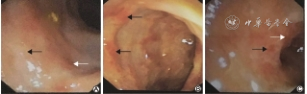

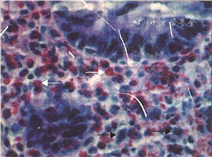

血便是新生儿的常见临床症状,可见于肛门直肠损伤、维生素K1缺乏、急性感染性胃肠炎、坏死性小肠结肠炎、败血症、外科急腹症及过敏性肠炎等情况。牛奶蛋白过敏可累及从口腔至直肠的整个消化道,多数疾病累及消化道的特定区域,如口腔过敏综合征、严重过敏反应、食物蛋白诱导性肠病、食物蛋白诱导的小肠结肠炎综合征或直肠结肠炎、嗜酸细胞性食管炎或胃肠炎、乳糜泻等[3]。AP的发病机制尚不清楚,主要与T细胞介导有关,通常为非IgE介导的过敏反应[4]。新生儿AP还与肠道黏膜发育不成熟、消化液分泌缺乏、肠道黏膜上皮之间存在间隙、通透性高、容易对牛奶蛋白产生过敏反应有关[5]。
新生儿AP发病率尚不清楚。Elizur等[6]研究婴幼儿直肠出血显示,由牛奶蛋白过敏引起的出血约占0.16%。一项包括13 019例以色列新生儿的前瞻性队列研究显示,1岁时因牛奶蛋白导致AP的累积发病率为0.34%[7]。AP可在生后第1周甚至生后几小时内发病,生后6个月内发病最为常见。Venter等[8]也报道在哺乳后2 h或2~3 d即可出现消化道过敏症状,纯母乳喂养婴儿多发生于生后2~6周。本组资料显示,11例患儿中早产儿3例,混合喂养4例,配方奶喂养7例,发病日龄3~12 d,均非纯母乳喂养,因生后早期接触牛奶蛋白导致AP发生于新生儿期,包括早产儿。目前母乳喂养也可导致婴儿食物过敏的观点已被多数学者接受,且认为母乳喂养对过敏性疾病的预防作用较低[9, 10]。但人乳能促进婴儿肠道黏膜成熟和有益菌定植,含有免疫调节因子和抗炎因子,对婴儿的营养、免疫及心理发育均有益,因此,提倡纯母乳喂养至6月龄仍是一个理想的目标,也是预防牛奶蛋白过敏最重要的策略[11, 12]。
婴幼儿AP主要表现为轻至中度腹泻,排便性质可以为黏液便、不同程度血便,也可能排便正常,患儿一般状况及生长发育良好,常有湿疹,无腹部阳性体征。本组资料显示,新生儿AP最常见的首发症状为血便,其次为腹胀、腹泻、呕吐,临床表现缺乏特异性。其中8例患儿嗜酸性粒细胞增多,但早产、感染、支气管肺发育不良、输血等也可引起嗜酸性粒细胞增多,该项检查不能作为诊断牛奶蛋白过敏的重要辅助指标[13]。皮肤点刺试验可用于筛查IgE介导的过敏反应,具有操作简单、快速、重复性好、阳性率高等特点,结合回避试验阳性可确诊牛奶蛋白过敏,其免疫反应强度可为免疫治疗及过敏原回避提供依据[14]。血清特异性IgE抗体检测也可用于筛查IgE介导的过敏反应,结果判定因年龄、过敏原、检测方法不同而异,新生儿阳性率低[15],因此本组患儿未做该项检测。大部分患儿胸腹立卧位X线片及腹部超声结果正常或提示轻度肠胀气,少数可见局部肠壁水肿、增厚甚至出现肠管排列与走行僵硬、肠壁透亮影、肠蠕动差、少量积液,肝肾功能、心肌酶谱及凝血功能指标均未见明显异常。由此可见,目前所有的实验室、影像学及生物技术检查对新生儿AP的诊断均缺乏特异性,但有助于与感染性胃肠炎、坏死性小肠结肠炎、败血症以及外科急腹症等新生儿严重疾病进行鉴别,同时结合电子结肠镜与病理学特征性改变对协助新生儿AP诊断有帮助,可以减少延误诊治。
AP主要病变在结肠,尤其是乙状结肠末段和直肠,呈灶性或弥漫性病变,内镜表现为肠黏膜充血、水肿、糜烂、灶性出血、溃疡等,组织学可见上皮层和固有层嗜酸性粒细胞浸润,部分患儿可有淋巴结增生病变,很少形成隐窝脓肿[1]。本组资料显示,11例AP患儿均可见直肠结肠黏膜不同程度的充血、水肿,8例伴黏膜糜烂,5例伴出血,5例伴溃疡。考虑到肠黏膜充血、肿胀,为防止检查造成进一步损伤,本组病例内镜检查范围只限于观察直肠和乙状结肠病变,病理显示肠黏膜间质可见炎性细胞浸润,以淋巴细胞或浆细胞为主,病灶区间质可见嗜酸性粒细胞浸润。需要注意的是,内镜检查和病理活检有助于AP的诊断与鉴别诊断,但不属于常规检查项目,当患儿通过回避可疑过敏原4周症状仍不能缓解,病情需要进一步诊断和鉴别诊断,需要明确嗜酸细胞性胃肠炎或食管炎、乳糜泻和食物蛋白诱导性小肠结肠炎等疾病时才有检查指征[1]。
婴幼儿AP通常为一过性良性疾病,预后较好,多数患儿在回避过敏原后72~96 h症状得到缓解[4]。本组资料也显示所有患儿调整为eHF或AAF喂养后,临床症状在3~7 d逐渐消失。对于AP患儿,目前国内外食物过敏指南均推荐纯母乳喂养儿仍坚持母乳喂养,但母亲需回避所有可能致敏的食物(如牛奶及各种奶制品、鸡蛋、花生、坚果等)。对于母亲饮食回避后患儿症状不能缓解以及人工喂养的新生儿,首选eHF。对于母亲饮食回避后患儿症状持续存在且很严重、影响生长发育、重度牛奶蛋白过敏以及eHF喂养仍不能耐受者,推荐AAF喂养至少6个月或直到9~12月龄[16, 17, 18]。
总结本组资料,AP可发生于新生儿期,甚至在生后几小时至第1周内发病。与婴儿AP相比,新生儿AP的临床表现更缺乏特异性,血便是主要临床症状,其次为腹胀、腹泻。目前所有的实验室、影像学及生物技术检查均对新生儿AP的诊断缺乏特异性,但有助于与感染性胃肠炎、坏死性小肠结肠炎、败血症以及外科急腹症等新生儿严重疾病进行鉴别。电子结肠镜与病理学特征性改变对协助新生儿AP诊断有帮助。回避过敏原后患儿临床症状在1周内逐渐消失,临床结局良好。但本研究为回顾性描述分析,例数少,结果存在局限性,对于新生儿AP的临床特征、诊断、治疗以及预后等方面仍需进一步研究。
所有作者均声明不存在利益冲突



























