
比较早产儿和足月儿先天性乳糜胸的临床特点。
回顾性分析中国人民解放军总医院第七医学中心儿科医学部2011年1月至2019年12月收治的先天性乳糜胸患儿临床资料,并按照胎龄分成早产儿组(<37周)和足月儿组(≥37周),比较两组患儿一般资料、临床表现、实验室检查结果、治疗方式及预后。
共纳入34例先天性乳糜胸患儿,其中早产儿组11例,足月儿组23例。两组性别、分娩方式、产前诊断胸腔积液比例、伴有先天性心脏病/染色体异常、出生时窒息、呼吸困难、胎儿水肿、积液产生部位等方面差异均无统计学意义(P>0.05)。早产儿组胸水白细胞计数和蛋白含量均低于足月儿组[3 245(1 007,7 403)×106/L比10 214(6 233,16 458)×106/L,(28.1±7.6) g/L比(33.3±6.3) g/L],差异有统计学意义(P<0.05);两组胸水淋巴细胞比例差异无统计学意义(P>0.05)。早产儿组机械通气比例高于足月儿组[100%(11/11)比65.2%(15/23)],机械通气时间长于足月儿组[(16(10,25) d)比(1(0,11) d)],差异有统计学意义(P<0.05);两组其他治疗方式(穿刺/引流、禁食、加用奥曲肽及红霉素胸腔注入)、积液消失时间、住院时间和治愈/好转率等方面差异无统计学意义(P>0.05)。
早产儿胸水白细胞计数和蛋白含量低于足月儿,早产儿和足月儿胸水淋巴细胞比例均较高。尽管早产儿生后多需呼吸机支持,但预后良好,同足月儿无显著差异,多数经保守治疗痊愈。

新生儿先天性乳糜胸是由于淋巴管发育异常引起淋巴液回流障碍在胸腔异常积聚所致,是引起新生儿胸腔积液的最常见原因,常引起呼吸困难[1]。国外报道其发病率为1/24 000~1/10 000[2, 3],以早产儿多见,病死率可高达20%~50%,肺功能发育不全和感染是患儿死亡的主要原因[4]。国内报道以足月儿多见,早产儿报道较少。现将本院2011年1月至2019年12月诊治的早产儿先天性乳糜胸与足月儿先天性乳糜胸临床特点进行比较,以提高临床医生对早产儿先天性乳糜胸的诊治水平,改善患儿预后。
选取2011年1月至2019年12月在我院住院并诊断为先天性乳糜胸的患儿为研究对象,按胎龄分为早产儿组(<37周)和足月儿组(≥37周)。先天性乳糜胸诊断参考Al-Tawil等[5]定义的标准:(1)症状开始时日龄<28 d;(2)入院年龄<2个月;(3)存在胸腔积液;(4)胸水特点:培养无细菌生长,淋巴细胞≥80%,甘油三酯>1.24 mmol/L或外观呈牛奶样。排除发病前有脐静脉置管、深静脉置管、经外周静脉穿刺中心静脉置管、手术及外伤史的患儿。本研究经中国人民解放军总医院第七医学中心伦理委员会批准(2020-100)。
1.资料收集:通过电子病案管理系统查阅病历记录患儿一般资料(性别、胎龄、出生体重、分娩方式、是否产前诊断胸腔积液、先天性心脏病/染色体异常情况)、临床表现(是否有窒息、呼吸困难、胎儿水肿)、积液产生部位(左侧、右侧、双侧)、实验室检查结果(胸水白细胞计数、胸水淋巴细胞比例、胸水蛋白含量、血浆蛋白含量)、治疗方式(穿刺/引流、禁食、加用奥曲肽及红霉素胸腔注入、使用呼吸机、呼吸机使用时间)及预后(积液消失时间、住院时间、并发败血症及治愈/好转率)。
2.治疗原则:患儿入院后均进行胸腔穿刺或闭式引流,诊断明确后给予禁食、肠外营养等支持治疗,严重呼吸困难者给予呼吸机辅助呼吸,胸水量明显减少或消失后开奶,给予脱脂奶粉喂养,对禁食1~2周胸水仍反复出现、引流量大于15~20 ml/(kg·d)者给予奥曲肽0.3 ~6 μg/(kg·h)治疗,如治疗5~7 d后引流量仍大于15~20 ml/(kg·d),给予红霉素(红霉素30 mg/kg+25%葡萄糖10 ml)胸腔内注射。
应用SPSS 24.0统计软件对数据进行分析。正态分布的计量资料以表示,组间比较采用t检验;非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用非参数秩和检验;计数资料以例(%)表示,组间比较采用Fisher确切概率法。P<0.05为差异有统计学意义。
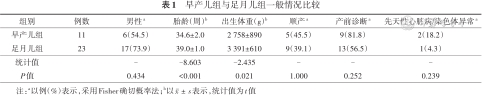
研究期间共收治先天性乳糜胸患儿41例,排除发病前脐静脉置管2例、外周中心静脉置管4例、动脉导管结扎术1例,共纳入34例。其中早产儿11例,足月儿23例,两组除胎龄和出生体重差异有统计学意义外,性别、分娩方式、产前发现胸腔积液比例及先天性心脏病/染色体异常方面差异均无统计学意义(P>0.05),早产儿组21三体综合征、DiGeorge综合征各1例,足月儿组部分性肺静脉异位引流1例。见表1。
早产儿组与足月儿组一般情况比较
早产儿组与足月儿组一般情况比较
| 组别 | 例数 | 男性a | 胎龄(周)b | 出生体重(g)b | 顺产a | 产前诊断a | 先天性心脏病/染色体异常a |
|---|---|---|---|---|---|---|---|
| 早产儿组 | 11 | 6(54.5) | 34.6±2.0 | 2 758±890 | 5(45.5) | 9(81.8) | 2(18.2) |
| 足月儿组 | 23 | 17(73.9) | 39.0±1.0 | 3 391±610 | 9(39.1) | 13(56.5) | 1(4.3) |
| 统计值 | - | -8.603 | -2.435 | - | - | - | |
| P值 | 0.434 | <0.001 | 0.021 | 1.000 | 0.252 | 0.239 |
注:a以例(%)表示,采用Fisher确切概率法;b以表示,统计值为t值
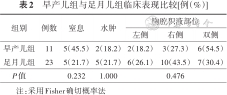
所有患儿均有呼吸困难,两组出生窒息、胎儿水肿、胸腔积液产生部位比较,差异均无统计学意义(P>0.05)。见表2。
早产儿组与足月儿组临床表现比较[例(%)]
早产儿组与足月儿组临床表现比较[例(%)]
| 组别 | 例数 | 窒息 | 水肿 | 胸腔积液部位 | ||
|---|---|---|---|---|---|---|
| 左侧 | 右侧 | 双侧 | ||||
| 早产儿组 | 11 | 5(45.5) | 2(18.2) | 2(18.2) | 3(27.3) | 6(54.5) |
| 足月儿组 | 23 | 5(21.7) | 5(21.7) | 6(26.1) | 10(43.5) | 7(30.4) |
| P值 | 0.232 | 1.000 | 0.476 | |||
注:采用Fisher确切概率法
早产儿组胸水白细胞计数、胸水蛋白含量、血浆蛋白含量均低于足月儿组,差异有统计学意义(P<0.05),两组淋巴细胞百分比差异无统计学意义(P>0.05)。见表3。

早产儿组与足月儿组实验室检查结果比较
早产儿组与足月儿组实验室检查结果比较
| 组别 | 例数 | 胸水白细胞 计数(×106/L)a | 胸水 淋巴细胞 百分比(%)a | 胸水蛋白含量(g/L)b | 血浆蛋白含量(g/L)b |
|---|---|---|---|---|---|
| 早产 儿组 | 11 | 3 245 (1 007,7 403) | 98.6 (95.7,99.1) | 28.1±7.6 | 30.3±1.4 |
| 足月 儿组 | 23 | 10 214 (6 233,16 458) | 98.8 (97.2,99.5) | 33.3±6.3 | 34.8±0.9 |
| 统计值 | -2.630 | -0.252 | -2.071 | 2.795 | |
| P值 | 0.013 | 0.804 | 0.047 | 0.009 |
注:a以M(Q1,Q3)表示,统计值为Z值;b以表示,统计值为t值
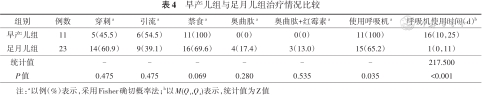
早产儿组使用呼吸机比例高于足月儿组,呼吸机使用时间长于足月儿组,差异有统计学意义(P<0.05)。早产儿组全部采取单纯禁食的治疗方式,足月儿组4例在禁食的基础上加用奥曲肽,3例采用奥曲肽联合红霉素治疗的方式,两组奥曲肽治疗方式差异无统计学意义(P>0.05)。见表4。
早产儿组与足月儿组治疗情况比较
早产儿组与足月儿组治疗情况比较
| 组别 | 例数 | 穿刺a | 引流a | 禁食a | 奥曲肽a | 奥曲肽+红霉素a | 使用呼吸机a | 呼吸机使用时间(d)b |
|---|---|---|---|---|---|---|---|---|
| 早产儿组 | 11 | 5(45.5) | 6(54.5) | 11(100) | 0(0) | 0(0) | 11(100) | 16(10,25) |
| 足月儿组 | 23 | 14(60.9) | 9(39.1) | 16(69.6) | 4(17.4) | 3(13.0) | 15(65.2) | 1(0,11) |
| 统计值 | - | - | - | - | - | - | 217.500 | |
| P值 | 0.475 | 0.475 | 0.069 | 0.280 | 0.535 | 0.035 | <0.001 |
注:a以例(%)表示,采用Fisher确切概率法;b以M(Q1,Q3)表示,统计值为Z值
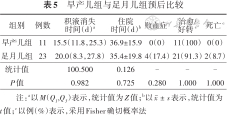
早产儿组积液消失时间和住院时间与足月儿组差异无统计学意义(P>0.05)。足月儿组4例住院期间并发败血症,但两组差异无统计学意义(P>0.05),早产儿组1例好转出院,足月儿组4例好转出院,出院后随访时,均于3个月内积液完全消失,尽管足月儿组2例放弃治疗后死亡(1例败血症、1例染色体异常),但两组治愈/好转率差异无统计学意义(P>0.05)。见表5。
早产儿组与足月儿组预后比较
早产儿组与足月儿组预后比较
| 组别 | 例数 | 积液消失 时间(d)a | 住院 时间(d)b | 败血症c | 治愈/ 好转c | 死亡c |
|---|---|---|---|---|---|---|
| 早产儿组 | 11 | 15.5(11.8,25.3) | 36.9±15.9 | 0(0) | 11(100) | 0(0) |
| 足月儿组 | 23 | 20.0(8.3,27.8) | 35.4±19.8 | 4(17.4) | 21(91.3) | 2(8.7) |
| 统计值 | 100.500 | 0.126 | - | - | - | |
| P值 | 0.982 | 0.725 | 0.280 | 1.000 | 1.000 |
注:a以M(Q1,Q3)表示,统计值为Z值;b以表示,统计值为t值;c以例(%)表示,采用Fisher确切概率法
先天性乳糜胸发病机制尚未完全清楚,可能与淋巴管发育异常相关,如胸导管缺如、畸形、梗阻等。生理情况下,胸导管起源于第2腰椎水平处的乳糜池,经膈肌主动脉裂孔进入胸腔后转至中线右侧,在第5或第6胸椎水平转至左侧,最终在左颈内静脉与锁骨下静脉连接处进入静脉。胸导管在胚胎时期是双侧结构,在发育过程中,经过一定程度的闭合和退化发展为不同的解剖学类型,且伴有许多淋巴静脉吻合口[6]。淋巴管发育异常的部位决定了胸腹腔乳糜性积液产生的部位[7]。国内报道先天性乳糜胸以足月儿为主,右侧多见,国外报道多为早产儿,以双侧多见。本组资料早产儿组以双侧多见,足月儿组以右侧多见,与既往报道相符,但两组产生积液部位差异无统计学意义,可能与样本量小有关。既往报道先天性乳糜胸患儿多伴其他先天性疾病,如先天性心脏病、21三体综合征、Noonan综合征、Turner综合征、先天性甲状腺功能减退症等,乳糜胸与伴发疾病的关系尚不明确[2, 5, 8]。本组资料早产儿组21三体综合征、DiGeorge综合征各1例,足月儿组部分性肺静脉异位引流1例,两组差异无统计学意义。
先天性乳糜胸的诊断主要根据胸水实验室检查,胸水中含有大量淋巴细胞、蛋白质及脂质消化产物(乳糜微粒)。本研究中,早产儿组血浆蛋白含量和胸水蛋白含量明显低于足月儿组,这是由于早产儿自身发育不完善,肝脏合成蛋白水平较低,而淋巴液为漏出液,故导致胸水中蛋白水平低于足月儿[9, 10]。早产儿胸水中白细胞计数明显低于足月儿,这可能与血白细胞计数随出生胎龄增加而升高有关[11],且早产儿胸水中蛋白含量较低,其胶体渗透压低于足月儿,可能存在稀释性减低。早产儿组和足月儿组胸水中的淋巴细胞比例均较高,故胸水中淋巴细胞比例增高对于先天性乳糜胸具有重要诊断意义[12]。
先天性乳糜胸可在宫内即发现胎儿胸腔积液,新生儿生后24 h内出现呼吸急促、呼吸困难、胸腔积液,多需呼吸支持[4,13]。本组患儿大部分宫内发现胸腔积液,生后均有不同程度的呼吸困难,所有早产儿及多数足月儿需呼吸支持。早产儿组机械通气比例高于足月儿组、机械通气时间长于足月儿组,这与早产儿本身肺发育不如足月儿有关。
先天性乳糜胸多采用禁食、营养支持、药物、胸腔穿刺/引流、呼吸支持等保守治疗,治愈率可达80%,保守治疗无效可外科手术治疗[14]。乳糜胸患儿一经诊断,可早期禁食,也可给予脱脂奶或富含中链甘油三酯的配方奶喂养,禁食时间应结合病情、胸水量及临床症状而定,不宜过长。中链甘油三酯配方奶可喂养6个月,胸腔积液无反复可改为普通配方奶喂养并添加辅食[15]。本组资料中,早产儿组均采用早期禁食及肠外营养保守治疗即达到治愈/好转出院,而足月儿组部分病例在禁食基础上需加用奥曲肽,或奥曲肽联合红霉素治疗才达到治愈/好转出院。尽管奥曲肽对于新生儿乳糜胸的疗效仍存在争议[14,16],但大多数研究证实其安全有效[17, 18, 19],临床上已普遍将该药作为二线用药。本组资料显示早产儿先天性乳糜胸较足月儿更容易治疗,但两组差异无统计学意义,还需要加大样本研究。王斯瑶[20]报道的足月儿先天性乳糜胸预后明显好于早产儿,早产儿病死率较高的原因可能与家属因早产儿预后不良放弃治疗有关。本组资料早产儿组和足月儿组治愈/好转率差异无统计学意义,这与Consigli等[4]的观点一致,早产对先天性乳糜胸病死率没有显著影响。也有研究认为早产、低出生体重是先天性乳糜胸患儿死亡的高危因素[13]。有研究显示,胎龄<34周的早产儿先天性乳糜胸病死率高达87.5%[21]。本研究中早产儿组与足月儿组预后没有差异的原因可能与早产儿组平均胎龄较大有关。由于本病临床少见,本研究样本量小,且为回顾性研究,仍需进一步多中心研究来评估。
综上所述,产前超声提示胸腔积液者需警惕新生儿先天性乳糜胸,尽管早产儿生后多需呼吸机支持,但预后良好,与足月患儿无明显差异,多数经保守治疗痊愈,早期诊断、及时综合治疗至关重要。
所有作者均声明不存在利益冲突



























