
采用Meta分析方法评价吸入一氧化氮(inhaled nitric oxide,iNO)治疗胎龄≤34周、需呼吸支持早产儿的临床效果。
检索PubMed、Embase、Cochrane图书馆和中国知网、中国生物医学文献数据库、万方及维普数据库,检索时间自建库至2020年6月,搜集胎龄≤34周、需要呼吸支持早产儿iNO治疗的随机对照研究(randomized controlled study,RCT),采用Cochrane偏倚分析工具对纳入文献质量进行评价,应用RevMan 5.3软件进行Meta分析。
共纳入17篇RCT英文文献,共4 033例早产儿。Meta分析结果显示,iNO组住院期间病死率与对照组差异无统计学意义(RR=1.00,95%CI 0.89~1.11,P=0.930),校正胎龄36周时支气管肺发育不良(bronchopulmonary dysplasia,BPD)发生率低于对照组(RR=0.89,95%CI 0.82~0.97,P=0.006)。亚组分析结果显示,出生体重>1 000 g早产儿iNO组病死或BPD总发生率低于对照组(RR=0.72,95%CI 0.58~0.89,P=0.002);生后≤7 d开始给予iNO组BPD发生率低于对照组(RR=0.83,95%CI 0.70~0.98,P=0.030);iNO起始剂量5 ppm组或≥10 ppm组BPD发生率均低于对照组(RR=0.89,95%CI 0.81~0.98,P=0.020;RR=0.90,95%CI 0.81~0.99,P=0.030);iNO ≤7 d组和>7 d组BPD发生率低于对照组(RR=0.77,95%CI 0.60~0.99,P=0.040;RR=0.87,95%CI 0.77~0.97,P=0.010)。iNO组机械通气时间、颅内出血发生率与对照组差异均无统计学意义(P>0.05);iNO组氧合指数下降幅度大于对照组(WMD=-6.32,95%CI -12.16~-0.48,P=0.030)。
胎龄≤34周需要呼吸支持早产儿进行iNO治疗可以改善氧合、降低BPD发生风险,生后7 d内开始治疗及出生体重>1 000 g者BPD发生风险明显降低,对病死率、机械通气时间、颅内出血发生率无明显影响。

吸入一氧化氮(inhaled nitric oxide,iNO)可改善足月和近足月新生儿持续低氧性呼吸衰竭(hypoxic respiratory failure,HRF)患儿氧合并减少体外膜肺氧合使用率[1],美国食品药品监督管理局已批准iNO用于胎龄≥34周新生儿HRF和持续性肺动脉高压(persistent pulmonary hypertension of the newborn,PPHN)的治疗[2]。由于早产儿iNO疗效不确切且可能抑制血小板凝聚而增加颅内出血风险,美国国家卫生研究院不建议给予早产儿iNO治疗[3]。但近年来早产儿iNO超指征试验性应用仍呈上升趋势[4, 5]。本文采用系统评价和Meta分析的方法探讨可能影响早产儿iNO疗效的因素,从不同角度评估早产儿iNO的临床效果,为临床决策提供依据。
通过计算机检索PubMed、Embase、Cochrane图书馆、中国知网、中国生物医学文献数据库、万方及维普数据库,检索时间自建库至2020年6月,检索语种为中文和英文,搜集早产儿iNO治疗的随机对照研究(randomized controlled study,RCT)。采用主题词和自由词相结合的方式,并追溯纳入文献的参考文献。中文检索词:支气管肺发育不良、早产儿、早产、新生儿、吸入一氧化氮、一氧化氮;英文检索词:bronchopulmonary dysplasia,preterm,premature,infant,newborn,inhaled nitric oxide,nitric oxide,NO,iNO。
1.纳入标准:(1)研究类型:RCT;(2)研究对象:接受呼吸支持(机械通气或持续气道正压通气)且胎龄≤34周的早产儿;(3)对照组给予常规治疗(如肺表面活性物质、呼吸支持等),iNO组为常规治疗联合iNO治疗。
2.排除标准:(1)非中、英文文献;(2)无法获取数据或数据不完整的文献。
1.资料提取:由2名研究者独立筛选文献、提取资料并交叉核对。如有分歧,则通过讨论或与第3方协商解决。资料提取内容包括:(1)纳入研究的题目、第一作者、发表年份、发表杂志等。(2)研究对象和入组日龄,iNO起始及最大剂量、疗程、随访时间、疗效。(3)偏倚风险评价的关键要素。(4)所关注的结局指标和结果测量数据。对于连续性变量,若原文献只提供中位数或四分位数,则参照文献通过公式转化为均数和标准差[6]。(5)疗效评价指标:主要指标包括住院期间病死率、校正胎龄36周时BPD发生率,次要指标包括机械通气持续时间、iNO治疗前后氧合指数(oxygenation index,OI)下降幅度、颅内出血(所有级别)发生率。(6)根据出生体重>1 000 g或≤1 000 g、治疗开始时间在生后7 d内或超过7 d、开始治疗剂量5 ppm或≥10 ppm、暴露时间≤7 d和>7 d分别提取数据进行亚组分析。
2.文献质量评价:由2名研究者独立进行。如有分歧,则通过讨论或与第3方协商解决。RCT研究采用Cochrane系统评价手册文献质量评价标准[7]:(1)随机化分组是否恰当;(2)有无分配隐藏,方法是否正确;(3)实施者与参与者是否双盲;(4)结果评估中的盲法;(5)结局数据是否完整;(6)发表偏倚;(7)是否存在其他偏倚来源。每项指标按发生偏倚分为低风险、不确定风险、高风险3级。7项指标均为低风险的文献被评估为有低偏倚风险,认为是高质量文献;有1项以上指标为不确定风险的文献被评估为有不明确的偏倚风险;有1项以上指标为高风险的文献被评估为高偏倚风险。
应用RevMan 5.3统计软件对数据进行Meta分析。通过χ2检验和I2检验进行异质性分析,若I2≤50%且P≥0.1,则各研究间具有统计学同质性,采用固定效应模型;若I2>50%或P<0.1,则进行敏感度分析,改变入选文献标准并再进行效应量合并。若改变后I2≤50%且P≥0.1,则视为排除异质性来源,采用固定效应模型;若仍为I2>50%或P<0.1则说明该分析敏感度低,各研究间具有统计学异质性,采用随机效应模型。计数资料采用相对危险度(relative risk,RR)和95%可信区间(confidence interval,CI)评价,计量资料采用加权均数差(weighted mean difference,WMD)和95%CI评价。P<0.05为差异有统计学意义。采用漏斗图定性评估发表偏倚。
通过数据库检索获得相关文献2 950篇,其中中文文献269篇(中国知网82篇,中国生物医学文献数据库79篇,万方数据库55篇,维普数据库53篇),英文文献2 681篇(PubMed 476篇,Embase 1 503篇,Cochrane图书馆702篇),删除重复文献后获得2 658篇。阅读标题和摘要后删除综述、荟萃分析、动物实验等2 451篇;阅读全文筛选并进行文献质量评价,删除无法提取数据文献174篇、重复数据文献2篇、病例对照研究文献4篇、队列研究3篇、随访文献7篇,最终纳入17篇RCT研究[8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24],均为英文文献,共4 033例早产儿。见表1。
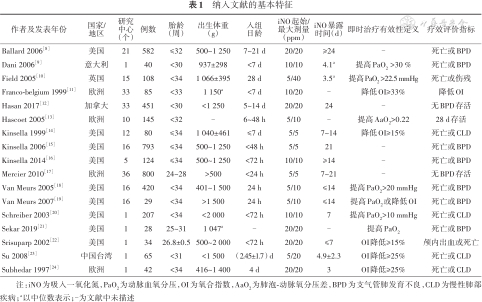
纳入文献的基本特征
纳入文献的基本特征
| 作者及发表年份 | 国家/ 地区 | 研究中心(个) | 例数 | 胎龄(周) | 出生体重 (g) | 入组 日龄 | iNO起始/最大剂量(ppm) | iNO暴露 时间(d) | 即时治疗有效性定义 | 疗效评价指标 |
|---|---|---|---|---|---|---|---|---|---|---|
| Ballard 2006[8] | 美国 | 21 | 582 | ≤32 | 500~1 250 | 7~21 d | 20/20 | ≥24 | - | 死亡或BPD |
| Dani 2006[9] | 意大利 | 1 | 40 | <30 | 937±298 | <7 d | 10/10 | 4.1a | 提高PaO2 >30 % | 死亡或BPD |
| Field 2005[10] | 英国 | 15 | 108 | <34 | 1 066±395 | 28 d | 5/40 | 3.5a | 提高PaO2 >22.5 mmHg | 死亡或伤残 |
| Franco-belgium 1999[11] | 欧洲 | 33 | 85 | <33 | 1 150a | <7 d | 10/20 | - | 降低OI≥33% | 降低OI |
| Hasan 2017[12] | 加拿大 | 33 | 451 | <30 | <1 250 | 5~14 d | 20/20 | 24 | - | 无BPD存活 |
| Hascoet 2005[13] | 欧洲 | 10 | 145 | <32 | - | 6~48 h | 5/10 | - | 提高AaO2>0.22 | 28 d存活 |
| Kinsella 1999[14] | 美国 | 12 | 80 | ≤34 | 1 040±461 | ≤7 d | 5/5 | 7~14 | 降低OI≥15% | 死亡或CLD |
| Kinsella 2006[15] | 美国 | 16 | 793 | ≤34 | 500~1 250 | <48 h | 5/5 | 21 | - | 死亡或BPD |
| Kinsella 2014[16] | 美国 | 5 | 124 | ≤34 | 500~1 250 | <72 h | 10/10 | ≥14 | - | 死亡或BPD |
| Mercier 2010[17] | 欧洲 | 36 | 800 | 24~28 | >500 | <24 h | 5/5 | 7~21 | - | 无BPD存活 |
| Van Meurs 2005[18] | 美国 | 16 | 420 | <34 | 401~1 500 | 24 h | 5/10 | ≤14 | 提高PaO2>20 mmHg | 死亡或BPD |
| Van Meurs 2007[19] | 美国 | 16 | 29 | <34 | >1 500 | 24 h | 5/10 | ≤14 | 提高PaO2或降低OI | 死亡或BPD |
| Schreiber 2003[20] | 美国 | 1 | 207 | <34 | <2 000 | <72 h | 10/10 | 7 | 提高PaO2>10 mmHg | 死亡或CLD |
| Sekar 2019[21] | 美国 | 1 | 28 | 25~31 | 1 047a | - | 20/20 | - | 提高PaO2 | 死亡或BPD |
| Srisuparp 2002[22] | 美国 | 1 | 34 | 26.8±0.5 | 500~2 000 | <72 h | 20/20 | ≤7 | OI降低≥15% | 颅内出血或死亡 |
| Su 2008[23] | 中国台湾 | 1 | 65 | <31 | <1 500 | (2.45±1.7) d | 5/20 | 4.9±2.3 | OI降低≥25% | 死亡或CLD |
| Subhedar 1997[24] | 欧洲 | 1 | 42 | <34 | 416~1 400 | 4 d | 20/20 | 3 | OI降低≥25% | 死亡或CLD |
注:iNO为吸入一氧化氮,PaO2为动脉血氧分压,OI为氧合指数,AaO2为肺泡-动脉氧分压差,BPD为支气管肺发育不良,CLD为慢性肺部疾病;a以中位数表示;-为文献中未描述
1. 文献质量偏倚风险评价:本次纳入的17项RCT研究中,8项有低偏倚风险[8,12,16, 17, 18, 19, 20, 21],5项有不确定的偏倚风险[10, 11,15,22,24],4项有较高的偏倚风险[9,13, 14,23]。
2. 发表偏倚:15篇文献评价iNO对早产儿病死率的影响[8, 9,11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23],漏斗图结果显示大部分研究位于漏斗上部,未见明显不对称,提示不存在明显发表偏倚。
1. iNO对病死率的影响:15项研究报道iNO组和对照组住院期间病死率情况,异质性检验显示各研究间异质性不大(I2=0%,PQ=0.46),采用固定效应模型,Meta分析结果显示,iNO组病死率与对照组差异无统计学意义(RR=1.00,95%CI 0.89~1.11,P=0.930)。见图1。
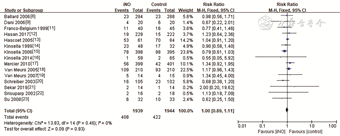

注:iNO为吸入一氧化氮
2. iNO对校正胎龄36周时BPD发生率的影响:14项研究报道iNO组和对照组BPD发生率情况,异质性检验显示各研究间异质性不大(I2=0%,PQ=0.52),采用固定效应模型,Meta分析结果显示,iNO组BPD发生率低于对照组,差异有统计学意义(RR=0.89,95%CI 0.82~0.97,P=0.006)。见图2。
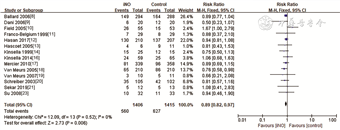

注:iNO为吸入一氧化氮,BPD为支气管肺发育不良
3. 按照出生体重亚组分析iNO对BPD或死亡的影响:出生体重>1 000 g时iNO组BPD或死亡总发生率低于对照组,差异有统计学意义(P=0.002);≤1 000 g时两组差异无统计学意义。见表2。

iNO对早产儿BPD或死亡影响的亚组分析
4. 按照入组日龄亚组分析iNO对BPD的影响:入组日龄≤7 d时iNO组BPD发生率低于对照组,差异有统计学意义(P=0.030);>7 d时两组差异无统计学意义。见表3。
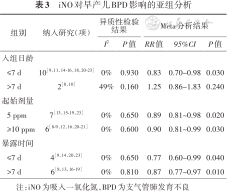
iNO对早产儿BPD影响的亚组分析
iNO对早产儿BPD影响的亚组分析
| 组别 | 纳入研究(项) | 结果 异质性检验 | Meta分析结果 | |||
|---|---|---|---|---|---|---|
| I2 | P值 | RR值 | 95%CI | P值 | ||
| 入组日龄 | ||||||
≤7 d | 10[9,11,14, 15, 16,18,20, 21, 22, 23] | 0% | 0.930 | 0.83 | 0.70~0.98 | 0.030 |
>7 d | 2[8,10] | 49% | 0.160 | 1.25 | 0.86~1.83 | 0.240 |
| 起始剂量 | ||||||
5 ppm | 7[13,15, 16, 17, 18, 19,23] | 0% | 0.650 | 0.89 | 0.81~0.98 | 0.020 |
≥10 ppm | 6[8, 9,12,16,20, 21] | 0% | 0.600 | 0.90 | 0.81~0.99 | 0.030 |
| 暴露时间 | ||||||
≤7 d | 4[9,14,20,23] | 0% | 0.650 | 0.77 | 0.60~0.99 | 0.040 |
>7 d | 6[8,13,16, 17, 18, 19] | 0% | 0.810 | 0.87 | 0.77~0.97 | 0.010 |
注:iNO为吸入一氧化氮,BPD为支气管肺发育不良
5. 按照起始剂量亚组分析iNO对BPD的影响:起始剂量为5 ppm和≥10 ppm时iNO组BPD发生率均低于对照组,差异有统计学意义(P=0.020,P=0.030)。见表3。
6. 按照暴露时间亚组分析iNO对BPD的影响:暴露时间≤7 d和>7 d时iNO组BPD发生率均低于对照组,差异有统计学意义(P=0.040,P=0.010)。见表3。
7.iNO对机械通气时间的影响:iNO组机械通气时间与对照组差异无统计学意义(P>0.05)。见表4。
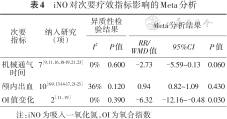
iNO对次要疗效指标影响的Meta分析
8.iNO对颅内出血的影响:iNO组颅内出血发生率与对照组差异无统计学意义(P>0.05)。见表4。
9.iNO治疗前后OI值变化情况:iNO组OI值下降幅度大于对照组,差异有统计学意义(P=0.030)。见表4。
iNO疗法已成为足月和近足月新生儿HRF和PPHN的常规治疗方法[25, 26]。由于早产儿外周肺血管发育相对不成熟,远端肺小动脉平滑肌较少,凝血功能发育不完善等,iNO是否可同样迅速改善早产儿氧合和预后而不增加并发症发生风险,是临床上关注的重点。本研究结果显示,胎龄≤34周需呼吸支持早产儿给予iNO治疗可能有助于改善氧合、降低BPD发生风险,但对机械通气时间、颅内出血、住院期间病死率无明显影响。
一项澳大利亚和新西兰的调查显示,几乎所有新生儿重症监护室都将iNO作为HRF早产儿的早期抢救措施[27]。Van Meurs等[18]研究表明,出生体重>1 000 g早产儿iNO治疗可减少病死率及BPD发生率,但对于出生体重<1 000 g者,病死率及重度颅内出血发生率反而升高。Kinsella等[15]研究显示,5 ppm iNO治疗虽未能降低出生体重500~1 250 g呼吸衰竭早产儿病死率和BPD发生率,但显著降低了1 000~1 250 g早产儿BPD发生率。本研究根据出生体重进行亚组分析,结果显示,iNO治疗降低了>1 000 g早产儿病死或BPD总发生率。但Hasan等[12]对451例胎龄<30周、出生体重<1 250 g高危早产儿生后第5至14天开始20 ppm iNO的治疗,并没有降低BPD发生风险,这可能与此组患儿平均胎龄(25.6周)、平均出生体重(750 g)较低有关。因此,抢救性iNO治疗并非适用于所有早产儿,尤其对超低出生体重儿可能效果欠佳。
生后早期iNO可以改善肺表面活性物质活性、促进肺血管生成和肺泡化、降低气道阻力、减轻高氧性肺损伤[28]。Srisuparp等[22]对进行机械通气的早产儿生后72 h内给予iNO治疗,降低了病死或BPD发生率。复旦大学附属儿科医院主持的多中心研究,对机械通气或无创正压通气早产儿在生后7 d开始低剂量iNO,并未降低死亡或BPD总体风险[29]。本研究按照入组日龄进行亚组分析显示,生后≤7 d开始iNO治疗可降低BPD发生风险,>7 d无明显统计学差异。因此,当呼吸支持等治疗措施效果不佳时,尽早给予iNO可能改善早产儿不良临床结局。
关于iNO剂量-反应的关系目前尚无确切定论。美国一项多中心研究发现,不同剂量iNO治疗PPHN的临床效果无差异,且低剂量iNO治疗安全有效[30]。我国一项多中心研究建议,足月和晚期早产儿iNO 治疗初始剂量均为10 ppm,如无反应可增至20 ppm,早期早产儿则一直为5 ppm[31]。马群英等[32]的Meta分析建议,早产儿iNO治疗的最佳剂量为5~20 ppm。本研究结果显示5 ppm和≥10 ppm iNO治疗早产儿发生BPD风险均降低。因此,胎龄≤34周早产儿iNO治疗可以从5 ppm开始,如无反应可逐渐上调剂量。
本研究也存在一定的局限性:(1)纳入文献总体质量不高,5项研究存在不确定偏倚风险,4项研究存在较高偏倚风险,可能存在一定的实施和测量偏倚;(2)纳入研究均为英文文献,我国内地的干预性研究较多[33, 34],文献质量较低,未纳入本次分析;(3)纳入文献的患儿基线不统一,可能会对结果造成一定影响。综上所述,不同早产儿iNO临床研究的结局不同,这与胎龄、出生体重、开始治疗时间、治疗剂量及暴露时间等多种因素有关。生后早期iNO可作为出生体重>1 000 g HRF早产儿的辅助性抢救措施之一。但我国目前还缺少多中心大样本的临床研究,有待进一步研究和随访。
所有作者均声明不存在利益冲突



























