
探讨新生儿休克评分与脓毒性休克评分(septic shock score,SSS)对新生儿难治性脓毒性休克发生死亡与严重并发症的评估和使用价值。
选择2019年1月至2020年11月在广东省妇幼保健院新生儿科住院的脓毒性休克新生儿进行回顾性分析,根据结局将患儿分为预后良好组和预后不良组,根据休克病程中各指标最差值计算新生儿休克评分和SSS,SSS又分为计算式脓毒性休克评分(computed septic shock scores,cSSS)与床边脓毒性休克评分(bedside septic shock scores,bSSS),采用受试者工作特征曲线分析两种评分方法对脓毒性休克发生不良风险的评估效能,Spearman秩相关分析新生儿休克评分和SSS与血管活性药物使用时间的相关性。
共纳入72例患儿,预后良好组45例,预后不良组27例。预后不良组患儿的血管活性药物评分、血乳酸、新生儿休克评分和cSSS均明显高于预后良好组(P<0.05),两组bSSS评分比较差异无统计学意义(P>0.05)。新生儿休克评分和cSSS预测脓毒性休克新生儿发生不良预后的曲线下面积分别为0.644(95%CI 0.510~0.777,P<0.05)和0.765(95%CI 0.654~0.877,P<0.05),新生儿休克评分和cSSS预测发生不良预后的最佳截断值分别为4.0和80.5,cSSS的阳性预测值(81.3%比47.5%)和阴性预测值(75.0%比70.6%)均高于新生儿休克评分。Spearman秩相关分析显示,cSSS与血管活性药物使用时间成正相关(r=0.487,P<0.01)。
两种休克评分系统对脓毒性休克新生儿预后均具有一定的评估价值,cSSS的评估价值优于新生儿休克评分,可作为评估新生儿难治性脓毒性休克的主要辅助工具。

世界卫生组织与2019年联合国儿童基金会数据显示,46%的5岁以下儿童死亡发生在新生儿期,其中60%以上由感染性疾病引起[1, 2]。脓毒性休克是新生儿和儿童死亡的主要原因[3],特别是难治性脓毒性休克(refractory septic shock,RSS)病死率高达40%~80%[4, 5]。2017年一项研究显示RSS是脓毒性休克儿童死亡的首要原因[6],因此RSS的成功诊治是降低脓毒性休克患儿病死率的重要手段。2016年欧洲儿科和新生儿重症监护协会提出了脓毒性休克评分(septic shock score,SSS),以便早期诊治RSS[7]。但这一评分多用于儿童,在新生儿领域的应用价值还需验证。本研究回顾性分析我院新生儿重症监护病房(neonatal intensive care unit,NICU)脓毒性休克新生儿的临床资料,探讨SSS与新生儿休克评分在评估新生儿脓毒性休克预后和临床决策中的价值,以期为新生儿RSS的诊治提供依据。
回顾性选择2019年1月至2020年11月广东省妇幼保健院NICU收治的脓毒性休克新生儿为研究对象。排除标准:(1)除卵圆孔未闭与无血流动力学意义的动脉导管未闭外的先天性心脏病患儿;(2)存在致死性先天畸形或怀疑先天性遗传代谢性疾病的患儿;(3)缺少功能性超声心动图资料的患儿。本研究通过我院伦理委员会批准(202001115)。根据患儿预后分为2组,存活且未发生严重并发症的患儿纳入预后良好组,28 d内死亡、因脓毒性休克继发严重并发症的患儿纳入预后不良组。
1.资料收集:通过查阅电子病历记录患儿临床资料,包括性别、胎龄、出生体重、实验室检查结果、影像学结果、临床结局等。
2.脓毒性休克诊断标准[8, 9]:脓毒症伴心功能不全,血压低于同龄儿正常血压的第5百分位或收缩压低于同龄儿正常血压2个标准差,或需要使用血管活性药物[多巴胺>5 μg/(kg·min)或任何剂量的多巴酚丁胺或肾上腺素]维持血压,或具有以下任意2条:(1)不能解释的代谢性酸中毒;(2)血乳酸(lactates,LAC)高于正常上限的2倍;(3)尿量<0.5 ml/(kg·h);(4)毛细血管充盈时间>5 s;(5)中心体温和周围体温相差3℃以上。
3.休克评分计算:根据各指标的最差值计算新生儿休克评分与SSS。(1)新生儿休克评分[10]:从皮肤颜色、皮肤循环、四肢温度、股动脉搏动、收缩压5个方面评估,每项0~2分,3分为轻度休克,4~6分为中度休克,7~10分为重度休克。(2)SSS评分[7]:分为计算式脓毒性休克评分(computed septic shock scores,cSSS)与床边脓毒性休克评分(bedside septic shock scores,bSSS)。涉及血管活性药物评分(vaso-inotrope score,VIS)、LAC、心脏指数(cardiac index,CI)与射血分数(ejection fraction,EF),按以下公式进行计算:①VIS=多巴胺剂量+多巴酚丁胺剂量+[(去甲肾上腺素剂量+肾上腺素剂量)×100]+(米力农剂量×10)[血管活性药物剂量单位均为μg/(kg·min)];②CI=每搏输出量×心率/[(0.035×体重+0.1)×1 000];③cSSS=1.001VIS+1.1LAC(mmol/L)+18×[心跳骤停或EF<25%或CI<2.2 L/(min·m2)],考虑此公式不便于临床计算,故改良为cSSS=1.001×VIS+1.1×LAC(mmol/L)+18×[心跳骤停或EF<25%或CI<2.2 L/(min·m2),符合1项或1项以上即为“1”,均无为“0”];④bSSS:VIS>200得1分,LAC>8 mmol/L得1分,心跳骤停或EF<25%或CI<2.2 L/(min·m2)得3分。
4.结局指标:严重并发症包括心跳骤停、肺出血、持续肺动脉高压、多器官功能障碍、弥散性血管内凝血、Ⅲ级及以上颅内出血与脑室周围白质软化,诊断标准均参照《实用新生儿学》第5版[10]。
应用SPSS 23.0统计软件进行数据分析。正态分布的计量资料以±s表示,组间比较采用单因素方差分析,两两比较采用最小显著性法(least- significant difference,LSD)t检验;非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用秩和检验;计数资料以例(%)表示,组间比较采用χ2检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析两种评分方法评估脓毒性休克发生不良预后风险的效能,Spearman秩相关分析休克相关指标、新生儿休克评分和SSS与血管活性药物使用时间的相关性。P<0.05为差异有统计学意义。
研究期间共收治新生儿13 758例,诊断脓毒性休克154例,排除有血流动力学意义的动脉导管未闭12例、先天性发育畸形4例、疑似遗传代谢性疾病或染色体病3例、缺少功能性超声心动图资料63例,最终纳入72例,男婴54例(75.0%),早产儿43例(59.7%),胎龄(34.7±4.4)周,出生体重(2 315±958)g,中位起病日龄2 d。
72例患儿中,预后良好组45例(62.5%),预后不良组27例(37.5%),轻度休克32例(44.4%)、中度休克36例(50.0%)、重度休克4例(5.6%);肺出血10例(13.9%)、持续性肺动脉高压15例(20.8%)、多器官功能障碍7例(9.7%)、弥散性血管内凝血9例(12.5%)、Ⅲ级及以上颅内出血8例(11.1%)、脑室周围白质软化4例(5.6%)、心跳骤停7例(9.7%),28 d内死亡14例(19.4%)。
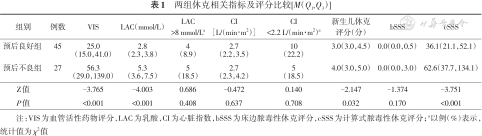
预后不良组VIS、LAC、新生儿休克评分及cSSS高于预后良好组,差异有统计学意义(P<0.05);两组LAC>8 mmol/L比例、CI、CI<2.2 L/(min·m2)比例及bSSS比较差异无统计学意义(P>0.05)。见表1。
两组休克相关指标及评分比较[M(Q1,Q3)]
两组休克相关指标及评分比较[M(Q1,Q3)]
| 组别 | 例数 | VIS | LAC(mmol/L) | LAC>8 mmol/La | CI[L/(min∙m2)] | CI<2.2 L/(min·m2)a | 新生儿休克评分(分) | bSSS | cSSS |
|---|---|---|---|---|---|---|---|---|---|
| 预后良好组 | 45 | 25.0(15.0,41.0) | 2.8 (2.3,3.8) | 4 (8.9) | 2.7 (2.2,3.5) | 10 (22.2) | 3.0(3.0,4.5) | 0.0(0.0,0.5) | 36.1(21.1,52.1) |
| 预后不良组 | 27 | 56.3(29.0,139.0) | 5.3 (3.6,7.5) | 5 (18.5) | 2.7 (2.3,4.2) | 5 (18.5) | 4.0(3.0,5.0) | 0.0(0.0,3.0) | 62.6(37.7,134.1) |
| Z值 | -3.765 | -4.003 | 0.686 | -0.472 | 0.140 | -2.147 | -1.374 | -3.751 | |
| P值 | <0.001 | <0.001 | 0.408 | 0.637 | 0.708 | 0.032 | 0.170 | <0.001 |
注:VIS为血管活性药物评分,LAC为乳酸,CI为心脏指数,bSSS为床边脓毒性休克评分,cSSS为计算式脓毒性休克评分;a以例(%)表示,统计值为χ2值
32例轻度休克患儿中,8例(25.0%)预后不良,VIS[32.8(22.0,39.6)比16.8(10.8,25.0)]高于预后良好新生儿,差异有统计学意义(P<0.05)。36例中度休克患儿中,15例(41.7%)预后不良,VIS[(95.8±54.2)比(40.1±22.6)]、LAC[7.3(4.1,13.6)mmol/L比3.3(2.7,4.5)mmol/L]及cSSS[(115.3±59.4)比(49.2±23.2)]高于预后良好新生儿,差异有统计学意义(P<0.05)。4例重度休克患儿均预后不良。
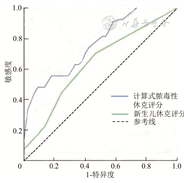
绘制新生儿休克评分及cSSS估测脓毒性休克新生儿预后不良的ROC曲线,结果显示,新生儿休克评分≥4.0与预后不良相关(曲线下面积=0.644,95%CI 0.510~0.777,P=0.042),阴性预测值为70.6%,阳性预测值为47.5%;cSSS>80.5与预后不良相关(曲线下面积=0.765,95%CI 0.654~0.877,P<0.01),阴性预测值为75.0%,阳性预测值为81.3%。见图1。

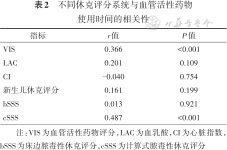
Spearman秩相关检验结果显示VIS(r=0.366)、cSSS(r=0.487)与血管活性药物使用时间成正相关(P<0.05);LAC、CI、新生儿休克评分、bSSS与血管活性药物使用时间无相关性。见表2。
不同休克评分系统与血管活性药物使用时间的相关性
不同休克评分系统与血管活性药物使用时间的相关性
| 指标 | r值 | P值 |
|---|---|---|
| VIS | 0.366 | <0.001 |
| LAC | 0.201 | 0.109 |
| CI | -0.040 | 0.754 |
| 新生儿休克评分 | 0.161 | 0.199 |
| bSSS | 0.013 | 0.921 |
| cSSS | 0.487 | <0.001 |
注:VIS为血管活性药物评分,LAC为血乳酸,CI为心脏指数,bSSS为床边脓毒性休克评分,cSSS为计算式脓毒性休克评分
脓毒性休克指严重感染导致的心血管功能障碍,包括低血压、需要使用血管活性药物治疗或灌注功能损伤[8]。目前儿童脓毒性休克指南均推荐在使用液体复苏和血管活性药物仍无法纠正休克的情况下,应考虑静脉注射氢化可的松与体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)治疗[8, 9]。2020年一项纳入了7项研究、共85例新生儿的Meta分析显示,需要ECMO支持的脓毒症新生儿合并生存率为73%(95%CI 56%~87%),说明RSS新生儿应考虑使用ECMO[11]。RSS患儿多于发病48~72 h内死亡[6, 7,12]。本研究结果显示,cSSS对脓毒性休克新生儿不良预后的评估效能优于新生儿休克评分,且与血管活性药物使用时间成正性线性相关。为使脓毒性休克治疗手段效果达到最大化,cSSS有望成为一种能早期识别RSS的工具,改善脓毒性休克患儿的治疗结局。
新生儿危急重症评分系统包括新生儿急性生理学评分[13]、第三代小儿死亡风险评分[14]、中国新生儿危重症病例评分[15],均可客观、有效地评估危重新生儿病情与预后[16, 17],但均需多项生理及生化指标联合评估,新生儿血容量少,不能耐受反复采血检查,在评估休克严重程度上受到限制。临床上最常用于评估新生儿休克严重程度的是新生儿休克评分[10],但此评分准确性受主观因素影响。2016年欧洲儿科和新生儿危重病医学会根据患儿是否存在高乳酸血症、血管活性药物剂量高与心肌功能障碍,提出SSS以指导RSS患儿的诊治,并指出bSSS≥2和cSSS≥3.5与病死率显著相关[7]。与新生儿休克评分相比,SSS加入了LAC水平、血管活性药物剂量与心功能指标,更接近脓毒性休克的定义。但目前SSS主要针对儿童,仅有一项关于3个月至12岁儿童的队列研究,结果显示SSS可区分出最严重的病例,并证实了评分的准确性[18]。基于前期儿童研究,本研究首次将SSS应用于脓毒性休克新生儿并计算其估测不良预后的阈值,为了更便于临床应用,将cSSS公式进行了改良。研究结果显示,当cSSS>80.5时估测不良预后的阳性与阴性预测值均高于70%,可为RSS新生儿诊治提供客观依据。
LAC水平是组织灌注不足的间接指标,与脓毒性休克发生不良结局相关[12,19, 20]。有研究显示,休克新生儿LAC>4 mmol/L的病死率高达42.5%,但多因素分析未发现LAC水平与死亡相关[21]。2017年的一项研究结果显示,休克儿童血LAC>2 mmol/L时病死率为32.0%,而LAC≤2 mmol/L的病死率仍有16.1%[12]。以上研究提示LAC增高可能增加患儿死亡风险,但最佳阈值仍不清楚,限制了其对脓毒性休克预后的预测价值。
VIS可评估患儿对血管活性药物的反应性和依赖性,客观量化了对血管活性药物支持的需求,已被证明是儿童脓毒症死亡的预测指标[7,22]。研究结果显示,VIS>200与心脏术后儿童的死亡或需要ECMO有关[23]。本研究结果显示,预后不良组脓毒性休克新生儿VIS明显高于预后良好组(56.3比25.0,P<0.001),VIS与血管活性药物使用时间成正相关(r=0.366,P<0.001)。因此,LAC与VIS加入SSS系统可以提高对新生儿脓毒性休克严重程度的鉴别能力。
本研究ROC曲线分析显示新生儿休克评分、cSSS对新生儿脓毒性休克的预后均具有一定的评估效能。cSSS的曲线下面积与约登指数均高于新生儿休克评分,cSSS>80.5时估测脓毒性休克新生儿发生不良预后的特异度、阴性预测值与阳性预测值均高于新生儿休克评分,敏感度低于新生儿休克评分,同时cSSS与血管活性药物使用时间成正相关(r=0.487,P<0.001)。因此,cSSS是指导脓毒性休克启动ECMO或糖皮质激素治疗的重要参考指标,对RSS治疗方案的制定具有重要的临床指导意义,cSSS>80.5的脓毒性休克新生儿是发生不良预后的高危人群。
本研究首次将SSS引入新生儿脓毒性休克的研究,但系单中心回顾性研究,存在丢失数据和信息偏差的风险;在整个脓毒性休克病程期间收集每个项目的最差值,最差值可能发生在病程中的不同时间点,对预后评估有一定影响;本研究样本量不大,且cSSS估测效能的灵敏度不高,存在较高的漏诊率,故本研究具有一定的局限性。将来需开展大样本量前瞻性研究,为新生儿RSS的诊治提供更可靠的依据。
所有作者均声明不存在利益冲突



























