
探讨喂养不耐受(feeding intolerance,FI)早产儿喂养前后肠道氧合变化及影响因素。
选择2018年12月至2019年8月生后24 h内入住温州医科大学附属第二医院新生儿重症监护病房的FI早产儿进行前瞻性自身对照研究,采用近红外光谱仪监测FI早产儿喂养前5 min和喂养后1 h肠道氧合(splanchnic regional saturation,rSsO2)及脑氧合(cerebral regional saturation,rScO2),计算喂养前后rSsO2和rScO2均值、喂养前后rSsO2与rScO2比值(splanchnic-cerebral oxygenation ratio,SCOR),并记录监测时日龄、校正胎龄、喂养种类等临床资料。应用SPSS 18.0统计软件进行单因素相关分析及多元线性回归分析喂养前后rSsO2变化的影响因素。
共纳入符合条件的早产儿41例,喂养前后rSsO2、rScO2、SCOR差异均无统计学意义(P>0.05)。喂养种类影响喂养后rSsO2及SCOR的变化值,与早产儿奶相比,母乳喂养后rSsO2及SCOR变化更小,回归方程分别为Y=5.538-4.065X(模型复相关系数=0.414,决定系数R²=0.171,F=8.050,P<0.01),Y=0.109-0.075X(模型复相关系数=0.405,决定系数R²=0.164,F=7.655,P<0.01)。
发生FI后合理喂养不会影响早产儿rSsO2,与早产儿奶相比,母乳喂养更有利于喂养后rSsO2的稳定,应作为早产儿喂养的首选。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着我国围产医学及新生儿重症监护技术的不断进步,早产儿存活率得到了明显提高[1],而肠道营养是提高早产儿存活率的关键环节[2]。早产儿容易发生喂养不耐受(feeding intolerance,FI)、新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)等,国外研究显示早产儿FI发生率约为25%[3],其预防及治疗是新生儿医师面临的一大难题。研究发现,FI常影响早产儿肠系膜血流灌注、氧合及营养的摄取[4]。近红外线光谱(near-infrared spectroscopy,NIRS)可在床边连续监测早产儿局部组织氧合,反映局部组织代谢和血流灌注情况[5]。本研究通过NIRS监测FI早产儿喂养前后肠道氧合(splanchnic regional saturation,rSsO2)及脑氧合(cerebral regional saturation,rScO2)状况,寻找FI早产儿喂养前后rSsO2的影响因素,以助于临床合理调整FI早产儿的喂养计划,减少肠道缺血缺氧和NEC的发生风险。
选取2018年12月至2019年8月在温州医科大学附属第二医院产科分娩、生后24 h内入住新生儿重症监护病房的FI早产儿进行前瞻性自身对照研究。入选标准:(1)出生胎龄<37周;(2)生后日龄>48 h;(3)符合FI诊断标准并继续接受喂养;(4)获得监护人同意。排除标准:(1)诊断先天性消化道畸形、紫绀型先天性心脏病、重度窒息、严重贫血、严重感染、先天性遗传代谢病等;(2)Papile分级≥2级的颅内出血;(3)正在使用血管活性药物;(4)正在接受有创机械通气;(5)住院期间因死亡或放弃治疗导致临床资料收集不完整。本研究通过温州医科大学附属第二医院伦理委员会审批(2021-K-78-01),患儿家长均签署知情同意书。
1.喂养指征:(1)生命体征平稳,无呕吐、腹胀,肠鸣音正常,排除先天性消化道畸形,于生后12 h内开始肠道喂养;(2)有窒息、脐动静脉插管史或超低出生体重儿(<1 000 g)可于生后24~48 h开始肠道喂养。
2.FI诊断标准[6, 7]:排除器质性疾病的前提下,出现以下情况之一者:(1)喂奶后发生频繁呕吐(≥3次/d)或腹胀;(2)奶量不增或减少持续3 d以上;(3)胃潴留量超过前次喂养量的1/2。
3.喂养方法:采用母乳或早产儿奶喂养。对有吸吮能力的早产儿予以奶瓶喂养,吸吮能力较差的早产儿用注射器通过重力作用滴注喂养。喂奶量及加奶速度按照《中国新生儿营养支持临床应用指南》进行[8]。由新生儿医师根据餐前胃储留量、有无腹胀、呕吐以及临床情况综合考虑是否继续增加喂奶量,直至达到全肠道喂养量≥120 ml/(kg·d)。
4.NIRS监测:应用苏州爱琴生物医疗电子有限公司NIRS仪(EGOS-600A),A型探头用3M弹力绷带固定于脐部正下方,探测深度1.5~2.0 cm,监测rSsO2。B型探头固定于前额正中部,探测深度1~1.5 cm,监测rScO2。安静状态下NIRS连续监测5 min rSsO2和rScO2,餐前监测在喂奶前5 min进行,餐后监测在喂奶后1 h(58~62 min)进行。NIRS监测均在早产儿发生FI后24 h内进行。监测中设置每2 s采集一次数据,应用EGOS-600系列血氧仪数据分析软件将数据转换成EXCEL文件进行分析。将变异率超过50%的数据剔除,计算喂养前后rScO2和rSsO2均值,喂养前后rSsO2与rScO2比值(splanchnic-cerebral oxygenation ratio,SCOR)的平均值,喂养前后rSsO2和SCOR的变化值。
5.资料收集:包括患儿性别、胎龄、出生体重、分娩方式、母亲产前有无使用糖皮质激素、开奶时间、喂养种类、喂养方式、监测时喂养量、生后日龄、校正胎龄等。
应用SPSS 18.0统计软件进行数据分析。计数资料以例表示;符合正态分布的计量资料以±s表示,两组比较采用配对t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,两组比较采用非参数检验。采用Pearson法及Spearman法对喂养前后rSsO2和SCOR的变化值与临床资料进行相关性分析,将单因素分析中具有统计学意义的变量及具有临床意义的变量进一步行多元线性回归分析。P<0.05为差异有统计学意义。
研究期间共收治产科分娩、生后24 h内入住新生儿重症监护病房的FI早产儿62例,共有45例符合入选标准,排除自动出院导致临床资料收集不完整3例,胎粪性腹膜炎、肠梗阻1例,最终纳入41例。
1.一般情况:41例FI早产儿中,男23例,女18例;胎龄(32.4±1.6)周;出生体重(1 723±339)g;剖宫产34例;产前使用糖皮质激素3例;轻度窒息5例;母乳喂养22例,早产儿奶喂养19例;鼻饲喂养27例,鼻饲联合经口喂养14例。
2.发生FI时一般情况:生后日龄中位数5 d;校正胎龄(33.3±1.5)周,其中30~31周9例,32~33周18例,胎龄34~36周14例;发生FI时喂养量为38.0(25.5,99.0)ml/(kg·d)。
喂养后rSsO2、rScO2和SCOR与喂养前比较,差异均无统计学意义(P>0.05),见表1。

喂养前后rSsO2、rScO2及SCOR比较
喂养前后rSsO2、rScO2及SCOR比较
| 组别 | 例数 | rSsO2 | rScO2 | SCOR |
|---|---|---|---|---|
| 喂养前5 min | 41 | 54.8±7.7 | 63.1±3.0 | 0.87±0.11 |
| 喂养后1 h | 41 | 55.6±8.5 | 63.7±4.0 | 0.87±0.13 |
| t值 | -0.913 | -1.188 | -0.220 | |
| P值 | 0.367 | 0.242 | 0.827 |
注:rSsO2为肠道氧合,rScO2为脑氧合,SCOR为rSsO2与rScO2比值
喂养后rSsO2、SCOR变化值与母乳喂养有关(P<0.05),与性别、开奶时间、监测时日龄、体重、胎龄、喂养量、喂养方式无明显相关(P>0.05)。见表2。
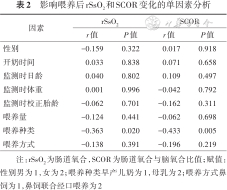
影响喂养后rSsO2和SCOR变化的单因素分析
影响喂养后rSsO2和SCOR变化的单因素分析
| 因素 | rSsO2 | SCOR | ||||
|---|---|---|---|---|---|---|
| r值 | P值 | r值 | P值 | |||
| 性别 | -0.159 | 0.322 | 0.017 | 0.918 | ||
| 开奶时间 | 0.033 | 0.838 | 0.071 | 0.658 | ||
| 监测时日龄 | 0.040 | 0.802 | 0.109 | 0.497 | ||
| 监测时体重 | 0.001 | 0.996 | -0.042 | 0.792 | ||
| 监测时校正胎龄 | -0.062 | 0.701 | -0.162 | 0.311 | ||
| 喂养量 | -0.124 | 0.441 | -0.062 | 0.698 | ||
| 喂养种类 | -0.363 | 0.020 | -0.433 | 0.005 | ||
| 喂养方式 | -0.138 | 0.391 | -0.196 | 0.219 | ||
注:rSsO2为肠道氧合,SCOR为肠道氧合与脑氧合比值;赋值:性别男为1,女为2;喂养种类早产儿奶为1,母乳为2;喂养方式鼻饲为1,鼻饲联合经口喂养为2
纳入单因素分析有统计学意义的变量及发生FI时校正胎龄、日龄、体重、喂养量等具有临床意义的变量作为自变量进行多因素分析,结果显示,喂养种类影响喂养后rSsO2及SCOR变化值,与早产儿奶喂养相比,母乳喂养后rSsO2及SCOR变化值更小,回归方程分别为Y=5.538-4.065X(模型复相关系数=0.414,决定系数R²=0.171,F=8.050,P<0.01)、Y=0.109-0.075X(模型复相关系数=0.405,决定系数R²=0.164,F=7.655,P<0.01)。
NIRS探头能发出波长650~950 nm的近红外光,并由接收探头接收由组织返回的光,从而获得局部组织氧合[9],其基本原理是利用不同血红蛋白对不同波长光吸收特性的差异,最大程度地区分氧合血红蛋白与还原血红蛋白[10]。局部组织氧合监测的血液循环主要来自小静脉(70%)、小动脉(20%)和毛细血管(10%)[11]。由于脑循环具有自动调节功能,大脑血流灌注能保持相对稳定状态[9],即正常情况下rScO2能保持相对稳定。由于肠管结构中空,活动度和表面积大,以及腹部气体、液体、粪便、肠道蠕动的干扰和观察者间的差异,使得rSsO2数据存在高度变异性。SCOR将rSsO2与rScO2进行比较,可避免全身血流动力学异常对rSsO2数据的影响,能够用于不同患者的比较,较rSsO2更可靠。Bozzetti等[12]对20例早产儿监测生后24 h及生后72 h的SCOR值,结果显示,联合监测内脏氧合与rScO2有助于判断早产儿内脏血流和灌注情况,决定是否可以开始肠内喂养。SCOR诊断新生儿肠缺血的敏感度可达到90%,特异度96%[13]。
本研究应用NIRS监测FI早产儿喂养前5 min及喂养后1 h的rSsO2及rScO2,结果显示,FI早产儿喂养前后rSsO2、rScO2和SCOR均无明显改变,说明早产儿发生FI后予以合理喂养不会影响rSsO2和rScO2。
早产儿FI由多种因素引起,如围生期感染、窒息、新生儿呼吸窘迫综合征、肺出血及机械通气等,生后早期开奶及母亲产前使用糖皮质激素可能是FI的保护性因素[14, 15]。本研究结果显示,喂养后rSsO2和SCOR变化小与母乳喂养有关;与早产儿奶相比,母乳喂养更有利于FI早产儿喂养后rSsO2的稳定,进一步说明母乳应作为早产儿喂养的第一选择。
Coombs等[16]研究发现,肠内喂养能增加肠系膜上动脉血流速度,并在餐后45~60 min达到峰值。NIRS床边监测新生儿SCOR只需5 min,不会因为临床诊疗或护理而造成监测中断[17]。因此,本研究应用NIRS监测喂养前5 min及喂养后1 h的rSsO2和rScO2。Dave等[17]应用NIRS监测全肠道营养的早产儿,发现喂养后1 h的SCOR显著升高。有研究显示红细胞压积≤0.28的极低出生体重早产儿喂养后SCOR较喂养前显著下降[18]。本研究结果显示,FI早产儿喂养后SCOR较喂养前无明显变化,考虑原因可能为FI早产儿对喂养代谢需求能力较弱。因此临床医生应综合FI早产儿的临床指标适时停止喂养。
早产儿母乳中含有多种免疫成分、生长因子及生物活性因子,对早产儿具有抗感染、抗炎、肠道定植、免疫调节和促进生长的作用[19]。早产儿母乳喂养可降低NEC、迟发性败血症、慢性肺疾病、早产儿视网膜病等的发生率及风险[20]。研究显示母乳喂养后血流增加速度峰值比配方奶喂养出现得更早[21]。Quigley等[22]研究发现,与母乳喂养相比,早产儿奶喂养的患儿发生FI和NEC的风险更高。张岚[23]的研究也显示,纯母乳喂养组早产儿FI及NEC发生率均低于母乳联合配方奶喂养组。
本研究也存在一定局限性:本次研究为单中心研究,样本量较小,对结果判读有一定影响;未对FI早产儿设置对照组,无法比较喂养顺利早产儿和FI早产儿喂养前后的rSsO2变化情况。此外,目前FI诊断标准国内外尚未统一,不同FI诊断标准可能会限制研究结果的适用性。
综上所述,发生FI后合理喂养不会影响早产儿rSsO2,母乳较早产儿奶更有利于FI早产儿喂养后rSsO2的稳定,但仍需更大样本量的研究证实。随着研究和技术的进步,机体组织氧合监测有望成为临床的有用工具。
所有作者均声明不存在利益冲突



























