
探讨极早产儿及中期早产儿校正18~24月龄神经发育结局并分析其影响因素。
选择2016年6月至2018年6月厦门市妇幼保健院新生儿科收治的胎龄<34周、在校正18~24月龄完成贝利婴儿发育量表Ⅱ测试的早产儿进行前瞻性研究,统计神经发育损害(neurodevelopmental impairment,NDI)的发生率,并根据贝利婴儿发育量表Ⅱ得分,将智力发育指数(mental developmental index,MDI)和精神运动发育指数(psychomotor developmental index,PDI)分为≥85分、70~84分和<70分3组,分析其影响因素。
共纳入胎龄<34周早产儿202例,男131例(64.9%)。共有91例(45.0%)发生NDI,其中轻度77例(38.1%),重度14例(6.9%)。单因素分析显示,MDI<70分组重度窒息发生率、多胎、早产儿视网膜病≥3期、气管插管史比例较高(P<0.05),校正40周和3、6、12月龄头围>-2SD比例较低(P<0.05);PDI<70分组宫内窘迫、母亲妊娠期高血压和多胎比例、呼吸窘迫综合征3~4级、生发基质-脑室内出血3~4级发生率、气管插管史和有创通气比例较高(P<0.05),校正6、12月龄头围>-2SD比例较低(P<0.05)。采用有序多分类Logistic回归对差异有统计学意义的因素进行分析,发现妊娠期高血压、气管插管史和有创通气是低PDI评分的危险因素(OR=9.176、4.547和3.227,P均<0.05),校正6月龄的头围>-2SD是低MDI和PDI评分的共同保护因素(OR=0.063和0.041,P<0.001)。
胎龄<34周早产儿发生重度NDI的比例较高,避免非必要气管插管和机械通气,加强妊娠期高血压管理可能对早产儿神经发育结局有益。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来随着围产医学和新生儿危重症救治技术的进步,早产儿特别是超早产儿(胎龄<28周)、极早产儿(胎龄28~31周)的存活率得到逐步提升,一项基于我国14家医院的多中心研究显示[1],26~27周超早产儿存活率为83.5%~84.8%,28~31周极早产儿存活率为87.4%~96.0%,接近发达国家水平,但国内外早产儿3~4级脑室周围-脑室内出血和囊性脑室周围白质软化发生率没有相应改善[1, 2]。发达国家大样本队列研究显示,胎龄<32周早产儿是发生神经发育损害(neurodevelopmental impairment,NDI)和神经系统后遗症的高危人群[3, 4],而发展中国家胎龄32~37周早产儿亦为高危人群[5],国内关于这些早产儿远期结局的研究报道较少。现对我院新生儿科2016年6月至2018年6月存活出院并完成定期随访的胎龄<34周早产儿进行前瞻性研究,分析其校正18~24月龄时神经发育状况,并探讨其影响因素。
选择2016年6月至2018年6月厦门市妇幼保健院分娩、新生儿科收治的胎龄<34周早产儿进行前瞻性研究。排除标准:(1)合并先天畸形或遗传代谢病;(2)生后14 d内自动出院或死亡;(3)家长拒绝参加本研究;(4)后期随访资料不完整。本研究通过厦门市妇幼保健院伦理委员会批准(KY-2021-030-K01),患儿家长均签署知情同意书。
出院后定期随访并在校正18~24月龄间进行贝利婴儿发育量表(Baley scales of infant development,BSID)Ⅱ测试[6],根据智力发育指数(mental developmental index,MDI)和精神运动发育指数(psychomotor developmental index,PDI)分为<70分(发育迟滞)、70~84分(边缘状态)和≥85分(发育正常)共3组。
1.资料收集:通过查阅电子病历收集患儿及其母亲临床资料。(1)患儿资料:性别、胎龄、出生体重、是否多胎、小于胎龄儿(small for gestational age,SGA)、重度窒息、呼吸治疗情况、早产儿并发症,以及校正40周、3、6和12月龄时体格生长指标,校正18~24月龄时神经发育评估结果;(2)患儿母亲资料:分娩方式、绒毛膜羊膜炎、胎儿宫内窘迫、妊娠期高血压、妊娠期糖尿病和产前激素使用情况。
2.相关定义:(1)早产儿并发症诊断:新生儿呼吸窘迫综合征(respiratory distress syndrome,RDS)、晚发型败血症(late-onset sepsis,LOS)、支气管肺发育不良(bronchopulmonary dysplasia,BPD)、新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、早产儿视网膜病(retinopathy of prematurity,ROP)、生发基质-脑室内出血(germinal matrix and intraventricular hemorrhage,GM-IVH)和脑白质损伤(white matter damage,WMD)等,诊断参考第5版《实用新生儿学》[7];(2)SGA:按2013年版的Fenton生长曲线,体重小于同性别同胎龄儿第10百分位;(3)宫外生长迟缓(extrauterine growth retardation,EUGR):出院时体重小于同胎龄同性别儿第10百分位;(4)追赶生长[8]:早产儿校正月龄的体格生长指标(体重、身长和头围)大于同月龄同性别儿童标准的均值-2SD,即Z评分>-2。校正胎龄40周前的体格生长指标按2013年版同性别Fenton生长曲线评价,40周后按2006年同性别世界卫生组织0~6岁儿童生长标准评价。本研究仅对头围的追赶生长进行分析。
3.NDI分度[9, 10]:(1)重度NDI:重度脑性瘫痪(简称脑瘫),MDI和(或)PDI<70分,需用助听器或人工耳蜗,双侧视觉障碍;(2)轻度NDI:轻度脑瘫,MDI和(或)PDI 70~84分,感音神经性或混合性听力损害,单侧视力障碍;(3)神经发育正常。脑瘫级别采用大运动功能分级系统评定,1~2级为轻度脑瘫,3~5级为重度脑瘫[11]。
4.随访方案:出院后3~5 d、校正胎龄40周及校正3、6、9、12、18和24月龄时来院随访,进行体格测量、BSID Ⅱ测试、听觉及视觉检查等,以校正18~24月龄最后一次评估结果纳入分析。
应用SPSS 23.0统计软件对数据进行分析。正态分布的计量资料以±s表示,组间比较采用t检验或单因素方差分析,两两比较采用最小显著法t检验;非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验或Kruskal-Walis H秩和检验;计数资料以例(%)表示,组间比较采用χ2检验;对纳入的影响因素进行单因素分析,将筛选出的影响因素进一步行有序多分类Logistic回归分析。P<0.05为差异有统计学意义。
研究期间本院分娩、新生儿科收治胎龄<34周早产儿共339例,排除家长拒绝参加研究16例、14 d内自动出院13例、死亡3例、合并先天畸形或遗传代谢病13例,以及出院后随访资料不完整92例(31.3%,92/294),最终纳入202例,胎龄(31.8±1.9)周,出生体重(1 666±410)g,男女比例为1.8∶1。
202例早产儿中,发生NDI 91例(45.0%),轻度NDI 77例(38.1%),重度NDI 14例(6.9%),其中2例合并重度脑瘫,无听力、视力损害患儿。69例超低/极低出生体重儿中发生轻度NDI 34例(49.3%),重度NDI 8例(11.6%),2例(2.9%)合并重度脑瘫。
91例NDI患儿中,胎龄<28周共8例,发生重度NDI合并重度脑瘫1例(12.5%),轻度NDI 3例(37.5%);胎龄28~31周共86例,重度NDI 7例(8.1%),其中合并重度脑瘫1例(1.2%),轻度NDI 32例(37.2 %);胎龄32~33周共108例,发生重度NDI 6例(5.6%),轻度NDI 42例(38.9%)。
1.MDI影响因素分析:与其他两组相比,MDI<70分组重度窒息发生率、多胎比例更高,差异有统计学意义(P<0.05);3组间性别、胎龄、出生体重、分娩方式、SGA和产前激素使用、宫内窘迫、母亲绒毛膜羊膜炎、妊娠期糖尿病、妊娠期高血压发生率比较,差异均无统计学意义(P>0.05),见表1。
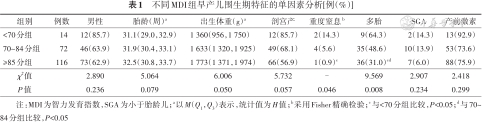
不同MDI组早产儿围生期特征的单因素分析[例(%)]
不同MDI组早产儿围生期特征的单因素分析[例(%)]
| 组别 | 例数 | 男性 | 胎龄(周)a | 出生体重(g)a | 剖宫产 | 重度窒息b | 多胎 | SGA | 产前激素 |
|---|---|---|---|---|---|---|---|---|---|
| <70分组 | 14 | 12(85.7) | 31.1(29.0,32.9) | 1 360(956,1 750) | 12(85.7) | 2(14.3) | 9(64.3) | 2(14.3) | 13(92.9) |
| 70~84分组 | 72 | 46(63.9) | 31.9(30.4,33.1) | 1 633(1 320,1 925) | 49(68.1) | 4(5.6) | 35(48.6) | 10(13.9) | 53(73.6) |
| ≥85分组 | 116 | 73(62.9) | 32.5(30.8,33.7) | 1 773(1 371,1 974) | 66(56.9) | 1(0.9)c | 36(31.0)cd | 7(6.0) | 88(75.9) |
| χ2值 | 2.890 | 5.064 | 6.006 | 5.732 | - | 9.569 | 2.907 | 2.418 | |
| P值 | 0.236 | 0.079 | 0.050 | 0.057 | 0.046 | 0.008 | 0.234 | 0.299 |
注:MDI为智力发育指数,SGA为小于胎龄儿;a以M(Q1,Q3)表示,统计值为H值;b采用Fisher精确检验;c与<70分组比较,P<0.05;d与70~84分组比较,P<0.05
与其他两组相比,MDI<70分组ROP≥3期、气管插管史比例较高,校正年龄40周、3、6、12月龄头围>-2SD比例较低,≥85分组有创通气比例较低,3组间差异有统计学意义(P<0.05)。见表2。3组间RDS 3~4级、BPD、LOS、NEC≥2期、WMD和EUGR发生率差异均无统计学意义(P>0.05)。
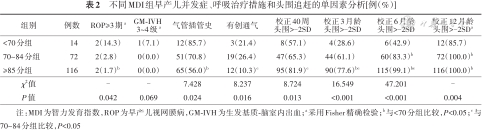
不同MDI组早产儿并发症、呼吸治疗措施和头围追赶的单因素分析[例(%)]
不同MDI组早产儿并发症、呼吸治疗措施和头围追赶的单因素分析[例(%)]
| 组别 | 例数 | ROP≥3期a | GM-IVH 3~4级a | 气管插管史 | 有创通气 | 校正40周 头围>-2SD | 校正3月龄 头围>-2SD | 校正6月龄 头围>-2SD | 校正12月龄 头围>-2SDa |
|---|---|---|---|---|---|---|---|---|---|
| <70分组 | 14 | 2(14.3) | 1(7.1) | 12(85.7) | 3(21.4) | 8(57.1) | 4(28.6) | 6(42.9) | 12(85.7) |
| 70~84分组 | 72 | 2(2.8) | 0(0.0) | 51(70.8) | 19(26.4) | 47(65.3) | 44(61.1) | 60(83.3)b | 72(100.0)b |
| ≥85分组 | 116 | 2(1.7)b | 0(0.0) | 65(56.0)b | 12(10.3)c | 95(81.9)c | 90(77.6)bc | 115(99.1)bc | 116(100.0)b |
| χ2值 | - | - | 7.428 | 8.237 | 8.724 | 16.549 | 47.201 | - | |
| P值 | 0.042 | 0.069 | 0.024 | 0.016 | 0.013 | <0.001 | <0.001 | 0.004 |
注:MDI为智力发育指数,ROP为早产儿视网膜病,GM-IVH为生发基质-脑室内出血;a采用Fisher精确检验;b与<70分组比较,P<0.05;c与70~84分组比较,P<0.05
2.PDI影响因素分析:与其他两组相比,PDI<70分组宫内窘迫、母亲妊娠期高血压和多胎比例较高,差异有统计学意义(P<0.05)。见表3。3组间产前激素使用、母亲绒毛膜羊膜炎、妊娠期糖尿病及SGA情况比较,差异无统计学意义(P>0.05)。
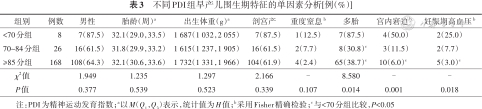
不同PDI组早产儿围生期特征的单因素分析[例(%)]
不同PDI组早产儿围生期特征的单因素分析[例(%)]
| 组别 | 例数 | 男性 | 胎龄(周)a | 出生体重(g)a | 剖宫产 | 重度窒息b | 多胎 | 宫内窘迫b | 妊娠期高血压b |
|---|---|---|---|---|---|---|---|---|---|
| <70分组 | 8 | 7(87.5) | 32.1(29.0,33.5) | 1 687(1 032,2 055) | 7(87.5) | 1(12.5) | 7(87.5) | 4(50.0) | 2(25.0) |
| 70~84分组 | 26 | 16(61.5) | 31.8(29.9,33.2) | 1 615(1 237,1 905) | 16(61.5) | 2(7.7) | 8(30.8)c | 3(11.5) | 2(7.7) |
| ≥85分组 | 168 | 108(64.3) | 32.1(30.6,33.6) | 1 732(1 331,1 966) | 104(61.9) | 4(2.4) | 65(38.7)c | 10(6.0)c | 5(3.0)c |
| χ2值 | 1.949 | 1.235 | 1.297 | 2.166 | - | 8.580 | - | - | |
| P值 | 0.377 | 0.539 | 0.523 | 0.339 | 0.107 | 0.014 | 0.001 | 0.018 |
注:PDI为精神运动发育指数;a以M(Q1,Q3)表示,统计值为H值;b采用Fisher精确检验;c与<70分组比较,P<0.05
与其他两组相比,PDI<70分组RDS 3~4级、GM-IVH 3~4级发生率、气管插管史比例较高,70~84分组有创通气比例较高,差异有统计学意义(P<0.05);PDI<70分组校正6、12月龄头围>-2SD比例较低,3组间差异有统计学意义(P<0.05)。见表4。3组间ROP≥3期、BPD、LOS、NEC≥2期、WMD和EUGR发生率差异均无统计学意义(P>0.05)。
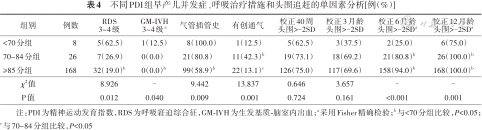
不同PDI组早产儿并发症、呼吸治疗措施和头围追赶的单因素分析[例(%)]
不同PDI组早产儿并发症、呼吸治疗措施和头围追赶的单因素分析[例(%)]
| 组别 | 例数 | RDS 3~4级 | GM-IVH 3~4级a | 气管插管史 | 有创通气 | 校正40周 头围>-2SD | 校正3月龄 头围>-2SD | 校正6月龄 头围>-2SDa | 校正12月龄 头围>-2SDa |
|---|---|---|---|---|---|---|---|---|---|
| <70分组 | 8 | 5(62.5) | 1(12.5) | 8(100.0) | 1(12.5) | 5(62.5) | 3(37.5) | 2(25.0) | 6(75.0) |
| 70~84分组 | 26 | 7(26.9) | 0(0.0) | 21(80.8) | 11(42.3)b | 19(73.1) | 18(69.2) | 21(80.8)b | 26(100.0)b |
| ≥85分组 | 168 | 32(19.0)b | 0(0.0)b | 99(58.9)b | 22(13.1)c | 126(75.0) | 117(69.6) | 158(94.0)b | 168(100.0)b |
| χ2值 | 8.926 | - | 9.442 | 13.837 | 0.646 | 3.657 | - | - | |
| P值 | 0.012 | 0.040 | 0.009 | 0.001 | 0.724 | 0.161 | <0.001 | 0.001 |
注:PDI为精神运动发育指数,RDS为呼吸窘迫综合征,GM-IVH为生发基质-脑室内出血;a采用Fisher精确检验;b与<70分组比较,P<0.05;c与70~84分组比较,P<0.05
将单因素分析中P<0.10的因素纳入有序多分类Logistic回归和广义线性模型分析,结果显示,校正6月龄头围>-2SD为低PDI和低MDI得分的保护性因素,气管插管史、母亲妊娠期高血压和有创通气为低PDI得分的危险因素。见表5。
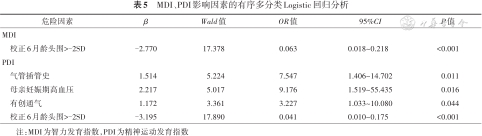
MDI、PDI影响因素的有序多分类Logistic回归分析
MDI、PDI影响因素的有序多分类Logistic回归分析
| 危险因素 | β | Wald值 | OR值 | 95%CI | P值 |
|---|---|---|---|---|---|
| MDI | |||||
| 校正6月龄头围>-2SD | -2.770 | 17.378 | 0.063 | 0.018~0.218 | <0.001 |
| PDI | |||||
| 气管插管史 | 1.514 | 5.224 | 7.547 | 1.406~14.702 | 0.011 |
| 母亲妊娠期高血压 | 2.217 | 5.017 | 9.176 | 1.519~55.435 | 0.016 |
| 有创通气 | 1.172 | 3.361 | 3.227 | 1.033~10.080 | 0.044 |
| 校正6月龄头围>-2SD | -3.195 | 17.890 | 0.041 | 0.010~0.175 | <0.001 |
注:MDI为智力发育指数,PDI为精神运动发育指数
胎龄<34周极早产儿及中期早产儿神经系统发育不成熟,脑发育易受围生期因素、并发症、治疗等因素的影响,NDI发生风险较高。本研究以校正18~24月龄NDI的发生率评估胎龄<34周早产儿神经发育结局,并分别对MDI、PDI的影响因素进行分析。
与翟倩等[12]报道的超低/极低出生体重儿神经发育结局相比,本研究中69例超低/极低出生体重儿中重度NDI(11.6%比21.9%)、脑瘫(2.9%比5.5%)发生率明显更低。本研究经多因素分析发现有创通气、气管插管史和母亲妊娠期高血压是低PDI评分的独立危险因素。有研究报道机械通气是低PDI评分的危险度因素,且机械通气时间越长,低PDI评分的危险度越高,但较少影响MDI评分[13, 14, 15]。机械通气可通过影响血流动力学变化、引发炎性反应和氧化应激等机制,影响早产儿脑发育。经气管插管与经LISA管给药的对比研究显示,气管插管造成的血流动力学波动和肺泡过度膨胀导致的炎性介质释放,是导致低PDI评分的原因[16, 17, 18]。本研究多因素回归分析中未发现3~4级GM-IVH是低PDI评分的危险因素,考虑可能与病例数过少有关。
母亲妊娠期高血压对子代神经发育结局的研究更多关注于孤独症和多动症,对MDI和PDI影响的研究较少。Yoneda等[19]研究表明母亲子痫前期合并肾功能障碍是胎龄<34周早产儿神经发育不良的危险因素,对语言、运动和认知等方面均造成不良影响。然而,Schlapbach等[20]研究显示子痫前期婴儿MDI评分明显低于对照组(P=0.021),但在校正胎龄、出生体重、生后生长发育等因素后,两组间差异无统计学意义(P=0.183),提示妊娠期高血压对智力发育的损伤主要通过对生长发育的影响实现。目前认为妊娠期高血压可通过营养-内分泌、氧化应激和炎症反应等机制改变早产儿神经元生长模式,对神经发育造成损伤[21]。本研究结果进一步证实妊娠期高血压对子代神经发育结局有不良影响,且在诸多因素中影响最明显。
本研究经多因素分析证实校正6月龄头围>-2SD是胎龄<34周早产儿MDI/PDI的独立保护因素。有关头颅MRI的研究发现,头围与脑体积密切相关,提示头围可较好地预测大脑发育情况[22]。有研究证实极低出生体重儿生后早期头围生长速度是后期神经发育和生长结局的独立影响因素[23],校正8月龄头围小于正常同龄儿-2SD与运动发育落后相关[24, 25],校正24月龄头围小于正常同龄儿-2SD与低MDI评分相关[24]。对极早产儿的研究也表明在校正6~9月龄发生追赶生长提示神经发育结局良好[26],加强出院后早期的营养支持及监测[27],关注头围的追赶状况,可望进一步改善早产儿的神经发育结局。
但本研究为单中心研究,失访率达31.3%,且未纳入家庭经济、母亲教育及后期干预的数据,结果存在一定的局限性,需开展多中心研究、扩大样本量验证以上结果。
综上,胎龄<34周早产儿发生NDI的比例仍较高,应尽量避免非必要的气管插管和机械通气,加强产前妊娠期高血压管理和生后早期特别是校正3~6月龄前的营养指导和头围监测,可能对早产儿远期神经发育结局有益。
所有作者均声明不存在利益冲突



























