
探讨足月小于胎龄儿(small for gestational age infant,SGA)生后24 h内类胰岛素样生长因子1(insulin-like growth factors-1,IGF-1)与血脂水平的相关性。
选择2020年5月至2021年1月广东省妇幼保健院分娩、生后24 h内收入新生儿病房的单胎活产SGA及适于胎龄儿(appropriate for gestational age infant,AGA)进行前瞻性研究,将纳入患儿分为SGA组和AGA组,比较两组患儿生后24 h内IGF-1和血脂水平的差异,分析IGF-1与血脂的相关性。
共纳入SGA组95例,AGA组84例。SGA组IGF-1<25 ng/ml比例高于AGA组(P<0.05)。在不同性别构成组内、早期足月分娩及完全足月分娩组内,SGA IGF-1<25 ng/ml比例也均高于AGA;SGA组甘油三酯(triglyceride,TG)水平高于AGA组,高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平低于AGA组(P<0.05);SGA和AGA生后24 h内IGF-1水平与HDL-C水平成正相关(P<0.01),与TG水平成负相关(P<0.01),HDL-C水平是IGF-1的预测因素。
与AGA相比,SGA生后24 h内即呈现IGF-1、HDL-C分泌不足及高TG水平的状态;生后应及时予SGA营养支持,避免发生低血糖,并刺激IGF-1的分泌。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
小于胎龄儿(small for gestational age infant,SGA)出生体重低于同胎龄、同性别新生儿出生体重第10百分位数,是高危儿的代表性群体[1, 2]。全世界每年约有3 000多万SGA出生,SGA不仅围产期病死率高于适于胎龄儿(appropriate for gestational age infant,AGA),发生远期代谢综合征的风险也远远高于AGA[3, 4]。国内学者指出,6月龄前婴儿的生长调控模式基本延续自胎儿期,以代谢轴调控生长轴,即营养-胰岛素-类胰岛素样生长因子(insulin-like growth factors,IGF)轴[5]。研究表明IGF-1可与胰岛素受体结合,调节脂肪和肌肉组织中葡萄糖的转运和利用,促进脂肪组织分解并增加肌肉对游离脂肪酸的获取[6, 7]。随机双盲对照试验也证实重组人IGF-1可降低健康人群空腹血清甘油三酯(triglyceride,TG)水平[8]。在肥胖儿童中,血清IGF-1低水平与高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)低水平成正相关[9]。本团队前期已研究了SGA发生的危险因素[10],考虑到SGA的高发生率及远期代谢问题风险,本研究分析SGA出生24 h内的IGF-1及血脂水平,为更好地解释SGA代谢机制提供依据。
选择2020年5月至2021年1月广东省妇幼保健院分娩、生后24 h内收入新生儿病房的活产SGA及AGA足月儿为研究对象进行前瞻性研究。纳入标准:(1)胎龄37~41周;(2)单胎;(3)无窒息史。排除标准:(1)染色体异常、先天性遗传代谢病、先天性心脏病、消化道畸形、新生儿坏死性小肠结肠炎;(2)母亲患有糖尿病、甲状腺功能亢进或低下、高血压、脂肪肝及血脂异常;(3)家长拒绝参加本研究。本研究已通过广东省妇幼保健院医学伦理委员会批准(201801045),且家属均已签署知情同意书。
根据2015年《中国不同胎龄新生儿出生体重曲线研制》[11],出生体重低于同性别、同胎龄体重第10百分位的患儿纳入SGA组,出生体重在同性别、同胎龄体重第10~90百分位的患儿纳入AGA组,SGA组与AGA组配对比例为1∶1。
1.资料收集:患儿性别、胎龄、出生体重、出生身长、出生头围、分娩方式、生后24 h内IGF-1及血脂水平。
2.体格测量:新生儿出生时体重、身长、头围均由经过培训的产科护士测量,体重测量采用坐卧式杠杆秤,测量值精确到1 g;身长采用标准量床,头围采用软尺测量,测量值均精确到0.1 cm。
3.血清标本采集和检测:所有纳入患儿均于生后24 h内、下一顿喂养前抽取静脉血2 ml,取血清于-80℃冰箱保存备检。所有样本均在广东省妇幼保健院实验室进行检测,由同一检测人员分别检测IGF-1、TG、总胆固醇(total cholesterol,TC)、HDL-C、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)值。IGF-1试剂盒由西门子公司提供,采用IMMULITE 2000仪器,进行化学发光免疫法分析;TG、TC、HDL-C、LDL-C由贝克曼公司提供的测定试剂盒,采用全自动生化分析仪AU5811进行测定。
4.研究内容:(1)对于IGF-1水平,本研究采用IGF-1第3百分位数25 ng/ml为截断值[12]进行二分类分析,并采用2013年美国妇产科医师学会发布的第579号专家共识文件[13],将足月SGA、AGA根据胎龄分为早期(胎龄37~38周)、完全(胎龄39~40周)、晚期(胎龄41周)足月儿进行分层分析,探讨不同胎龄SGA与AGA在IGF-1水平方面的差异;(2)探讨足月儿生后24 h内IGF-1与血脂水平的相关性。
应用SPSS 22.0统计软件进行数据分析。正态分布的计量资料以±s表示,组间比较采用随机区组设计的协方差分析,两两比较采用最小显著性法(least-significant difference,LSD)t检验;计数资料以例(%)表示,组间比较采用χ2检验;相关关系采用Spearman相关分析,并采用Logistic回归分析进行多因素分析。P<0.05为差异有统计学意义。
共纳入SGA组95例,其中早期、完全、晚期足月儿分别为39例、49例、7例;AGA组因血样未检测出数值、血样太少未能检测所有项目及检测数值明显异常等情况排除11例,最终纳入84例,其中早期、完全、晚期足月儿分别为39例、36例、9例。两组性别、胎龄、分娩方式比较,差异均无统计学意义(P>0.05);SGA组出生体重、出生身长、出生头围均低于AGA组,差异有统计学意义(P<0.05)。见表1。
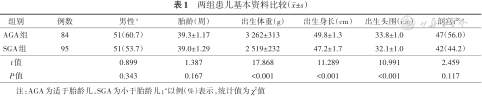
两组患儿基本资料比较(±s)
两组患儿基本资料比较(±s)
| 组别 | 例数 | 男性a | 胎龄(周) | 出生体重(g) | 出生身长(cm) | 出生头围(cm) | 剖宫产a |
|---|---|---|---|---|---|---|---|
| AGA组 | 84 | 51(60.7) | 39.3±1.17 | 3 262±313 | 49.8±1.3 | 33.8±1.0 | 47(56.0) |
| SGA组 | 95 | 51(53.7) | 39.0±1.29 | 2 519±232 | 47.2±1.7 | 32.1±1.0 | 42(44.2) |
| t值 | 0.899 | 1.387 | 17.868 | 11.289 | 10.991 | 2.459 | |
| P值 | 0.343 | 0.167 | <0.001 | <0.001 | <0.001 | 0.117 |
注:AGA为适于胎龄儿,SGA为小于胎龄儿;a以例(%)表示,统计值为χ2值
SGA组生后24 h内IGF-1<25 ng/ml比例高于AGA组,差异有统计学意义(P<0.05)。见表2。通过性别、胎龄对IGF-1<25 ng/ml患儿进行分层χ2检验,结果显示SGA组男婴(88.2%比64.7%)、女婴(86.4%比33.3%)、早期足月儿(76.9%比48.7%)及完全足月儿(95.9%比55.6%)的IGF-1<25 ng/ml比例均高于AGA组,差异均有统计学意义(P<0.05);但两组晚期足月儿IGF-1<25 ng/ml的比例差异无统计学意义(P=0.308)。
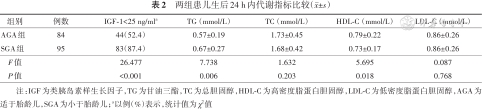
两组患儿生后24 h内代谢指标比较(±s)
两组患儿生后24 h内代谢指标比较(±s)
| 组别 | 例数 | IGF-1<25 ng/mla | TG(mmol/L) | TC(mmol/L) | HDL-C(mmol/L) | LDL-C(mmol/L) |
|---|---|---|---|---|---|---|
| AGA组 | 84 | 44(52.4) | 0.57±0.19 | 1.73±0.45 | 0.79±0.22 | 0.86±0.26 |
| SGA组 | 95 | 83(87.4) | 0.67±0.27 | 1.68±0.42 | 0.73±0.17 | 0.86±0.26 |
| F值 | 26.477 | 7.738 | 1.632 | 5.695 | 0.087 | |
| P值 | <0.001 | 0.006 | 0.203 | 0.018 | 0.768 |
注:IGF为类胰岛素样生长因子,TG为甘油三酯,TC为总胆固醇,HDL-C为高密度脂蛋白胆固醇,LDL-C为低密度脂蛋白胆固醇,AGA为适于胎龄儿,SGA为小于胎龄儿;a以例(%)表示,统计值为χ2值
生后24 h内,SGA组TG水平高于AGA组,HDL-C水平低于AGA组,差异均有统计学意义(P<0.05);两组TC、LDL-C水平比较差异无统计学意义(P>0.05)。见表2。
以性别和组别为变量,胎龄为协变量,对TG、TC、HDL-C、LDL-C指标进行2(男比女)×2(SGA比AGA)随机区组设计的协方差分析,发现男婴组TC、HDL-C、LDL-C水平均低于女婴组,差异有统计学意义(P<0.05);但TG水平差异无统计学意义(P>0.05)。
Spearman相关分析显示,足月儿生后24 h内血清IGF-1水平与HDL-C水平成正相关(r=0.270,P<0.01),与TG成负相关(r=-0.285,P<0.01),进一步分析发现各变量间不存在共线性关系(方差膨胀系数<10),对胎龄、性别、出生体重校正后进行Logistic回归分析,结果显示HDL-C水平越高,IGF-1水平越高(OR=0.071,P<0.05)。
了解SGA早期代谢特点,对临床合理营养支持有重要指导意义。本研究结果显示,与AGA相比,SGA生后24 h内即出现代谢改变,表现为IGF-1、HDL-C分泌不足及高TG水平,提示SGA生后早期通过脂肪动员来满足机体能量代谢需求,但SGA出生时脂肪储备显著不足[14],因此SGA生后应及时予营养支持,避免低血糖的发生。
在胎儿期,尤其是孕早期,胎儿生长发育受IGF-2调节为主,其浓度是IGF-1的5~6倍,而IGF-1在生后起主导作用[15]。胎儿循环中的IGF-1主要来自胎盘及营养刺激下胎儿自身合成,当胎盘受到病理因素影响时可能会影响IGF-1分泌。由于生长迟缓、低体重及消瘦均以相应体格指标的第3百分位数作为截断值,本研究亦选择IGF-1水平的第3百分位25 ng/ml作为截断值,以更好地体现与儿童营养评价指标的同步性。本研究结果显示SGA组生后24 h内血清IGF-1<25 ng/ml的比例显著高于AGA组;但在晚期足月儿中两组IGF-1<25 ng/ml的比例差异无统计学意义。一方面可能是因为本研究纳入晚期足月儿例数较少,导致结果存在偏倚,未来需扩大样本量继续探讨、分析;另一方面,虽然晚期足月SGA出生体重低于同胎龄AGA,但各器官组织整体发育较为成熟,且晚期足月儿不良围产结局风险更高,疾病状态会导致IGF-1水平降低[16],因此,SGA的IGF-1水平与同期AGA差异不显著。既往研究也发现,SGA脐血IGF-1水平显著低于AGA和大于胎龄儿,且IGF-1水平与新生儿体重之间存在正相关关系[17]。
本研究结果显示,SGA组血清TG水平高于AGA组。由于SGA极易受子宫收缩影响发生缺氧应激、胎盘功能受损,导致糖原储备耗竭,且胎儿期糖原储备不足、生后血糖调节能力下降,约1/3的SGA生后会出现低血糖[18, 19],生后24 h内SGA需要动员更多的脂肪组织,但SGA的IGF-1、皮质醇、肾上腺素等激素分泌不足,且仅部分中长链酰基肉碱升高[20],导致SGA对TG水平利用率低下,故而血清TG水平升高。以往研究在脐血水平亦有类似发现,相比于AGA,SGA脐血中的TG水平显著上升[21]。综上,由于SGA生后TG利用度下降,给予肠外营养支持时,应慎重补充脂肪乳,且SGA生后应加强喂养,避免发生低血糖。
本研究结果显示SGA血清HDL-C水平显著低于AGA,Pecks等[22]对脐血的研究也显示,SGA组HDL-C水平显著低于AGA组。由于早期新生儿肝脏合成能力有限,与AGA相比,SGA肝脏内的细胞数目更少、体积更小,肝脏合成HDL的能力更显不足,故而SGA脐血中的HDL水平显著低于AGA[23];由于胆固醇的转运载体减少,导致SGA的HDL-C水平低下。除逆向转运胆固醇外,HDL还可调节人体炎症反应,且HDL-C水平与心血管疾病风险成负相关[24]。最新研究表明,HDL转运胆固醇时,还会转运一定量的维生素、激素及蛋白质等,这为HDL在心血管健康方面的调节作用提供了分子机制基础[25]。SGA生后24 h内即出现HDL-C水平低下,可能意味着未来心血管疾病发生风险较高,需要对此类人群进行血脂水平的跟踪随访,尽早发现心血管疾病风险,以期早期干预。
此外,本研究还发现足月儿生后24 h内IGF-1与HDL-C成正相关,且HDL-C是IGF-1水平的预测因素。但SGA呈现出与肥胖儿童一致的低IGF-1和低HDL-C代谢状态,这表明SGA生后24 h内即存在代谢改变,而这种改变是否会随着追赶生长动态变化,尚需继续跟踪随访,并扩大样本量,对SGA生长与代谢的变化情况做进一步探讨。
所有作者均声明不存在利益冲突



























