
分析新生儿脑积水的临床特点。
通过检索电子病历系统,回顾性分析2010年1月至2019年12月复旦大学附属儿科医院新生儿科收治的脑积水患儿临床资料,根据是否足月、不同病因及治疗方式进行分组,比较各组临床特征及短期结局。
共纳入脑积水患儿223例。早产儿136例(61.0%),足月儿87例(39.0%),早产儿组颅内出血后脑积水比例高于足月儿组(P<0.001)。原发性脑积水58例(26.0%),颅内出血后脑积水82例(36.8%),颅内感染后脑积水48例(21.5%),出血合并感染后脑积水35例(15.7%),颅内出血组围产期窒息、出生时急救复苏、生后3 d内气管插管比例高于其他组(P<0.05);颅内感染组合并新生儿败血症、原发性组合并动脉导管未闭、颅内出血组合并呼吸系统疾病比例高于其他组(P<0.05)。非手术治疗137例(61.4%),临时性引流48例(21.5%),永久性分流37例(16.6%),行颅内血肿清除术1例(0.4%),原发性组及颅内出血组行永久性分流术后好转率高于临时性引流和非手术治疗(P<0.001)。
新生儿脑积水的主要病因为颅内出血及颅内感染;颅内出血后脑积水早产儿比例高,不同病因引起的脑积水合并不同的临床问题;孕产期母婴保健、预防新生儿败血症及颅内出血是预防脑积水的要点;治疗方式的选择尚需积累更多经验。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脑积水可分为原发性(先天性)脑积水、颅内感染或颅内出血后脑积水,以及出血合并感染后脑积水,其中以颅内出血后脑积水最为常见[1, 2]。随着围产医学的不断发展,早产儿存活率不断提高,新生儿脑积水发生率也随之增加[3]。若没有得到及时的诊断和积极治疗,脑积水可能会对大脑造成不可逆的损伤,出现神经系统后遗症,导致一系列认知、行为障碍。目前国内针对新生儿脑积水临床特点的研究不多,尤其缺乏不同病因患儿临床特点的分析,与治疗方式有关的研究样本量较少,可供临床参考的资料有限。因此,本研究通过对单中心较大样本的病例进行回顾性分析,阐述新生儿脑积水的临床特征及短期结局情况,报告如下。
选取2010年1月至2019年12月复旦大学附属儿科医院新生儿科收治的所有新生儿脑积水患儿进行回顾性分析。入选标准:(1)入院日龄≤28 d。(2)住院过程中发生脑室扩大[4],以下3项中至少符合2项:①前角宽度>4 mm(或超过胎龄对应的第97百分位数值1 mm);②丘脑-枕部距离>26 mm(或超过胎龄对应的第97百分位数值1 mm);③第三脑室>3 mm(或超过胎龄对应的第97百分位数值1 mm)。(3)出院诊断包含新生儿脑积水。排除资料不全和脊髓脊膜膨出的患儿。本研究经医院伦理委员会审批[2021(429)]。
1.资料收集:由接受过相应培训的高年资医务人员完成;资料收集表格由研究团队讨论设计并经过临床专家论证,临床专家包括儿科学、新生儿学、新生儿外科、神经外科及新生儿护理专家;从电子病历中提取数据并录入统一的电子数据库,提取资料包括患儿性别、胎龄、出生体重、病因、围产期病史、影像学检查结果、治疗方法及临床结局。
2.分组方法:(1)根据出生胎龄分为早产儿组(<37周)和足月儿组(≥37周);(2)根据病因分为原发性组、继发性组(包括颅内出血组、颅内感染组和颅内出血合并感染组);(3)根据治疗方式分为非手术组(保守治疗)、临时性引流组和永久性分流组。
1.基本定义:(1)胎龄:<28周为超早产儿;28~31周为极早产儿;32~33周为中期早产儿;34~36周为晚期早产儿[5];≥37周为足月儿。(2)出生体重:<1 000 g为超低出生体重儿;<1 500 g为极低出生体重儿;<2 500 g为低出生体重儿;2 500~3 999 g为正常出生体重儿;≥4 000 g为巨大儿。(3)围产期窒息:1 min Apgar评分0~3分为重度窒息;4~7分为轻度窒息;8~10分为正常。(4)颅内出血程度[6]:Ⅰ级:出血局限于生发基质;Ⅱ级:血液在脑室内占据容积≤50%;Ⅲ级:血液在脑室内占据容积>50%;Ⅳ级:在出血同侧的侧脑室旁发生出血性脑梗死。(5)母亲孕期并发症:指妊娠期糖尿病和妊娠期高血压。
2.脑积水的监测和治疗:通过头颅CT及头颅 MRI判断梗阻部位、监测脑积水进展,经利尿、连续腰椎穿刺放液等保守治疗无缓解,头围逐渐扩大(周长超过50 cm)、颅内压增高(颅内压>250 mmH2O)、脑室进行性扩张伴脑实质受压的患儿建议手术治疗。常用手术方法:(1)临时性引流:对经利尿、连续腰椎穿刺治疗无效,且影像学检查提示脑室进行性扩张伴脑实质受压者行临时性引流术,包括侧脑室外引流术或埋置脑室储液囊反复放液分流[7, 8];(2)永久性分流:对经放液分流超过2个月后脑积水仍未缓解者,行永久性分流术,即脑室-腹腔分流术[9]。
3.出院标准:临床指标稳定、体重和头围增长速度正常、脑脊液压力正常为好转出院;治疗未完成、各项指标未达到稳定状态,家长要求出院为自动出院。
4.随访管理:无论是好转出院或是自动出院均在出院后2周至1个月进行常规随访,任何时间发生异常或者危急情况均可立即来院就诊。
应用SPSS 20.0 统计软件进行数据分析。计数资料以例(%)表示,组间比较采用χ2检验或Fisher精确概率法;非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验。P<0.05为差异有统计学意义。
研究期间共收治新生儿脑积水患儿232例,符合入选标准226例,因资料不全排除2例,因脊髓脊膜膨出排除1例,共纳入223例,男132例,女91例;胎龄34(30,38)周;出生体重2 250(1 350,3 105)g;早产儿136例,足月儿87例。原发性脑积水58例,继发性脑积水165例,包括颅内感染48例,颅内出血82例,出血合并感染35例。存在围产期窒息、急救复苏、分娩相关问题、生后3 d内气管插管、生后3 d内脐动静脉置管、母亲孕期用药和母亲孕期并发症等占3.6%~31.8%。合并新生儿败血症61例(27.4%)、支气管肺发育不良(bronchopulmonory dysplasia,BPD)36例(16.1%)、呼吸窘迫综合征(respiratory distress syndrome,RDS)27例(12.1%)、动脉导管未闭(patent ductus arteriousus,PDA)17例(7.6%)、坏死性小肠结肠炎(necrotizing enterocolitis,NEC)8例(3.6%)。非手术组137例(61.4%);手术治疗86例(38.6%),包括临时性引流48例(21.5%)、永久性分流37例(16.6%)、颅内血肿清除1例(0.4%)。治疗后好转130例(58.3%),自动出院88例(39.5%),死亡5例(2.2%)。
早产儿组颅内出血后脑积水比例高于足月儿组,颅内感染后脑积水比例低于足月儿组,围产期窒息和重度窒息史比例、生后需急救复苏、存在分娩问题、生后3 d内需侵入性操作如气管插管、脐动静脉置管比例及母亲孕期并发症比例均高于足月儿组,差异有统计学意义(P<0.05);两组母亲用药史差异无统计学意义(P>0.05)。见表1。
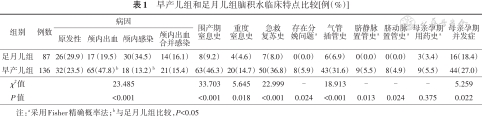
早产儿组和足月儿组脑积水临床特点比较[例(%)]
早产儿组和足月儿组脑积水临床特点比较[例(%)]
| 组别 | 例数 | 病因 | 围产期窒息史 | 重度窒息史 | 急救复苏史 | 存在分娩问题a | 气管插管史 | 脐静脉置管史a | 脐动脉置管史a | 母亲孕期用药史a | 母亲孕期并发症 | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 原发性 | 颅内出血 | 颅内感染 | 颅内出血合并感染 | |||||||||||
| 足月儿组 | 87 | 26(29.9) | 17(19.5) | 30(34.5) | 14(16.1) | 8(9.2) | 4(4.6) | 7(8.0) | 0(0.0) | 6(6.9) | 0(0.0) | 0(0.0) | 3(3.4) | 16(18.4) |
| 早产儿组 | 136 | 32(23.5) | 65(47.8) b | 18(13.2) b | 21(15.4) | 63(46.3) | 20(14.7) | 50(36.8) | 8(5.9) | 43(31.6) | 9(5.5) | 8(4.9) | 9(5.5) | 44(27.0) |
| χ2值 | 23.485 | 33.703 | 5.645 | 22.999 | - | 18.913 | - | - | - | 5.259 | ||||
| P值 | <0.001 | <0.001 | 0.018 | <0.001 | 0.024 | <0.001 | 0.013 | 0.024 | 0.375 | 0.022 | ||||
注:a采用Fisher精确概率法;b与足月儿组比较,P<0.05
颅内出血组围产期窒息史、急救复苏史、生后3 d内脐动静脉置管史、合并BPD和RDS比例均高于颅内感染组,生后3 d内气管插管史比例高于颅内感染组和颅内出血合并感染组,合并败血症比例低于颅内感染组和颅内出血合并感染组,差异有统计学意义(P<0.05),见表2。
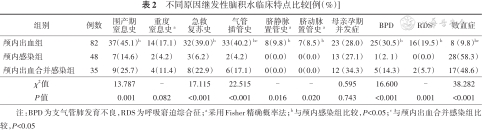
不同原因继发性脑积水临床特点比较[例(%)]
不同原因继发性脑积水临床特点比较[例(%)]
| 组别 | 例数 | 围产期窒息史 | 重度窒息史a | 急救复苏史 | 气管插管史 | 脐静脉置管史a | 脐动脉置管史a | 母亲孕期并发症 | BPD | RDSa | 败血症 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 颅内出血组 | 82 | 37(45.1)b | 14(17.1) | 32(39.0)b | 33(40.2) bc | 8(9.8) b | 7(8.5) b | 23(28.0) | 25(30.5)b | 16(19.5) b | 8(9.8)bc |
| 颅内感染组 | 48 | 7(14.6) | 2(4.2) | 3(6.2) | 2(4.2) | 0(0.0) | 0(0.0) | 13(27.1) | 1(2. 1) | 0(0.0) | 28(58.3) |
| 颅内出血合并感染组 | 35 | 9(25.7) | 4(11.4) | 8(22.9) | 6(17.1) | 0(0.0) | 0(0.0) | 12(34.3) | 5(14.3) | 2(5.7) | 17(48.6) |
| χ2值 | 13.787 | - | 17.115 | 22.515 | - | - | 0.595 | 16.600 | - | 38.282 | |
| P值 | 0.001 | 0.082 | <0.001 | <0.001 | 0.016 | 0.020 | 0.743 | <0.001 | 0.001 | <0.001 |
注:BPD为支气管肺发育不良,RDS为呼吸窘迫综合征;a采用Fisher精确概率法;b与颅内感染组比较,P<0.05;c与颅内出血合并感染组比较,P<0.05
原发性组与继发性组胎龄分别为35.9(31.2,38.4)周和33.5(29.4,38.7)周,出生体重分别为2 510(1 635,3 135)g和1 903(1 303,3 175)g,脑积水发生日龄分别为9(3,31)d和25(17,37)d,原发性组脑积水发生时间早于继发性组,差异有统计学意义(Z=-3.595,P<0.001)。原发性组合并败血症比例低于继发性组,合并PDA比例高于继发性组,非手术治疗比例高于继发性组,临时性引流比例低于继发性组,差异均有统计学意义(P<0.05),见表3。

原发性和继发性脑积水临床情况比较[例(%)]
原发性和继发性脑积水临床情况比较[例(%)]
| 组别 | 例数 | BPD | RDS | 败血症 | PDAa | 非手术治疗 | 临时性引流 | 永久性分流 |
|---|---|---|---|---|---|---|---|---|
| 原发性组 | 58 | 5(8.6) | 9(15.5) | 8(13.8) | 10(17.2) | 46(79.3) | 2(3.4) | 10(17.2) |
| 继发性组 | 165 | 31(18.8) | 18(10.9) | 53(32.1) | 7(4.2) | 92(55.8) | 46(38.3) | 27(16.4) |
| χ2值 | 3.277 | 0.856 | 7.254 | - | 10.093 | 24. 161 | 0.024 | |
| P值 | 0.070 | 0.355 | 0.007 | 0.003 | 0.001 | <0.001 | 0.877 |
注:BPD为支气管肺发育不良,RDS为呼吸窘迫综合征,PDA为动脉导管未闭;a采用Fisher精确概率法
原发性组非手术治疗比例高于颅内感染组,临时性引流比例低于其他3组,差异有统计学意义(P<0.05);颅内出血组永久性分流术比例虽高于其他3组,但差异无统计学意义。见表4。原发性、颅内出血后和颅内出血合并感染后脑积水行永久性分流术的患儿均好转,原发性、颅内出血后和颅内感染后脑积水非手术治疗的患儿自动出院率高于好转率,见表5。

不同病因脑积水患儿的治疗方式选择情况[例(%)]
不同病因脑积水患儿的治疗方式选择情况[例(%)]
| 组别 | 例数 | 非手术治疗 | 临时性引流 | 永久性分流 |
|---|---|---|---|---|
| 原发性组 | 58 | 46(79.3) | 2(3.4) | 10(17.2) |
| 颅内出血组 | 82 | 48(58.5) | 16(19.5)a | 17(20.7) |
| 颅内感染组 | 48 | 24(50.0)a | 19(39.6)a | 5(10.4) |
| 颅内出血合并感染组 | 35 | 19(54.3) | 11(31.4)a | 5(14.3) |
| χ2值 | 24.242 | |||
| P值 | <0.001 | |||
注:a与原发性组比较,P<0.05
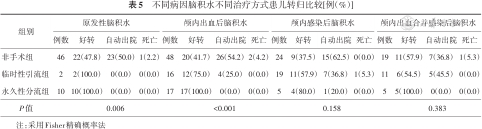
不同病因脑积水不同治疗方式患儿转归比较[例(%)]
不同病因脑积水不同治疗方式患儿转归比较[例(%)]
| 组别 | 原发性脑积水 | 颅内出血后脑积水 | 颅内感染后脑积水 | 颅内出血合并感染后脑积水 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 例数 | 好转 | 自动出院 | 死亡 | 例数 | 好转 | 自动出院 | 死亡 | 例数 | 好转 | 自动出院 | 死亡 | 例数 | 好转 | 自动出院 | 死亡 | |
| 非手术组 | 46 | 22(47.8) | 23(50.0) | 1(2.2) | 48 | 20(41.7) | 26(54.2) | 2(4.2) | 24 | 9(37.5) | 15(62.5) | 0(0.0) | 19 | 11(57.9) | 7(36.8) | 1(5.3) |
| 临时性引流组 | 2 | 2(100.0) | 0(0.0) | 0(0.0) | 16 | 12(75.0) | 4(25.0) | 0(0.0) | 19 | 11(57.9) | 7(36.8) | 1(5.3) | 11 | 6(54.5) | 5(45.5) | 0(0.0) |
| 永久性分流组 | 10 | 10(100.0) | 0(0.0) | 0(0.0) | 17 | 17(100.0) | 0(0.0) | 0(0.0) | 5 | 4(80.0) | 1(20.0) | 0(0.0) | 5 | 5(100.0) | 0(0.0) | 0(0.0) |
| P值 | 0.006 | <0.001 | 0.158 | 0.383 | ||||||||||||
注:采用Fisher精确概率法
新生儿重症监护病房中脑积水最常见的原因为颅内出血,其次是颅内感染、先天畸形(Dandy-Walker畸形、Chiari畸形、矢状窦闭锁、颅底软骨发育异常)、脑膜炎后遗症、脑室内囊肿和肿瘤等[10]。不同原因脑积水患儿的临床特点及治疗方式也不同。本研究对本院新生儿科10年间收治的脑积水患儿临床特点进行分析,结果显示脑积水的主要病因为颅内出血及颅内感染,早产儿颅内出血后脑积水比例最高,不同病因引起的脑积水合并不同的临床问题。
早产儿生发基质比较脆弱、脑血流易波动,相较于足月儿更易发生颅内出血,并且在发生脑室内出血后,35%的早产儿会出现出血后梗阻性脑积水,主要发生于Ⅲ~Ⅳ级颅内出血[11, 12, 13]。Christian等[14]研究进一步发现颅内出血后脑积水患儿中超早产儿和极早产儿约占60%,且超低/极低出生体重儿约占59%。此外,Yi等[15]发现37.5%的未流产的原发性脑积水患儿为早产儿,表明早产是原发性脑积水的危险因素,但原发性脑积水也可能增加早产的风险。本研究结果与上述报道基本相符,早产儿组颅内出血后脑积水占47.8%,明显高于足月儿组,但原发性脑积水在早产儿组和足月儿组中无明显差异。
研究表明,窒息会使大脑缺氧缺血,同时出现酸中毒、血管收缩,从而造成循环障碍、缺氧加重,增加颅内出血风险;早产儿因自身免疫力差、置管机率大,更易出现感染[16]。本组病例中围产期窒息71例,重度窒息24例,早产儿组窒息比例明显高于足月儿组,早产儿组颅内出血后脑积水比例亦明显高于足月儿组,虽然早产儿组置管率高于足月儿组,但颅内感染后脑积水比例却低于足月儿组,考虑可能与本研究为单中心研究存在一定偏倚有关。
此外,研究发现医院间转运与生发基质-脑室内出血发生率和严重程度相关,需要急救复苏、气管插管的患儿颅内出血风险增加[17, 18, 19]。本研究也显示颅内出血后脑积水患儿急救复苏史、生后3 d内气管插管史比例均高于颅内感染后脑积水患儿。据美国住院患者数据库2000—2010年的资料表明,发生不同程度颅内出血的早产儿中,9%进展为脑积水[14]。因此,新生儿出生后在产房内的处理以及从产房到新生儿的转运需要尽可能地精细化照护,给予患儿最少的刺激,尽可能使用无创的监测和治疗方案。
研究显示,原发性脑积水多与先天畸形有关,颅内出血更多与早产、围产期窒息有关,颅内感染后脑积水与新生儿败血症相关[15,20]。这些结论在本研究中也得到了相应的验证,原发性脑积水患儿合并PDA、颅内感染后脑积水患儿合并败血症、颅内出血后脑积水患儿合并BPD和RDS比例均高于其他组。
母亲妊娠期高血压和糖尿病会导致胎儿缺氧、宫内窘迫等,一项系统评价显示,母亲妊娠期糖尿病及高血压可导致新生儿颅内出血后脑积水和原发性脑积水的风险增加[21, 22, 23, 24, 25]。本研究也关注了母体情况对新生儿脑积水可能造成的影响,结果显示,26.9%的母亲有孕期并发症,以妊娠期高血压和糖尿病多见。因此,对母亲不良因素的早期预防及治疗也十分关键。
目前关于脑积水的最佳治疗方案仍没有定论,除了2岁以上儿童和成人的阻塞性脑积水经常使用内镜下第三脑室造瘘术外,脑室-腹腔分流术是最常用且有效的治疗方案[26]。本研究结果显示,原发性、颅内出血后和颅内出血合并感染后脑积水行永久性分流术的患儿均好转,原发性、颅内出血后和颅内感染后脑积水非手术治疗患儿自动出院率高于好转率,但各组接受永久性分流术的比例仅为10.4%~20.7%,这可能是因为行永久性分流术的患儿需要充分评估,需待患儿体重增长,喂养良好,心肺疾病、贫血、感染、NEC等并发症控制后方可进行。因此,在治疗方面,应开展相关临床研究,积累更多的经验,寻找最为有效的治疗方法。
综上所述,本研究显示新生儿脑积水发生的主要原因为颅内出血及颅内感染,早产儿易发生颅内出血,因此颅内出血后脑积水比例最高,而对于足月儿则需警惕败血症的发生,防止颅内感染。目前脑积水的主要治疗方案为腹腔-脑室分流术,不良结局少,但新生儿脑积水的最佳治疗方法尚未明确,仍需积累更多经验,根据胎龄、出生体重及临床情况选择治疗方式。
张艺, 胡晓静, 黄盼盼, 等. 单中心新生儿脑积水10年临床资料回顾性分析[J]. 中华新生儿科杂志, 2023, 38(7): 395-400. DOI: 10.3760/cma.j.issn.2096-2932.2023.07.002.
所有作者声明无利益冲突






























