
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
容量超负荷是急、慢性心力衰竭(心衰)发生发展的重要病理生理过程。心衰时心输出量降低,有效循环血容量减少,肾脏和神经内分泌系统激活,导致代偿性液体潴留和再分布,中心静脉压和心室充盈压增高,组织间隙液体潴留,继而出现淤血症状和体征,如呼吸困难、外周水肿等,是心衰患者住院的主要原因[1,2,3,4]。
容量超负荷和淤血导致多器官生理功能异常:肺淤血致气体交换功能障碍、易继发肺部感染,心肌淤血可致心肌缺血和收缩力下降[5],肾脏淤血致肾小球滤过率降低、肾功能不全[6,7],肝淤血致肝功能异常,肠道淤血致消化功能障碍、肠道菌群易位等[8]。因此,控制液体潴留,减轻容量超负荷,是缓解心衰症状、降低再住院率、提高生活质量的重要措施,是治疗充血性心衰的基石之一。
尽管控制容量超负荷在心衰治疗中举足轻重,但心衰患者容量状态复杂且动态变化,心衰的容量管理含义更加广泛,容量管理的目的是使心衰患者达到个体化的最佳容量平衡状态。目前国内外缺乏容量管理的专家共识或指南,专家组结合国内外最新循证医学证据和专家意见制定了"心力衰竭容量管理中国专家建议"。
容量管理是急、慢性心衰治疗中的关键环节之一。完整的容量管理流程为:(1)准确评估容量状态。(2)确定容量管理目标。(3)选择合适的治疗措施。(4)制定个体化的容量管理方案。
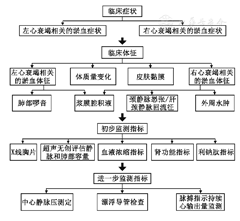
容量状态评估是容量管理的基础。心衰病因复杂,患者的疾病状态、体质、合并症不同,增加了容量评估的复杂性。应多维度、多层面进行分析,首先判断总体容量状态,分为容量正常、容量超负荷、容量不足三种情况;其次判断容量分布,是以肺循环淤血为主还是体循环淤血为主;最后分析血容量增加的组分,即红细胞和血浆容量各占比重。
评估容量状态及容量分布分3步。
第1步,根据症状、体征初步判断容量状态。
1.详细采集临床症状:典型心衰淤血症状包括左心功能不全导致的肺淤血症状[劳力状态下呼吸困难(敏感性66%,特异性53%)、夜间阵发性呼吸困难或平卧后干咳、静息呼吸困难或端坐呼吸(敏感性66%,特异性47%)等]和右心功能不全导致的体循环淤血症状(水肿、腹胀、纳差等消化道症状)[9]。存在上述任何一种症状,均提示容量超负荷;完全没有淤血症状提示容量状态正常;无淤血症状,同时皮肤弹性差、干燥,眼窝凹陷,提示容量不足。淤血症状的改善是容量控制达标的直接反应。
2.有针对性进行体格检查:应重点评估如下体征,包括颈静脉怒张、肝颈静脉回流征、肺部啰音、浆膜腔积液、肝脏肿大及水肿等[10,11,12]。
颈外静脉怒张的顶点到胸骨角的垂直距离加上5 cm为颈静脉压力值,>8 cm时提示容量超负荷(敏感性70%,特异性79%)。引起颈静脉压力升高的其他非容量原因包括心包积液、缩窄性心包炎、上腔静脉阻塞综合征等[13]。肝颈静脉回流征反映容量负荷的敏感性和特异性高于颈静脉怒张[14,15]。患者高枕卧床,张口呼吸,右手掌面轻贴于肝区,逐渐加压持续10 s,如颈外静脉明显怒张,停止压迫肝区后颈外静脉搏动点迅速下降>4 cm为阳性。
肺部存在湿啰音、干啰音、喘鸣音、呼吸气流减弱等提示肺淤血,严重者表现为心原性哮喘。湿啰音多为细湿啰音,从肺底向上发展。部分心衰患者尽管存在肺淤血但由于机体代偿可无湿啰音[16]。
水肿是最直观的评估容量负荷的体征(敏感性46%,特异性73%),多为双下肢水肿或身体低垂部位水肿(长期卧床者)。肝脏或肾脏功能不全、低蛋白血症、下肢深静脉血栓或静脉瓣功能障碍、甲状腺功能减退症等疾病会加重水肿程度[16] 。长期卧床者发生身体低垂部位水肿时应注意水肿程度及范围。浆膜腔积液,包括单侧(右侧居多)或双侧胸腔积液、腹腔积液、心包积液等也是液体潴留的形式。
体质量、尿量、液体净平衡能客观反映容量负荷的动态变化,短期体质量明显增加,尿量减少、入量大于出量(液体正平衡)提示液体潴留。血压下降、心率加快,可由于容量超负荷引起心衰加重所致,也可因有效循环血容量不足所致。采用卧立位试验,患者平卧2 min测卧位血压和心率,待患者站立1 min以后测立位血压和心率,如果收缩压显著下降(>20 mmHg,1 mmHg=0.133 kPa)提示存在容量不足[17]。
第2步,根据检查和化验辅助判断容量状态。
1.X线胸片:X线胸片出现肺上叶血管扩张、肺淤血(敏感性60%,特异性68%)、肺泡间质水肿(敏感性60%,特异性73%)、胸腔积液(敏感性43%,特异性79%)、克氏线等征象提示容量超负荷。
2.血液浓缩指标:在治疗过程中血液浓缩指标,如红细胞比容、血红蛋白浓度、白蛋白水平、总蛋白水平、血钠等进行性升高,除外其他原因后,提示容量超负荷已纠正、甚或出现了容量不足[18,19,20]。这些指标绝对值与容量负荷相关性差,动态监测指标变化趋势更有助于临床判断。
3.肾脏功能指标:血肌酐、尿素氮是反映肾灌注和肾损害的指标,血尿素氮/血肌酐比值>20∶1,尿钠、氯浓度降低,尿肌酐/血肌酐、尿比重或渗透压升高等均提示容量不足[21,22,23]。
4.利钠肽指标:根据利钠肽进行容量评估时一定要动态监测利钠肽水平,确定患者"湿体质量"(容量负荷过重时)和"最佳容量"对应的利钠肽值,如急性心衰入院时的利钠肽水平、出院前去除容量超负荷时的利钠肽水平、门诊随访时正常容量状态下的利钠肽水平[24]。注意:①容量超负荷不是利钠肽升高的唯一原因,去除容量超负荷后利钠肽不一定下降[25];②不能采用利钠肽的绝对数值作为确定容量状态的阈值,个体间会有差异。
5.超声评估下腔静脉塌陷指数下降、下腔静脉直径增宽、出现肺部B线等提示容量超负荷[26,27,28]。平均的舒张早期二尖瓣血流速度峰值/二尖瓣瓣环速度峰值(E/e′) >14提示左房压升高,可反映血流动力学淤血[29]。
第3步,行有创监测评估。
1.测定中心静脉压:通过中心静脉置管监测中心静脉压可反映右心前负荷,简单、易操作。中心静脉压正常值范围为5~12 cmH2O(1 cmH2O=0.098 kPa),易受左心功能、心率、心脏顺应性、瓣膜功能、肺静脉压、胸腔内压力等多种因素影响[30]。监测中心静脉压应同时监测心输出量及组织灌注。应动态观察中心静脉压变化趋势,不能依据一次测量值判定。
2.漂浮导管检查:漂浮导管检查可提供一系列的血流动力学信息,包括肺毛细血管楔压、肺动脉压、心输出量、中心静脉压等[31]。低血压、容量状态判断困难时,可行漂浮导管检查。低血压伴肺毛细血管楔压<14 mmHg,适当补液后,如果血压回升、尿量增加、肺内无湿啰音或湿啰音未加重,提示存在容量不足。低血压伴心排血指数明显降低,肺毛细血管楔压>18 mmHg,提示肺淤血。
3.脉搏指示持续心输出量监测:脉搏指示持续心输出量监测是一种可在床旁进行的、持续、实时监测血流动力学的监测方法,可测定反映心脏前负荷和肺水肿的指标,其测定的容量性指标敏感性高于压力性指标[32],不受胸内压或腹腔内压变化的影响,但不能替代漂浮导管检查。
血容量包括血浆容量和红细胞,心衰时分为三种情况:血浆容量增加,红细胞量减少(真性贫血);血浆容量和红细胞量同时增加;血浆容量和组织间液增加,红细胞量正常(稀释性贫血)[33]。有些慢性心衰患者不仅血浆容量增加,红细胞量也增多,过度利尿加重红细胞淤滞,增加血栓栓塞风险。核素标记示踪剂稀释法能够定量检测血浆容量和红细胞量,但操作繁琐,费用昂贵,临床应用较少[34]。
总之,任何一种评估方法都存在一定的价值和局限性,临床上选择容量评估方法应基于由简便到复杂、由无创到有创、由易到难的原则,少数病例需要结合多种评估方法,并根据临床指标的动态变化进行综合分析(图1)。注意事项:①每个指标评估容量负荷的能力不同;②应权衡每个指标的敏感性和特异性及其他非容量或非心衰影响因素[35];③注意指标的动态变化;④本建议推荐的临床评估步骤可随临床情况适当变动。

急性失代偿性心衰的主要治疗目标是有效纠正容量超负荷,慢性心衰则是长期维持较稳定的正常容量状态。
关于急性心衰容量控制的目标,可采用如下方法确定:(1)将患者目前的体质量与干体质量做比较,将其差值作为减容目标。干体质量即出现淤血症状和体征前的体质量[36]。(2)可通过尿量或液体平衡作为治疗目标:①如果评估容量负荷重,每日尿量目标可为3 000~5 000 ml,直至达到最佳容量状态;②保持每天出入量负平衡约500 ml,体质量下降0.5 kg,严重肺水肿者负平衡为1 000~2 000 ml/d,甚至可达3 000~5 000 ml/d[37]。3~5 d后,如肺淤血、水肿明显消退,应减少液体负平衡量,逐渐过渡到出入量大体平衡。慢性心衰容量控制目标以不出现短期内体质量快速增加或无心衰症状和体征加重为准。
教育患者自我管理利尿剂和液体摄入,进行体质量、尿量监测。如发现体质量持续增加(如3日增加2 kg),提示有容量超负荷的情况[37]。认识尿量和体质量可直接反映病情变化,识别心衰的症状及急性加重的表现,及早到医院治疗。
液体摄入量应根据环境及自身状态而定。慢性D期心衰患者可将液体摄入量控制在1.5~2 L/d,也可根据体质量设定液体摄入量,体质量<85 kg患者每日摄入液体量为30 ml/kg,体质量>85 kg患者每日摄入液体量为35 ml/kg[38]。急性心衰患者液体摄入量,更应严格控制,尤其是肺淤血、体循环淤血明显者,无明显低血容量因素(大出血、严重脱水、大汗淋漓等)时,每天摄入液体量一般宜在1 500 ml以内,不要超过2 000 ml。避免过量摄入钠(<6 g/d),心衰急性发作伴有容量负荷过重的患者,要限制钠摄入<2 g/d[37]。长期使用利尿剂治疗时,适量补充微量元素,注意监测血钾和血钠水平,避免低钾血症、低钠血症发生,适当给予补钾治疗,维持电解质平衡。
治疗心衰的药物中,利尿剂是唯一能够充分控制液体潴留的药物,是急、慢性心衰治疗的基石之一[39]。慢性心衰患者多口服最小有效量利尿剂长期维持。急性心衰或慢性心衰急性失代偿期患者,需静脉给予更高剂量的利尿剂。
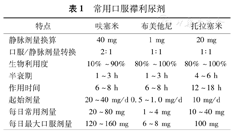
常用襻利尿剂有呋塞米,布美他尼,托拉塞米等(表1),是多数心衰患者的首选药物,适用于有明显液体潴留或伴有肾功能受损的患者。襻利尿剂的剂量与效应呈线性关系,剂量越大,利尿作用越强,严重肾功能受损患者(估测的肾小球滤过率<15 ml·min-1·1.73 m-2)需要增大剂量。
常用口服襻利尿剂
常用口服襻利尿剂
| 特点 | 呋塞米 | 布美他尼 | 托拉塞米 |
|---|---|---|---|
| 静脉剂量换算 | 40 mg | 1 mg | 20 mg |
| 口服/静脉剂量转换 | 2∶1 | 1∶1 | 1∶1 |
| 生物利用度 | 10%~90% | 80%~100% | 80%~100% |
| 半衰期 | 1~3 h | 1~3 h | 4~6 h |
| 作用时间 | 6~8 h | 6~8 h | 12~18 h |
| 起始剂量 | 20~40 mg/d | 0.5~1.0 mg/d | 10 mg/d |
| 每日常用剂量 | 20~80 mg | 1~4 mg | 10~40 mg |
| 每日最大口服剂量 | 120~160 mg | 6~8 mg | 100 mg |
呋塞米口服剂型生物利用度个体间差异很大(10%~90%),肠道淤血时吸收差。无严重肾功能受损时,静脉呋塞米利尿作用相当于口服剂型的2倍(即静脉呋塞米10 mg =口服呋塞米20 mg)。液体潴留明显时,静脉剂型作用更强。口服布美他尼和托拉塞米生物利用度较高(80%~100%),受肠道淤血影响小,静脉和口服剂型药效相似[40]。布美他尼耳毒性及肾毒性较其他两种为重[41]。
长期口服利尿剂者,急性期一般首选静脉应用呋塞米,剂量应大于平时每日剂量(推荐剂量为平时日剂量的2.5倍)[42]。急性心衰或慢性心衰未使用过利尿剂且无肾功能不全的患者,首次可先静脉注射呋塞米20~40 mg,或托拉塞米10~20 mg,根据尿量再决定利尿剂剂量的增减。
理论上持续静脉泵入较间断静脉推注相比,利尿剂血药峰浓度低、肾功能恶化和神经内分泌激活风险低、水钠潴留反跳现象少,但研究显示两种静脉给药方式在改善心衰症状、血肌酐水平、N末端B型利钠肽前体水平、住院时间等方面并无差异[42]。中、重度心衰合并利尿剂抵抗的患者大剂量使用利尿剂时,可选择持续静脉泵入方式[43]。呋塞米持续静脉滴注的剂量为0.1~0.75 mg·kg-1·h-1;托拉塞米可等剂量换算。
噻嗪类利尿剂作用强度中等,常用药物有氢氯噻嗪、苄氟噻嗪、美托拉宗等[38]。适用于有轻度液体潴留、伴有高血压而肾功能正常的心衰患者,或长期使用襻利尿剂发生利尿剂抵抗者。氢氯噻嗪起始剂量12.5~25.0 mg,1~2次/d,可根据血压、尿量增加至50 mg,2次/d,此时达到最大药物效应。肾功能中度损害时(肌酐清除率<30 ml/min时)噻嗪类利尿剂失效。
保钾利尿剂作用强度最弱,包括醛固酮受体拮抗剂(螺内酯和依普利酮)和钠通道阻滞剂(氨苯蝶啶和阿米洛利)。
临床上主要应用非利尿作用的低剂量醛固酮受体拮抗剂,以改善心肌重构,如螺内酯20 mg或依普利酮25~50 mg[44,45]。要达到利尿作用需要使用高剂量醛固酮受体拮抗剂,如50~100 mg螺内酯[46]。依普利酮是选择性醛固酮受体拮抗剂,对性激素受体作用小,不良反应少。氨苯蝶啶和阿米洛利一般与其他利尿剂联合使用。
(1)作用机制:血管加压素作用于肾脏集合管细胞基底膜侧的V2受体促进自由水的吸收,其非渗透性分泌增高是心衰容量负荷过重的重要机制之一。血管加压素V2受体拮抗剂(普坦类药物)选择性地与位于肾脏集合管血管面的血管加压素V2受体结合,导致水通道蛋白2从集合管顶端膜脱落,阻断水的重吸收,增加水排泄,故称为排水利尿剂。该类利尿剂以排水为主,水排出后,血浆渗透压增高,组织间液向血管内转移,这样既有利于消除器官组织水肿,也有助维持血管内的容量稳定。托伐普坦不需要被分泌至肾小管腔内发挥作用,作用效率提高,也不依赖于血钠和白蛋白水平。(2)临床证据:普坦类药物中的代表药物为托伐普坦。托伐普坦在各种病因导致的失代偿性心衰或稳定心衰、射血分数降低或保留性心衰中具有一定的临床证据,多数临床试验是在传统治疗(包括襻利尿剂)基础上加用托伐普坦,可增加尿量、减轻体质量、改善充血症状,不影响神经激素、肾功能和电解质水平。对于老年、低血压、低钠血症、低蛋白血症、肾功能损伤等高危人群托伐普坦依然有效。EVEREST、TACTIC等研究发现在急性失代偿性心衰早期使用托伐普坦,可明显减轻体质量、增加液体负平衡、缓解淤血症状,无明显短期和长期不良反应[47,48,49]。日本QUEST研究和在我国进行的研究均显示,使用常规利尿剂治疗后仍有液体潴留的心衰患者,在常规治疗基础上联用托伐普坦片15 mg/d共7日可显著降低体质量,保持液体负平衡,减轻下肢水肿和颈静脉怒张体征,安全性良好[50,51]。EVEREST[52]研究事后分析表明心衰合并低钠血症患者(血钠水平低于130 mmol/L)长期应用托伐普坦能减少死亡率。(3)适应证和临床应用:目前推荐托伐普坦用于充血性心衰、常规利尿剂治疗效果不佳、有低钠血症或有肾功能损害倾向患者。可与襻利尿剂合用,有协同利尿效果。部分患者用药后1~2 d即可见到明显利尿效果;建议起始剂量为7.5~15.0 mg/d,疗效欠佳者逐渐加量至30 mg/d。短期可使用7~14 d。7.5 mg托伐普坦排尿能力与40 mg静脉呋塞米相当。口渴和高钠血症是常见的不良反应,使用过程中注意监测血钠水平。
其他常用口服利尿剂及其剂量(表2)。

其他常用口服利尿剂及其剂量
其他常用口服利尿剂及其剂量
| 药物 | 起始剂量 | 每日常用剂量 | 每日最大剂量 |
|---|---|---|---|
| 氢氯噻嗪 | 12.5~25.0 mg,1~2次/d | 25~50 mg | 100 mg |
| 阿米洛利 | 2.5 mga/5.0 mgb,1次/d | 5~10 mga/10~20 mgb | 20 mg |
| 氨苯蝶啶 | 25 mga/50 mgb,1次/d | 100 mga/200 mgb | 200 mg |
| 螺内酯 | 20 mg,2次/d | 50~100 mg | 100 mg |
| 托伐普坦 | 7.5~15.0 mg,1次/d | 7.5~30.0 mg | 60 mg |
注:a与ACEI或ARB合用时剂量;b不与ACEI或ARB合用时剂量
小到中等剂量(2~5 μg·kg-1·min-1)多巴胺,具有兴奋肾血管多巴胺受体,引起血管扩张,增加肾脏血流量,提高肾小球滤过率的作用[53,54]。部分研究显示多巴胺与利尿剂联用可明显增加尿量、改善肾功能,但未在较大型随机对照研究中获得证实,可能与多巴胺血药浓度的个体间差异有关[55,56,57,58]。心衰越重患者对多巴胺反应性越低,需应用更大剂量才可增加肾脏血流、降低肾血管阻力[59]。
血压正常的心衰患者,静脉应用小剂量硝普钠、硝酸甘油等血管扩张剂也可增加肾脏血流量,具有增强利尿的作用,但此用法的循证医学证据尚不足。
重组人脑钠肽不仅增强尿钠排泄、抑制交感兴奋和肾素-血管紧张素-醛固酮系统激活、抗增殖、扩张动、静脉血管,而且能改善肾血流动力学,具有加强利尿的作用。
尽管随机对照研究(如FUSIONII、ASCEND-HF、ROSE-AHF)未显示重组人脑钠肽改善心衰症状、增加尿量、改善肾功能、降低死亡率或再住院率等临床获益,但常规利尿剂效果不佳者,仍建议尝试使用以改善利尿效果,缓解心衰症状,可与襻利尿剂或托伐普坦联合应用[57,60,61,62]。对于急性失代偿性心衰患者,首先按1.5~2.0 μg/kg给予缓慢静脉推注(推注时间最好>1 min),之后按0.0075~0.0100 μg·kg-1·min-1剂量静脉滴注。血压偏低时不给予负荷量;最大维持量可以达到0.015~0.030 μg·kg-1·min-1;连续用药视情况可达5~7 d,注意监测血压,根据血压调整药物剂量。
血液超滤与肾小球滤过原理类似,在超滤泵负压吸引下,利用滤器半透膜两侧建立的压力梯度滤出水份及中小分子物质,血浆蛋白和血细胞不能透过滤膜孔而被留存,形成超滤液。超滤能可控地减低容量超负荷,排钠能力强于利尿剂,不引起电解质紊乱、减轻神经内分泌激活,并可恢复利尿剂疗效[63]。
UNLOAD研究显示与常规利尿剂治疗相比,早期超滤可更有效降低急性失代偿性心衰患者的体质量和减少90 d再住院,但常规利尿剂治疗组利尿剂用量较小[64,65]。随后的CARRESS-HF[66]研究则显示急性失代偿性心衰合并肾功能不全患者,当药物对照组给予高剂量利尿剂进行充分利尿治疗后,体质量下降、60 d死亡率和心衰再住院率均与超滤组相当。最新的AVOID-HF[67]研究则显示,住院心衰患者采用超滤治疗较高剂量利尿剂治疗相比,体质量变化相当,具有减少30 d和90 d心衰再住院或心血管事件的趋势,但未降低90 d死亡率,且局部不良并发症更多,因而如何选择超滤时机和心衰的适应证人群,仍有待探讨。
根据已有的循证医学证据,目前中国、欧洲指南和本"专家建议"均推荐血液超滤用于有明显的容量超负荷且常规利尿剂治疗效果不佳的心衰患者,以快速缓解淤血症状和液体潴留[37,68]。ACC/AHA指南则较积极推荐超滤治疗,不强调利尿剂抵抗,认为有明显液体潴留也是超滤指征[69]。
体外超滤治疗禁忌证[70]:(1)肌酐≥265.8 μmol/L(3 mg/dl)。(2)收缩压≤90 mmHg且有末梢循环不良。(3)严重凝血功能障碍。(4)严重二尖瓣或主动脉瓣狭窄。(5)需要透析或血液滤过治疗者。(6)全身性感染。
临床上可根据患者的实际液体负荷状态,决定脱水速度和脱水总量。通常开始治疗时血泵流量一般设为20~30 ml/min,流量越大心脏负荷越重,不宜超过50 ml/min。超滤速度设为200~300 ml/h,最大不超过500 ml/h(即血浆再充盈率)[70,71],根据患者的治疗反应和生命体征适当调整。通常建议24 h内超滤总量不宜超过5 000 ml,但是若患者血流动力学稳定,则可根据实际病情增加超滤的液体量。超滤治疗可能引起低血容量、低血压、肾功能异常,出血等不良反应,相应的对策包括控制超滤速度、血泵流量、监测血压、心率、出血体征、凝血指标等。超滤治疗期间一般不同时使用襻利尿剂,结束后可根据临床情况选择利尿剂的种类和剂量。治疗期间若血压进行性下降,收缩压低于90 mmHg伴心率加快,提示存在低血容量,应降低超滤速度或停止超滤治疗。超滤治疗终点要根据液体负荷状态、淤血症状和体征、体质量变化、中心静脉压、红细胞压积、肾功能指标等确定[70]。
特别指出,心衰专用超滤设备主要用于脱水,不能有效清除肌酐等代谢终产物,也不能纠正高血钾等严重电解质紊乱。血肌酐中度升高但未达到透析指征的患者,谨慎选用超滤治疗,超滤速度控制在200 ml/h以内,超滤总量不宜超过1 500 ml,并密切监测血肌酐变化[70]。如合并以下任何一种情况时,应进行血液透析治疗:液体复苏后仍然少尿,严重高钾血症(K+>6.5 mmol/L),严重酸中毒(pH<7.2),血尿素氮>25 mmol/L (150 mg/dl),血肌酐>300 mmol/L (>3.4 mg/dl)[68]。
容量管理中利尿剂抵抗是较棘手的问题,临床特点为心衰症状缓解不明显,住院心衰恶化率、出院后死亡率和再住院率升高。
利尿剂抵抗的定义:存在心原性水肿的情况下,大剂量利尿剂的利尿作用减弱或消失的临床状态[72,73],或尽管利尿剂剂量递增,仍无法充分控制液体潴留和淤血症状[74]。
利尿剂抵抗诊断标准尚未统一,通常利尿剂抵抗是指每日静脉应用呋塞米剂量≥80 mg或等同剂量利尿剂,尿量<0.5~1.0 ml·kg-1·h-1;或满足如下标准:(1)尽管使用了大剂量利尿剂(静脉应用呋塞米≥80 mg/d)仍持续存在淤血。(2)尿钠量/肾小球滤过钠量<0.2%。(3)每天口服呋塞米320 mg,但72 h内尿钠排泄量<90 mmol[75,76]。
心衰患者的临床特征和疾病严重程度、基线容量负荷状态、合并用药等个体间差异非常大,这些因素都影响利尿剂反应性。不建议仅根据一次利尿剂反应性定义利尿剂抵抗,应在利尿治疗期间连续监测液体出入量、体质量、电解质、肾功能、淤血症状体征的变化。
(1)未坚持服用利尿剂或钠摄入过多。(2)低钠血症。(3)低蛋白血症。(4)低血压。(5)药物相互作用:非甾体类抗炎药抑制前列腺素合成,减少肾脏血流量,降低利尿剂在肾小管中的浓度,导致利尿作用减弱[77]。与呋塞米有相同转运途径的药物(如丙磺舒、青霉素等)损害有机阴离子转运体使呋塞米分泌不足,在Henle′s襻中的浓度降低,达不到有效治疗剂量。(6)感染:如肺部感染。(7)低氧血症。
严重心衰患者多有不同程度的肾功能损害,进行性肾结构及功能损害导致钠水潴留。
严重心衰时胃肠低灌注、淤血,会导致口服利尿剂吸收延迟、吸收率降低,需增加剂量或改为静脉用药才能达到利尿目的。
(1)钠摄入过多者适当限制钠摄入。(2)避免应用非甾体类抗炎药物。(3)纠正低钠血症、低蛋白血症。低钠血症者输注高渗盐水提高晶体渗透压,低蛋白血症者输注白蛋白或血浆提高胶体渗透压。(4)低血压状态使肾脏灌注不足,利尿效果不佳,任何情况下发生低血压,都应在纠正低血压的前提下观察利尿剂反应性。
(1)首先增加襻利尿剂剂量,其次将口服剂型改为静脉剂型或更换襻利尿剂种类。(2)联合应用不同种类的利尿剂:襻利尿剂联合作用于远端肾小管或近端肾小管的利尿剂可产生相加或协同作用。呋塞米可联合双氢克尿噻(25~100 mg/d)、氯噻酮( 500~1 000 mg/d)、美托拉宗(2.5~10.0 mg/d),或阿米洛利(5~10 mg/d),联合螺内酯时应采用其利尿剂量(40~120 mg/d)。(3)襻利尿剂联用血管加压素V2受体拮抗剂:血管加压素V2受体拮抗剂只排水不排钠,与常规利尿剂合用是治疗心原性水肿(尤其合并低钠血症时),缓解液体潴留有效方法。(4)联用改善肾血流的药物:血压偏低的心衰患者可在常规利尿剂基础上短期应用小剂量多巴胺(2~5 μg·kg-1·min-1),血压正常者可联用小剂量静脉硝普钠或硝酸甘油,常规治疗后心衰症状仍不能改善时可联用重组人利钠肽。(5)血液超滤、血液透析滤过或腹膜透析:心衰容量超负荷、且常规利尿剂治疗效果不佳时推荐血液超滤治疗,如合并急性肾损伤或严重肾功能不全,选择血液透析滤过等肾脏替代治疗。慢性心衰患者长期利尿剂抵抗或合并慢性肾功能不全可行腹膜透析。(6)其他治疗:大量腹水时可行腹腔穿刺引流以降低腹腔内压改善肾小球滤过率,以改善利尿效果。
慢性心衰患者应在出现液体潴留的早期应用利尿剂。通常从小剂量开始应用,逐渐增加剂量至淤血症状和体征改善,待病情控制(肺部啰音消失,水肿消退,体质量稳定)后,即以最小有效量长期维持,并根据液体潴留情况随时调整剂量,目标是以最低有效利尿剂剂量维持"干体质量"[37]。
心衰时最早出现血流动力学淤血,即中心静脉压和心室充盈压增高,临床淤血相对延迟出现,一旦发生临床淤血则容量超负荷已经非常明显[33]。因此临床上有必要将慢性心衰患者的容量管理关口前移,早期监测到血流动力学淤血并采取去除容量超负荷的措施,进而避免慢性心衰患者反复症状加重而住院。慢性心衰患者发生容量超负荷则很快进入失代偿期,应尽早就医评估病情,必要时住院治疗。
首先判断患者总体容量状态,结合血压水平、外周组织灌注情况决定容量管理方案,启动容量管理流程(图2)。需要动态评价容量状态,及时改变容量管理目标。
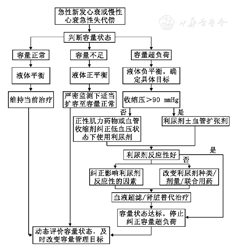

去除容量超负荷的治疗过程中,如果出现以下情况,需重新评估容量状态:(1)已经完全去除淤血症状和体征。(2)已达到最佳干体质量状态。(3)开始利尿剂治疗后血肌酐水平持续高于基线1.0 mg/dl。(4)患者血流动力学持续不稳定[78]。确定去除淤血需满足:颈静脉压<8 cmH2O,无端坐呼吸,基本无外周水肿[66]。
静脉应用利尿剂治疗结束后,分为以下两种情况:(1)已达到理想干体质量,且血肌酐稳定无进行性升高,可开始口服襻利尿剂并保持总液体平衡,同时加用纠正心衰的标准化药物治疗。(2)无容量超负荷情况下,血肌酐升高、血流动力学不稳定,则①暂停利尿剂,直到血肌酐水平稳定至少12 h后开始口服利尿剂治疗;②如果血肌酐持续升高或血流动力学持续不稳定,则可考虑适当补液[78]。
心衰是复杂的临床综合征,病因和临床状态个体差异大,容量状态复杂且动态变化,恰当的容量管理具有挑战性。目前缺乏足够的循证医学证据以形成指南、共识指导临床实践,专家组结合有限的循证医学证据和中国专家的临床实践经验提出了本"专家建议"。心衰的容量管理中仍存在较多难题需要探索,期待未来进行更多临床研究给出答案。
撰写组成员(按姓氏笔画排序):白 玲 许顶立 张宇辉 张 健张 瑶 罗素新 姚亚丽 黄 凯 熊长明 黎励文
专家组成员(按姓氏笔画排序):马爱群 王 江 方理刚 白 玲朱文玲 许顶立 杨艳敏 杨新春 余 静 沈璐华 张 庆张 健 张 静 张 瑶 张宇辉 张抒扬 罗素新 季晓平郑昭芬 姚亚丽 郭小梅 唐其柱 黄 凯 黄 洁 黄 峻黄晓红 董吁钢 董念国 董建增 熊长明 樊朝美 黎励文
学术秘书:王运红 张荣成 邹长虹

























