
Takotsubo综合征(TTS)临床表现与急性冠状动脉综合征(ACS)类似,病情轻重与诱发因素相关,近年来研究报道逐渐增多。本文通过对TTS的流行病学,发病机制,临床表现,诊断标准,治疗及预后评分等研究进展作一综述,以提高对于该病的认识。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
Takotsubo综合征(Takotsubo syndrome,TTS)常由精神或身体等刺激因素引起快速可逆性心肌病变,于1990年由日本学者首先提出,因心脏结构改变类似日本章鱼壶,又称为章鱼壶心肌病(Takotsubo cardiomyopathy),其他名称有心碎综合征(broken heart syndrome)或心尖球形综合征(apical ballooning syndrome)等[1, 2]。由于该病是广泛情感或身体刺激因素导致左心室功能不全,2018年国际共识称为TTS[1],本文也使用TTS名称。
TTS最初被认为主要影响亚洲人,但目前关于TTS报道不断增多。2008年美国TTS约占总住院患者的0.02%[3],从2007到2012年间,TTS发病率增加超过3倍,从2007年52/百万出院患者到2012年178例/百万出院患者[4]。TTS约占怀疑ST段抬高心梗患者(ST segment elevation myocardial infarction,STEMI)的2%[5],女性怀疑STEMI患者的5%~6%[6];TTS复发率约为1.8%~4%每人年[7, 8]。重症患者中约有1.5%为TTS,,8%心源性休克为TTS[9]。在新型冠状病毒肺炎(COVID-19)患者中,TTS约占心脏功能异常患者的2%~5.6%[10, 11]。急性冠状动脉综合征(acute coronary syndrome,ACS)患者行心室造影检查提示,TTS发病率明显上升,由疫情前1.5%~1.8%上升至疫情期间的7.8%[12]。
TTS病理生理机制尚未明确。目前认为交感神经过度激活可能是TTS发病的主要机制。TTS急性期肾上腺髓质嗜铬细胞释放肾上腺素和去甲肾上腺素,及交感神经末端释放的去甲肾上腺素大量进入血液循环,形成儿茶酚胺风暴。儿茶酚胺风暴通过直接儿茶酚胺毒性,肾上腺素受体介导的损害,心外膜和冠脉微血管的收缩/痉挛,增加心脏做功,斑块破裂,激活心肌存活通路,共同导致心肌损害[1,13]。回顾性研究发现,由药物导致TTS患者中有68.2%与儿茶酚胺相关,36.3%来自外源性儿茶酚胺输注,31.9%由于潜在拟肾上腺素能作用所致[14]。绝经后女性雌激素缺乏使其容易发病,女性年龄>55岁发生TTS的风险增加5倍[7]。基因突变和遗传易感性也促进TTS发生[1]。55.8%的TTS患者有神经系统或精神病史,约为年龄、性别匹配的ACS患者2倍[7],提示神经系统或精神异常是TTS易感因素。
新冠期间TTS发病机制除交感反应增强外,还与疫情相关经济、社会、心理等应激机制[12];以及病毒感染患者心理压力大,炎症风暴,微循环障碍等因素有关[15]。
在大型国际TTS注册研究(The International Takotsubo Registry)中,1 750名患者中89.8%为女性,且90%为67~70岁女性[7]。但在,目前围生期TTS病例报道不断增多[16]。TTS分经典型——心尖型约81.7%,非经典型包括心室中部型14.6%,基底型2.2%,局灶型1.5%[7];双心室受累<0.5%[17]。与经典型TTS相比,非经典型TTS患者发病年龄更小,ST段压低比例更多,神经系统病史更多,左心室射血分数(left ventricular ejection fraction,LVEF)更高,利钠肽水平更低,但两者预后相似[18]。TTS患者中约36%有身体刺激因素,如脑出血,抽搐,哮喘发作,消化道出血,嗜铬细胞瘤,尿脓毒症,分娩,肿瘤化疗,各种感染,手术,麻醉等;28%无明显刺激因素;27%有情感刺激因素,如抑郁,离婚,害怕,失业,新工作,退休,负债,吵架,自然灾害,车祸等[7];其中约有4%由于积极情绪诱发,如中奖、生日、婚礼等,因此又称“开心综合征”[19]。女性患者情感诱因更多,男性患者身体刺激更常见[7]。
TTS主要临床表现为胸痛(75.9%)、呼吸困难(46.9%)、晕厥(7.7%)等[7],难与ACS鉴别。实验室检查方面,87%的TTS患者肌钙蛋白升高,但升高幅度小于ACS患者;83%的TTS患者利钠肽水平升高达5.9倍正常上限,显著高于ACS患者[7]。
TTS患者心电图44%ST段抬高,41%T波倒置,8%ST段压低,5%左束支阻滞。相比ACS患者,TTS患者心电图ST段抬高比例相似,但ST段压低发生较低(8.3% vs. 31.1%,P<0.001)。心电图鉴别TTS与ACS流程如图1[20]。
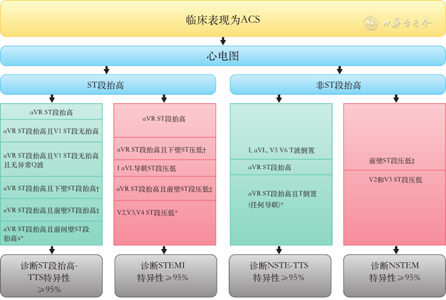

ACS为急性冠状动脉综合征,TTS为Takotsubo综合征,STEMI为ST段抬高心肌梗死,NSETMI为非ST段抬高心肌梗死
与ACS患者比较,TTS患者LVEF降低比例高达86.5%,而ACS患者中仅54.2%存在LVEF降低;且TTS患者LVEF降低幅度更加明显[(40.7±11.2)%比(51.5±12.3)%,P<0.001];93%TTS患者左心室舒张末压力大于11 mmHg。虽然TTS与ACS患者的住院并发症相似,包括急性心衰(12%~45%),二尖瓣反流(14%~25%),左心室流出道动态梗阻(10%~25%),心源性休克(6%~20%)等[7,21, 22, 23];但TTS患者严重并发症更多,包括室性心动过速(室速)(3.0%),心室血栓(1.3%~3.3%),心脏破裂(0.2%)[7,24]。重症TTS患者85%使用儿茶酚胺药物,20%需要主动脉内球囊反搏治疗[9]。而且使用儿茶酚胺导致的TTS病情更重,左心室功能障碍更严重,并发症更多[25],因此,TTS更需要我们重视。
TTS诊断标准包括2008年梅奥标准[26]:1. 有短暂左心室室壁运动异常(wall motion abnormalities,WMA),并且超过单支冠状动脉分布;2. 冠状动脉造影提示无冠状动脉阻塞或斑块破裂,3. 新发心电图异常或肌钙蛋白升高;4. 无心肌炎或嗜铬细胞瘤。2016年发表的欧洲心脏病学会心力衰竭协会(the Heart Failure Association of the European Society of Cardiology,HFA-ESC)立场声明[27]予以适当修订。
2018年,TTS国际共识[1]提出诊断标准如下:1. 表现为一过性左心室功能不全(运动低下、无运动、矛盾运动),心尖球形改变或心室中部、基底部或局部WMA;WMA可能持续存在一段时间,或者无法检测到恢复,如在恢复前死亡。右心室受累可以存在。除了以上节段性室壁运动形式,各种类型TTS可转化。节段性WMA通常超过单支心外膜血管分布范围。然而,罕见病例节段性WMA在单支冠状动脉血管分布范围内(局灶TTS)。2. 情感、身体或合并刺激因素导致TTS,但非必须;3. 神经系统疾病(蛛网膜下腔出血、卒中/短暂性脑缺血发作、抽搐)以及嗜铬细胞瘤都可作为诱因;4. 新发心电图改变(ST抬高、压低、T波倒置、QTc延长),罕见病例无心电图改变;5. 大多数病例心脏标志物(肌钙蛋白和肌酸激酶)中度升高;常见利钠肽水平明显升高;6. 存在明显冠状动脉疾病不是TTS的禁忌征;7. 没有感染性心肌炎证据,推荐行心脏磁共振(cardiac magnetic resonance,CMR)检查,除外感染性心肌炎,明确TTS诊断;8. 绝经后女性为主要受累人群。可见,TTS诊断仍以临床表现为主,明确指出TTS患者可以合并有冠状动脉疾病,强调心功能一过性好转是TTS主要影像学特点。
超声心动图是TTS的一线影像学诊断方式,可在急性病程评估左心室收缩、舒张功能,识别典型心尖-心室中部球形改变及室壁环形运动障碍;早期发现并发症如左心室流出道梗阻,二尖瓣反流,右心室受累,左心室血栓和心包积液等,以及监测心脏收缩功能恢复情况。TTS患者冠状动脉造影基本正常,但约有10%的TTS患者有阻塞性冠状动脉粥样硬化斑块,但TTS患者通常左心室WMA超出单支冠状动脉分布范围。左心室造影能评估左心室功能和形态,识别超声心动图难以诊断的非经典型TTS,如心室中部型TTS心尖部收缩正常而心室造影可见鹰嘴表现[28]。经典TTS中30.4%有“心尖乳头征(apical nipple′ sign)”,表现为心尖极小部分心肌收缩良好,是TTS与左前降支导致前壁STEMI鉴别的重要标志[29]。CMR检查能提供心脏结构、功能广泛信息,包括组织特征,以及鉴别诊断,如心肌梗死和心肌炎。在急性胸痛怀疑TTS患者,冠状动脉CT血管造影能排除其他原因,可无创评估冠状动脉情况;而核素显像评估TTS作用还未明确[30]。
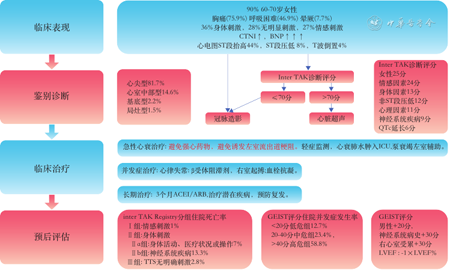
TTS鉴别诊断主要包括ACS、嗜铬细胞瘤合并心肌病、心肌炎等[17]。有胸痛或呼吸困难合并心电图ST段抬高患者,共识推荐行冠状动脉造影检查排除ACS;非ST段抬高患者进行Inter TAK 诊断评分[31](女性25分,情感刺激24分,身体刺激24分,无ST段压低12分,精神疾患11分,神经系统疾患9分,QTc延长6分),≤70分TTS可能性为低度或中度,建议行冠状动脉造影排除ACS;>70分TTS可能性高,首选超声心动图检查(图2)[1]。但15.3%TTS患者合并冠状动脉疾病[7],因此,共识明确指出,明显冠状动脉疾病不是TTS的除外标准,而且ACS本身可能诱发TTS[1]。嗜铬细胞瘤心肌病的症状通常为慢性或亚急性,但可合并TTS存在;有学者称嗜铬细胞瘤导致的心肌病为TTS样综合征或TTS样心功能不全;但共识指出,嗜铬细胞瘤可作为TTS继发诱因[1,17]。

另外,后者TTS需与Kounis综合征鉴别,后者又称为过敏性心肌缺血综合征,指由严重过敏反应诱发的心绞痛、急性心肌梗死或ACS[32];其为伴肥大细胞激活的一种ACS,占美国过敏住院患者的1.1%[33],且Kounis综合征患者中约1.5%考虑为TTS[34],TTS与Kounis综合征鉴别困难[35]。
TTS治疗包括急性心衰治疗,并发症治疗和出院后治疗[21](图2)。
在心脏功能最“脆弱”的时候应尽可能避免“鞭打快牛”的治疗[36],避免使用肾上腺素、去甲肾上腺素、异丙肾上腺素、米力农,多巴酚丁胺等正性肌力药物。轻度TTS伴或不伴心衰患者建议收入心脏监护室至少48小时,给予血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitors,ACEI)/血管紧张素受体阻滞剂(angiotensin receptor blockers,ARB)、β受体阻滞剂;合并肺水肿或心衰收入监护室,给予ACEI/ARB、β受体阻滞剂,如果无左心室流出道梗阻,可以给予利尿剂和硝酸酯类;合并原发心脏泵衰竭导致心源性休克,考虑左西孟旦,左心室辅助或静脉-动脉体外膜肺氧合;由左心室流出道梗阻导致心源性休克,予补液、短效β受体阻滞剂、左心室辅助(如Impella),避免利尿、硝酸酯和主动脉内球囊反搏。
TTS合并室速、心室颤动(室颤)、尖端扭转型室速,QTc延长等心律失常,建议β受体阻滞剂、临时起搏器;避免使用导致QTc延长的药物;在心动过缓伴QTc>500 ms避免β受体阻滞剂;合并血栓或栓塞的患者建议使用肝素或维生素K依赖拮抗剂或直接作用口服抗凝药治疗,在LVEF<30%时建议预防性抗凝治疗。
TTS患者出院后给予ACEI/ARB至3个月或节段性WMA恢复;治疗潜在疾病;预防复发可给予激素替代,ACEI/ARB。
TTS有身体刺激因素、急性神经或精神疾病、入院肌钙蛋白>10倍正常上限、LVEF<45%、持续ST段抬高、呼吸困难、心率快和血压低、男性、年龄>70岁等均提示短期预后更差[7,37, 38, 39, 40, 41];合并心源性休克或心脏骤停的TTS患者,短期死亡率增加10倍[22,42]。TTS 患者平均LVEF由入院时41.1%恢复至出院前51.2%,随访60天恢复至59.9%,因此,既往认为TTS长期预后良好。但随访发现,TTS每患者年的主要不良心脑血管事件发生率为9.9%,死亡率为5.6%[7];TTS具有长期临床影响,包括持续心衰症状,运动试验心脏活动受限[43];其长期预后与年龄、性别匹配的ACS患者相似[40]。
TTS根据刺激因素分3组:Ⅰ组:情感刺激导致TTS;Ⅱ组:身体刺激导致TTS(Ⅱa组:继发于身体活动、医疗状况或操作;Ⅱb组:TTS继发于神经系统疾病);Ⅲ组:TTS无明确刺激因素。各组住院死亡率分别为1%、7%、13%和3%(P<0.01);对比Ⅰ组,Ⅱa组、Ⅱb组和Ⅲ组的5年死亡率风险比分别为3.78、5.76和2.14(P<0.01);该分组可评估TTS短期及长期预后[40]。
德国和意大利应激性心肌病(German and Italian Stress Cardiomyopathy,GEIST)注册研究预后评分[44](男性20分,神经系统疾病20分,右心室受累30分,总分相加后减去患者LVEF绝对值),住院并发症发生率(死亡、肺水肿,有创通气,心源性休克)在低危组(<20分)、中危组(20~40分)和高危组(>40分)分别为12.7%,23.4%和58.8%(P<0.01);随访2.6年有住院并发症患者死亡率为40%,是无住院并发症患者的4倍;该评分可早期识别TTS风险,高风险患者需在监护室住院,低风险患者可在几天内出院(图2)。
TTS临床并不少见,多种情感、疾病等都可导致发病;其临床表现与ACS类似,诱因不同病情轻重不同,长期预后差异巨大,早期识别高危患者并及时处理心衰、心律失常等并发症,并注意随访。
所有作者均声明不存在利益冲突



























