
总结炎症性肠病患者服用硫唑嘌呤药物(AZA)产生不良反应的现状,处理措施及预后。
对1994年12月至2015年9月在浙江大学医学院附属邵逸夫医院接受硫唑嘌呤治疗的364例炎症性肠病患者的病历资料进行回顾性分析,其中克罗恩病292例,溃疡性结肠炎72例。
364例炎症性肠病患者中147例(40.4%)患者出现不良反应共178例次,包括骨髓毒性74例,肝功能异常31例,胃肠道反应18例,感染14例,关节痛11例,其他不良反应有胰腺炎、头晕头痛、皮疹、脱发、发热等共30例。其中发生在用药1个月内的不良反应占42.1%(75/178)。因不良反应停药的患者占20.1% (73/364),停药患者中的52.1% (38/73)发生在用药1个月内。所有不良反应或自行好转或相应处理后恢复,未出现不可逆的严重不良反应。
硫唑嘌呤治疗炎症性肠病不良反应发生率及停药率较高,且表现多样,以骨髓毒性及肝损害多见,需重视不良反应的监测,尤其是用药早期。特殊感染、胰腺炎及粒细胞缺乏病例相对少见。硫唑嘌呤药物治疗炎症性肠病相对安全。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅,光盘如有质量问题,请向编辑部调换
硫唑嘌呤(azathioprine,AZA)是目前国内炎症性肠病(inflammatory bowel disease,IBD)的主要治疗药物之一[1]。国外对于硫唑嘌呤药物的不良反应、发生率及可能的机制等已进行了深入研究。但对中国IBD患者使用硫唑嘌呤的现状目前尚缺乏研究。因此浙江大学医学院附属邵逸夫医院进行了一项大样本回顾性研究,调查该院1994—2015年所有使用硫唑嘌呤的IBD住院患者不良反应的发生情况,不良反应类型,发生几率,预后等。旨在探讨中国人群硫唑嘌呤使用的情况,为临床更安全有效地应用硫唑嘌呤药物,尽量避免不良反应的发生提供理论依据。
回顾性分析1994年12月至2015年9月于浙江省邵逸夫医院消化科住院患者的病历资料。纳入标准:(1)明确诊断为IBD;(2)曾接受硫唑嘌呤治疗;(3)临床资料完整。IBD的诊断标准参照《炎症性肠病诊断与治疗的共识意见(2012年·广州)》[2]。按上述标准共纳入患者411例,排除资料不完整47例,最终纳入分析364例。其中克罗恩病(Crohn′s disease,CD)292例,溃疡性结肠炎(ulcerative colitis,UC)72例,男性198例,女性166例,平均年龄(35.7±12.4)岁。
口服硫唑嘌呤的剂量一般在1~1.25 mg·kg-1·d-1,每日分1~2次口服。收集和记录入选患者的年龄、性别、体重、诊断,硫唑嘌呤用药时间、用药量、合并用药情况及不良反应发生时间、类型、表现、停药时间等住院及随访资料(随访资料通过复诊或电话随访收集)并进行统计学分析。
药品不良反应的判断标准参照国家食品药品监督管理局制定的原则。定义白细胞减少为成人外周血白细胞计数持续<4×109/L;定义粒细胞缺乏为外周血中性粒细胞绝对值<0.5×109/L。
使用SPSS15.0软件进行统计学分析。正态分布的计量资料以 ±s表示,采用t检验进行分析;计数资料以例数和百分率表示,采用χ2检验。以P<0.05为差异有统计学意义。
±s表示,采用t检验进行分析;计数资料以例数和百分率表示,采用χ2检验。以P<0.05为差异有统计学意义。
硫唑嘌呤使用剂量:平均起始剂量(48.3 ±10.2) mg/d (25~75 mg/d)。维持剂量:14例25 mg/d维持口服,167例50 mg/d维持口服,53例增加剂量至75 mg/d,102例增加剂量至100 mg/d,15例增加剂量至125 mg/d,13例增加剂量至150 mg/d。
硫唑嘌呤使用时间:用药时间最短5 d,最长96个月,平均(9.5±2.8)个月。
合并用药情况:157例(43.1%)早期单独联用激素,98例(26.9%)早期单独联用生物制剂,39例(10.7%)单独联用5-ASA,同时联用激素和5-ASA者25例(6.9%),同时联用生物制剂和5-ASA者32例(8.8%),单用硫唑嘌呤者13例(3.6%)。
147例患者用药后出现不良反应,发生率40.4%。其中男性83例,女性64例,男女比1.29∶1。
不良反应在不同年龄段的发生情况:发生不良反应的患者平均年龄(37.7±12.5)岁,不同年龄阶段发生不良反应的比例见图1。
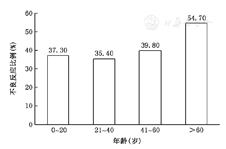

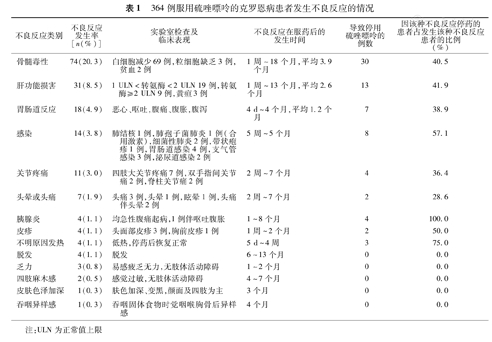
用药后出现不良反应的147例患者中,克罗恩病118例,溃疡性结肠炎29例。发生不良反应的时间平均为(3.2±0.9)个月,其中发生在用药1个月内和1年后的分别占42.1%和7.9%。用药后出现不良反应的时间,见表1。
364例服用硫唑嘌呤的克罗恩病患者发生不良反应的情况
364例服用硫唑嘌呤的克罗恩病患者发生不良反应的情况
| 不良反应类别 | 不良反应发生率[n(%)] | 实验室检查及临床表现 | 不良反应在服药后的发生时间 | 导致停用硫唑嘌呤的例数 | 因该种不良反应停药的患者占发生该种不良反应患者的比例(%) |
|---|---|---|---|---|---|
| 骨髓毒性 | 74(20.3) | 白细胞减少69例,粒细胞缺乏3例,贫血2例 | 1周~18个月,平均3.9个月 | 30 | 40.5 |
| 肝功能损害 | 31(8.5) | 1 ULN<转氨酶<2 ULN 19例,转氨酶≥2 ULN 9例,黄疸3例 | 1周~13个月,平均2.6个月 | 13 | 41.9 |
| 胃肠道反应 | 18(4.9) | 恶心、呕吐,腹痛、腹胀,腹泻 | 4 d~4个月,平均1.2个月 | 7 | 38.9 |
| 感染 | 14(3.8) | 肺结核1例,肺孢子菌肺炎1例(合用激素),细菌性肺炎2例,带状疱疹1例,胃肠道感染4例,支气管感染3例,泌尿道感染2例 | 5周~5个月 | 8 | 57.1 |
| 关节疼痛 | 11(3.0) | 四肢大关节疼痛7例,双手指间关节痛2例,脊柱关节痛2例 | 2周~7个月 | 4 | 36.4 |
| 头晕或头痛 | 7(1.9) | 头痛3例,头晕1例,眩晕1例,头痛伴头晕2例 | 2周~7个月 | 2 | 28.6 |
| 胰腺炎 | 4(1.1) | 均急性腹痛起病,1例伴呕吐腹胀 | 1~8个月 | 4 | 100.0 |
| 皮疹 | 4(1.1) | 头面部皮疹3例,胸前皮疹1例 | 1周~2个月 | 2 | 50.0 |
| 不明原因发热 | 4(1.1) | 低热,停药后恢复正常 | 5 d~4周 | 3 | 75.0 |
| 脱发 | 4(1.1) | 脱发 | 6~13个月 | 0 | 0.0 |
| 乏力 | 3(0.8) | 易感疲乏无力,无肢体活动障碍 | 1~2个月 | 0 | 0.0 |
| 四肢麻木感 | 2(0.5) | 感觉过敏,无肢体活动障碍 | 4~7个月 | 0 | 0.0 |
| 皮肤色泽加深 | 1(0.3) | 肤色加深、变黑,颜面及四肢为主 | 3个月 | 0 | 0.0 |
| 吞咽异样感 | 1(0.3) | 吞咽固体食物时觉咽喉胸骨后异样感 | 4个月 | 0 | 0.0 |
注:ULN为正常值上限
147例患者出现不良反应共178例次,发生不良反应的平均时间为(3.2±0.9)个月。在服药后1个月内、2~3个月内、4~6个月内、7~12个月内以及1年发生不良反应的例次分别占总例次的42.1%、21.9%、15.7%、12.4%和7.9%。
用药后出现的不良反应以骨髓毒性最常见,其次为肝功能损害、胃肠道反应、感染、关节疼痛、头痛、头晕、皮疹、发热和胰腺炎等。
因不良反应停药的患者达73例(20.1%),其中因骨髓毒性、肝功能损害、感染和胃肠道反应停药的分别占41.1%、17.8%、11.0%和9.6%。导致停药的不良反应类别、不良反应发生率、临床表现、发生时间及导致停用硫唑嘌呤的原因见表1。
停药者平均用药时间为(3.1±0.7)个月。发生在用药1个月内停药的患者达52.1%,76.7%发生在半年内,9.6%发生在用药1年后。其中因白细胞减少停药有48%发生在1个月内,1例用药1个月内发生粒细胞缺乏。
364例IBD患者使用硫唑嘌呤发生不良反应的预后总体良好,无死亡病例。
74例发生骨髓抑制的患者中69例出现白细胞减少(不包括粒细胞缺乏),均在加用升白细胞药物(多为口服药物,仅6例注射粒细胞集落刺激因子)或减量或停用硫唑嘌呤后,血白细胞升至正常范围。粒细胞缺乏患者3例,均在使用粒细胞集落刺激因子后粒细胞恢复正常。2例贫血患者经口服补铁药物治疗后血红蛋白升至正常范围。
31例出现肝功能损害的患者中35.5%(11例)联用护肝药物或减量硫唑嘌呤后肝功能正常,7例联用护肝药物并更换硫唑嘌呤为6-巯基嘌呤口服,13例停用硫唑嘌呤的患者经护肝治疗后肝功能均正常。
14例服硫唑嘌呤后现现感染的患者经抗感染治疗后治愈。4例发生急性轻症胰腺炎的患者在停药及治疗后痊愈。其他不良反应包括胃肠道反应、关节痛、头晕、头痛、皮疹及不明原因发热等均能耐受或停药及对症处理后缓解。
本研究为目前国内最大样本量的硫唑嘌呤治疗IBD不良反应的分析报告,结果显示其不良反应总发生率为40.4%,主要包括骨髓抑制、肝功能损害、胃肠道反应、感染等;不良反应在用药过程中的任何时间均可能出现,但更易发生在早期;因不良反应停药率达20.1%。同时发现高龄患者(尤其是超过60岁)更易出现不良反应。
硫唑嘌呤是治疗IBD的一线用药。国外报道其不良反应发生率可达67.0%,因不良反应停药率为8.0%~45.0%,停药发生在用药后2周内的占41.0%[3,4]。与本研究结果相似。硫唑嘌呤的早期不良反应为非剂量依赖的特异质反应,是导致停用硫唑嘌呤的最常见原因,因此在用药早期应密切监测不良反应的发生。本研究提示在用药1年后仍有7.9%的患者发生不良反应,故对于迟发性的不良反应仍不能忽视。
骨髓抑制是硫唑嘌呤最常见且最严重的不良反应,国外文献显示,硫唑嘌呤致骨髓抑制的累计发病率为8.0%,病死率1.0%,发生在用药13 d~28年,但在开始数月内发生率较高[5,6]。本研究中骨髓毒性发生率20.3%,高于文献报道的发生率。早期发生的骨髓抑制可能与剂量无关,与巯嘌呤甲基转移酶(TPMT)基因多态性可能有关[7]。根据基因多态性检测结果个体化用药,可以减少骨髓抑制不良反应的发生。本研究中因骨髓毒性导致的停药率达40.5%,但停药后给予相应治疗后均能恢复正常,无致死病例,表明硫唑嘌呤致骨髓抑制大多为可逆性,且程度较轻,停药或相应处理后可恢复。
本研究中硫唑嘌呤致肝损害的发生率为8.5%,高于国外文献报道的3.0%[8],发生肝损害的停药率达41.9%,但均为轻中度肝功能异常,经处理后均能恢复。部分患者换用6-巯基嘌呤后可耐受,肝功能好转,值得同行借鉴,随访未发现肝衰竭等重症病例。本研究中硫唑嘌呤的胃肠道反应发生率为4.9%,14例发生在1个月内,8例发生在1周内,说明胃肠道反应为硫唑嘌呤的早期不良反应表现,也是迫使患者停药的一大原因,可能与肌醇三磷酸焦磷酸酯酶的异型性有关[9],而与巯嘌呤甲基转移酶基因的多态性无关[10]。
硫唑嘌呤属于免疫抑制药物,在发挥免疫调节作用的同时也不可避免地带来免疫监视功能减低,因此发生机体感染的几率也增加[11]。本研究中硫唑嘌呤治疗后感染以呼吸道(肺部)及胃肠道感染多见,包括诱发肺结核及肺孢子菌肺炎各1例,这在国外文献中较少报道。其中肺结核患者治疗前结核菌筛查阴性,但治疗过程中出现肺部结核感染,提示除在用药前进行特殊病原筛查,在用药过程中仍需密切监测。另一例肺孢子菌肺炎为老年女性,合并糖尿病,同时联用激素,提示对于这类高危患者需高度警惕机会性感染的发生。硫唑嘌呤可引起药物性胰腺炎,发生率为0.4%~5.3%,本研究病例中胰腺炎发生率为1.1%,发生机制不清楚,可能通过机体过敏反应或免疫反应释放激活胰酶的物质如组胺等而诱发[12,13,14,15]。本研究中硫唑嘌呤诱发的均为轻症急性胰腺炎。长期服用硫唑嘌呤有增加患淋巴瘤的风险[16],但本次回顾性分析未发现继发淋巴瘤病例,需继续随访观察。
综上所述,硫唑嘌呤治疗炎症性肠病的不良反应发生率及停药率均较高,且表现多样,以骨髓毒性及肝损害多见,但程度较轻,经停药或治疗后可逆,未发现重症致死病例,所以该药物仍相对安全,适于临床使用。尽管如此仍需重视用药早期不良反应监测,同时对迟发性不良反应也不能忽视。对于粒细胞缺乏、胰腺炎及特殊病原感染等情况因可能严重影响患者预后,故需引起临床医师重视,注意用药前特殊疾病筛查,用药后加强监测,重点关注高危人群如联用激素、生物制剂、高龄、合并基础疾病的患者,及早发现严重不良反应征兆,及时处理从而改善患者预后。



























