
版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅,光盘如有质量问题,请向编辑部调换
肠道超声在国外用于克罗恩病(Crohn′s disease,CD)的诊断治疗已有30年历史[1,2,3,4],因其操作简便、经济、无辐射已成为克罗恩病长期随访理想的检查方法。克罗恩病合并腹腔脓肿的累计发病率为10%~30%[5],临床治疗较困难。中山大学附属第一医院是国内克罗恩病肠道超声领域起步较早的医院之一,目前已治疗患者600余例,积累了较多临床经验。本文结合国内外文献对克罗恩病合并腹腔脓肿的超声诊断、超声介入治疗与置管引流相关技术进行总结和阐述。
肠道超声检查前2 d嘱患者低渣半流饮食,检查前禁食6 h,必要时清洁灌肠。检查时通常使用的探头频率为3.5~10.0 MHz,首先运用腹部探头进行全腹结肠、小肠肠管检查,然后再用线阵探头详细检查目标肠段肠壁结构和壁内血流。正常肠壁厚度小于3 mm,超声声像图显示为5层结构,由内至外分别为高、低、高、低、高5层回声,分别代表黏膜面、黏膜肌层、黏膜下层、固有肌层和浆膜面。彩色多普勒超声显示肠壁内血流信号可采用Limberg分级:0级,正常肠壁;Ⅰ级,肠壁增厚,未探及血流信号;Ⅱ级,肠壁增厚,见点状或短条状血流信号;Ⅲ级,肠壁增厚,见长条状的血流信号;Ⅳ级,肠壁增厚且出现与肠系膜相连的长条状血流信号,分级越高,提示克罗恩病活动性越强[1,2,3,4]。
克罗恩病典型的超声表现:(1)肠壁增厚(≥4 mm)[1,2,3,4]。受累肠壁因水肿增厚横切面呈"靶环征",纵切面呈"水管征"或"三明治征"。(2)疾病活动期肠壁血供丰富。(3)多节段受累,可累及全消化道。(4)其他:梗阻、脓肿等超声表现。
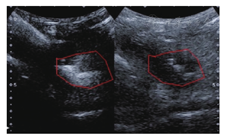
常规超声显示克罗恩病患者腹腔脓肿表现为累及的增厚肠壁旁局限性低回声区,形态不规则、内回声浑浊,可有高回声气体回声,壁不规则,囊壁及周围组织可见较丰富血流信号,液区内未见血流信号,可与病变肠段分界不清形成包块。静脉超声造影显示脓腔内无增强,周围炎性组织和病变肠段提示高增强。于腔内注入稀释造影剂在造影模式下可清晰地观察到脓腔的位置、大小及液化范围(图1)。根据文献系统综述提示,肠道超声对腹腔脓肿的检测具有与CT和MR相似的较高敏感度和高特异度[6,7],尤其对表浅的腹腔脓肿诊断效能更佳。

介入超声(intervention ultrasound)是现代医学超声重要的诊断技术,其特点是在实时超声引导下完成各种穿刺活检、抽吸、插管、注射药物等治疗操作,以达到诊断或治疗的目的。超声引导下经皮穿刺置管引流术是对体内超声可显示的肝脓肿、盆腹腔脓肿、膈下脓肿、阑尾周围脓肿等各种脓肿的主要治疗手段之一。文献报道超声引导穿刺抽脓能达到与切开引流手术相类似的疗效[8,9,10,11]。目前超声引导下穿刺置管引流治疗克罗恩病合并的腹腔脓肿是临床常用的治疗方法。
克罗恩病合并腹腔脓肿的治疗目标是引流脓腔、控制感染,然后切除病灶。若不能及时引流可能引起脓毒血症,多脏器功能衰竭,甚至危及生命。2017年欧洲克罗恩病和结肠炎组织指南推荐(推荐等级EL3)在使用抗生素控制感染下,早期行介入置管引流或手术切开引流控制炎症后,再行病变肠段切除手术治疗[12]。传统的治疗方法是手术切开引流脓肿。随着超声介入技术的发展,在引流方法上应追求以最小创伤达到最佳的引流效果,经皮穿刺置管引流技术极大改进了腹腔脓肿的治疗策略,在病变肠段手术前用微创方法引流脓腔、待炎症消退后再实施手术,以达到更好的手术效果[13]。
超声置管引流的优点:研究表明经皮穿刺引流脓肿效果好,可使70.0%克罗恩病合并腹腔脓肿的患者得到有效治疗[14,15],其优势在于:(1)准确定位:实时超声引导下穿刺可准确定位脓肿的部位、大小、深度,决定最佳穿刺角度及进针途径,避开邻近脏器,避免误入或损伤病变累及的肠管和腹腔内大血管。(2)微创:微创操作可使脓肿壁保持完整,防止感染扩散。(3)精准注射药物:可在超声引导下向脓腔局部注入抗生素或其他治疗克罗恩病的药物,甚至生物制剂,增加局部药物浓度,缩短炎症治愈时间。(4)实时监测及复查:超声可实时监测或反复多次观察脓肿引流情况,并可在超声引导下调整引流管长度和角度,持续抽吸脓液直至痊愈。
超声置管引流的禁忌证:(1)没有合适的穿刺路径,无法避开大血管、重要脏器和肠管。(2)腹腔脓肿早期尚未明显液化。(3)患者有凝血功能障碍。(4)有严重心肺功能疾病。
患者仰卧位或其他合适体位,在实时超声引导下确定穿刺点后常规消毒皮肤,铺无菌洞巾,再次确定穿刺点、穿刺途径和深度,2%利多卡因局部麻醉后进穿刺针,避开肠管和大血管沿引导线至腹腔脓肿处,拔出针芯,抽吸的脓液标本即送细菌培养及药敏试验检查,再插入导丝,开皮,置入引流管,接引流瓶,局部包扎,术后观察30 min,无不适可返回病房。一般需引流3~14 d,超声复查脓腔基本消失可拔除引流管。
置管引流术中需注意:(1)因脓腔内脓液浑浊,含坏死物、纤维块等物质,穿刺置管引流时宜首选口径较大的引流管。(2)选择合适路径,避开大血管和肠管,尤其对位置较深或盆腔的脓肿(盆腔脓腔与肛周脓肿相通时)可从肛周脓肿处置管,也能达到盆腔脓肿引流的目的。(3)对于多个分隔脓腔,可采用多点穿刺抽脓,使每个腔隙的脓液充分引流。(4)注意冲洗引流管,保持导管通畅,以便脓液顺利流出,引流不畅时可在超声引导下调整引流管位置。
经腹腔内超声造影(intra-cavitary contrast-enhanced ultrasound,IC-CEUS)是在克罗恩病患者腹腔脓肿穿刺抽脓后将造影剂注入脓腔内,在造影模式下观察脓腔、瘘管、肠腔的情况,可用于对脓腔的观察和肠瘘的诊断(图1,图2)。本研究团队IC-CEUS均由有超声介入和超声造影经验丰富的超声医师操作。具体操作流程为超声引导下将21-gauge细针穿刺活检(fine needle aspiration,FNA)针(proCore,cook endoscopy,Winston-Salem,NC)置入克罗恩病病变累及肠段旁的脓腔行脓肿穿刺引流,再通过穿刺针注入10~30 ml的稀释超声造影剂声诺维(Bracco Co.,Ltd,Italy,diluted to 1∶300 with 0.9% saline)。在造影剂模式下观察并储存图像,对肠瘘瘘管和邻近器官的解剖关系进行实时评估。IC-CEUS图像评估得到以下信息:(1)确定瘘管的存在并分析其解剖学形态;(2)评估瘘管及其旁病变肠管的关系;(3)评估瘘管及其连接脓腔和其他腹部脏器(如累及膀胱)的关系。以手术病理诊断作为参考标准。
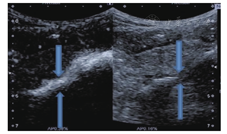

IC-CEUS是中山大学附属第一医院一项具有创新性、实用性的研究,并在国内外首次报道[16],该技术通过管道直接注入管腔而获得管道的直视化信息,进而获得瘘管形态解剖、走行及内外口的准确诊断,尤其对于一些细小、走行复杂的瘘管诊断效能高,并可作为内瘘管诊断的"金标准"之一。该研究建立在多学科团队协作平台的基础上。在遇到克罗恩病内瘘这一临床难题时,经过多学科讨论、交流、论证IC-CEUS在克罗恩病膀胱瘘应用的可行性,最后由超声介入科和消化内科医师共同完成诊断,并得到其他科室的通力合作。目前该研究已完成30余例IC-CEUS检查,无一例发生术后并发症,病例数仍在不断增加,且诊断和治疗更加完善。


























