
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
炎症性肠病(inflammatory bowel disease,IBD)是病因尚不清楚的慢性非特异性肠道炎症性疾病,主要包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn′s disease,CD)。IBD的诊断缺乏金标准,确诊需要综合临床、内镜、影像及病理表现,并且在排除感染性肠炎和其他非感染性肠炎后作出诊断。UC与CD的鉴别在手术标本中相对容易,但在内镜活检标本相对困难。本文主要从这两个方面进行概述,并简要介绍IBD的少见亚型。
内镜医生取活检时,需取多个部位多块组织活检,至少要包括回肠末端和直肠。除了病变部位,正常黏膜处和溃疡边的黏膜也要取活检。特别强调治疗前即初诊时的内镜活检病理评估。诊断有困难时,建议行上消化道检查,并取活检协助诊断。对已经确诊IBD的病例,治疗后复诊活检的主要目的是判断病变范围、活动度及瘤变观察。
首先采用系统化诊断方法判断是否为IBD,其次再进一步鉴别UC和CD。病理医师若严格按照系统化诊断方法进行病理诊断,一般不会错过有用信息。该方法中的每个参数都非常重要,这些参数包括组织结构的改变、上皮的改变和黏膜固有层的变化等[1,2]。(1)组织结构的改变:隐窝扭曲,隐窝长度,隐窝基底距黏膜肌距离,隐窝间距离,隐窝分支,黏膜表面绒毛状转化。(2)上皮的改变:杯状细胞数目,上皮内有无淋巴细胞,潘氏细胞化生及幽门腺化生,隐窝炎/隐窝脓肿,有无特定的微生物。(3)黏膜固有层的改变:有无炎症反应,炎症反应的性质为急性或慢性,炎症反应的分布为局灶性或弥漫性、表浅或基底部、隐窝内或黏膜固有层、黏膜层或黏膜下层,有无特定的微生物,有无纤维化,有无肉芽肿。(4)黏膜肌及黏膜下层的改变:黏膜肌有无增生、纤维化,黏膜下层有无神经纤维增生,黏膜下层淋巴管有无扩张。
UC结构改变包括隐窝分支、扭曲、萎缩(图1)。黏膜表面绒毛状改变,镜下表现为隐窝开口增宽,黏膜表面不平整,严重时呈手指状突起。上皮的改变有隐窝炎和隐窝脓肿;上皮的炎性损伤可导致黏蛋白丢失,镜下表现为杯状细胞减少;左半结肠出现潘氏细胞化生;黏膜固有层呈现弥漫性淋巴细胞和浆细胞浸润,炎症反应分布均匀,黏膜基底部浆细胞增多(图2)[3]。UC分为活动期、缓解期及静止期。活动期表现为血管充血,黏蛋白缺失,隐窝炎和隐窝脓肿,上皮剥脱,溃疡形成。缓解期表现为血管充血减轻,中性粒细胞逐渐消失,隐窝脓肿逐渐消失,基底部浆细胞仍保留,上皮再生,细胞增殖带扩大。静止期表现为黏膜萎缩、分支、隐窝变浅,潘氏细胞化生,淋巴组织增生。由于UC病变主要在黏膜层,内镜活检组织内可以出现上述诊断要点,所以内镜活检标本诊断UC准确率高。如果看到隐窝排列整整齐齐,结构没有紊乱,即使看到隐窝炎、隐窝脓肿,也不能轻易诊断为UC。
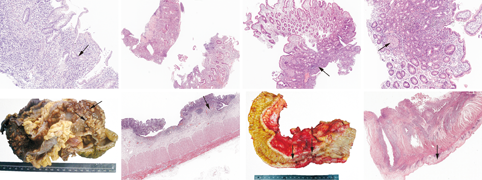

浅表部位的、贴近淋巴小结的炎症反应是CD早期特点,内镜可见到口疮样溃疡(阿弗他溃疡),显微镜下为黏膜局部糜烂,杯状细胞相对正常。CD炎症反应呈多灶性,且程度不均匀,可观察到明显的炎症反应灶向正常黏膜跳跃的特点,表现为同一块活检组织或多块活检组织炎症反应分布不均匀(图3)。CD炎性细胞多样,包括组织细胞、中性粒细胞、淋巴细胞、浆细胞及嗜酸性粒细胞。上皮样肉芽肿具有一定的诊断价值[4,5]。肉芽肿一般较小,由数个上皮样细胞聚集组成,有时出现单个多核巨细胞(图4)。CD活检上皮样肉芽肿的检出率比手术切除标本低[6,7]。由于CD是肠壁全层的炎症反应,而内镜活检只能取到肠壁黏膜层和浅表黏膜下层,这给诊断带来一定的难度。补充上消化道包括食管、胃及十二指肠的活检,若发现上皮样肉芽肿或局灶性增强性胃炎,可以协助诊断CD。
病理医师不仅要熟悉IBD形态学改变,还要了解临床特点、内镜表现、常见病变部位及分布等。只有这样,才能对内镜下钳夹的表浅标本进行全面评估,给出倾向性的诊断意见。UC与CD的活检标本鉴别诊断要点见表1。需要强调的是部分CD活检标本,组织学上显示弥漫的炎症反应,特别是发生在结肠的CD,这种情况很难与UC区别。IBD表现为黏膜慢性炎,但导致黏膜慢性炎的病因很多,有感染性、缺血性、药物性、憩室病相关性、改道性、自身免疫性、系统性疾病累及肠道及淋巴瘤等。
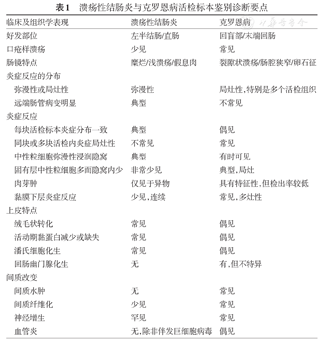
溃疡性结肠炎与克罗恩病活检标本鉴别诊断要点
溃疡性结肠炎与克罗恩病活检标本鉴别诊断要点
| 临床及组织学表现 | 溃疡性结肠炎 | 克罗恩病 | |
|---|---|---|---|
| 好发部位 | 左半结肠/直肠 | 回盲部/末端回肠 | |
| 口疮样溃疡 | 少见 | 常见 | |
| 肠镜特点 | 糜烂/浅溃疡/假息肉 | 裂隙状溃疡/肠腔狭窄/卵石征 | |
| 炎症反应的分布 | |||
| 弥漫性或局灶性 | 弥漫性 | 局灶性,特别是多个活检组织 | |
| 远端肠管病变明显 | 典型 | 不常见 | |
| 炎症反应 | |||
| 每块活检标本炎症分布一致 | 典型 | 偶见 | |
| 同块或多块活检内炎症局灶性 | 不常见 | 常见 | |
| 中性粒细胞弥漫性浸润隐窝 | 典型 | 有时可见 | |
| 固有层中性粒细胞多而隐窝内少 | 非常少见 | 典型,局灶 | |
| 肉芽肿 | 仅见于异物 | 具有特征性,但检出率较低 | |
| 黏膜下层炎症反应 | 少见,连续 | 常见,多灶性 | |
| 上皮特点 | |||
| 绒毛状转化 | 常见 | 偶见 | |
| 活动期黏蛋白减少或缺失 | 常见 | 偶见 | |
| 潘氏细胞化生 | 常见 | 偶见 | |
| 回肠幽门腺化生 | 无 | 有,但不特异 | |
| 间质改变 | |||
| 间质水肿 | 无 | 常见 | |
| 间质纤维化 | 少见 | 常见 | |
| 神经增生 | 罕见 | 常见 | |
| 血管炎 | 无,除非伴发巨细胞病毒 | 偶见 | |
UC典型的变化是病变连续性。起病于直肠,并向近端肠管扩散,近端肠管累及的程度及范围各异,表现为直肠炎、直肠乙状结肠炎、左半结肠炎、次全结直肠炎及全结肠炎。活动期UC黏膜表现为红斑、出血。当黏膜存在溃疡时,溃疡间增生的黏膜向肠腔面隆起,形成黏膜岛(图5)。黏膜部分或完全缺失,形成表面覆盖黏液脓性渗出物的大面积浅表溃疡。浅表溃疡与肉芽组织交替出现,伴有上皮再生,最终形成大量假息肉,息肉数目多少不一,有时黏膜面布满大小不一数百个息肉。这些息肉与病变的严重程度及癌前病变无相关性。结肠息肉比直肠息肉更明显,可布满整个结肠。相邻的息肉表面发生溃疡后,融合成迷路样外观和黏膜桥。当溃疡愈合后,黏膜外观可能恢复正常,但显微镜下,在先前存在的活动性病变区,黏膜萎缩。
UC显微镜下病变主要局限在黏膜层及黏膜下层(图6)。UC组织学的改变因病程及病变严重程度有所不同,可分为3个时期:活动期、缓解期及静止期。形态上同内镜活检部分。
典型CD的手术切除标本表现为病变不连续,呈节段性分布。受累肠段可见浆膜炎性渗出和(或)浆膜粘连。脂肪缠绕或蔓状脂肪指的是脂肪组织扩展到肠系膜对侧的浆膜表面,主要见于小肠CD,在结直肠CD并不常见。脂肪缠绕对CD有诊断价值[8,9]。早期黏膜面见阿弗他溃疡,溃疡扩大可融合为深的纵行线状溃疡,边缘黏膜水肿。深的不连续的溃疡将水肿的非溃疡黏膜分隔呈岛状,形成典型的鹅卵石样外观。也可见到假息肉。瘘管形成在小肠CD常见,主要见于累及回肠和(或)回结肠的病例,结肠CD相对少见。肠道狭窄见于有纤维化和纤维肌性增生的透壁性炎症反应部位,表现为肠壁增厚、僵硬(图7)。UC和CD大体标本特点比较见表2。
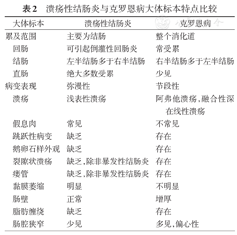
溃疡性结肠炎与克罗恩病大体标本特点比较
溃疡性结肠炎与克罗恩病大体标本特点比较
| 大体标本 | 溃疡性结肠炎 | 克罗恩病 | |
|---|---|---|---|
| 累及范围 | 主要为结肠 | 整个消化道 | |
| 回肠 | 可引起倒灌性回肠炎 | 常受累 | |
| 结肠 | 左半结肠多于右半结肠 | 右半结肠多于左半结肠 | |
| 直肠 | 绝大多数受累 | 少见 | |
| 病变表现 | 弥漫性 | 节段性 | |
| 溃疡 | 浅表性溃疡 | 阿弗他溃疡,融合性深在线性溃疡 | |
| 假息肉 | 常见 | 不常见 | |
| 跳跃性病变 | 缺乏 | 存在 | |
| 鹅卵石样外观 | 缺乏 | 存在 | |
| 裂隙状溃疡 | 缺乏,除非暴发性结肠炎 | 存在 | |
| 瘘管 | 缺乏,除非暴发性结肠炎 | 存在 | |
| 黏膜萎缩 | 明显 | 不明显 | |
| 肠壁 | 正常 | 增厚 | |
| 脂肪缠绕 | 缺乏 | 存在 | |
| 肠腔狭窄 | 少见 | 多见,偏心性 | |
CD的主要镜下特点为全层透壁性炎症反应(图8)、裂隙状溃疡、肠壁全层淋巴细胞聚集形成、上皮样肉芽肿。结肠CD出现上皮样肉芽肿的概率比回肠多。CD的次要镜下特点:黏膜下层和固有肌层神经节细胞及神经纤维增生紊乱、淋巴管扩张、幽门腺化生、肌层肥大。确诊CD前必须排除感染(如结核病)。UC与CD手术大体标本显微镜下的特点比较见表3。
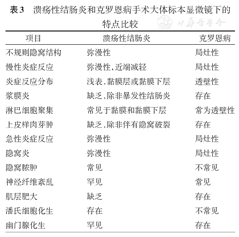
溃疡性结肠炎和克罗恩病手术大体标本显微镜下的特点比较
溃疡性结肠炎和克罗恩病手术大体标本显微镜下的特点比较
| 项目 | 溃疡性结肠炎 | 克罗恩病 |
|---|---|---|
| 不规则隐窝结构 | 弥漫性 | 局灶性 |
| 慢性炎症反应 | 弥漫性,近端减轻 | 局灶性 |
| 炎症反应分布 | 浅表,黏膜层或黏膜下层 | 透壁性 |
| 浆膜炎 | 缺乏,除非暴发性结肠炎 | 存在 |
| 淋巴细胞聚集 | 常见于黏膜和黏膜下层 | 常为透壁性 |
| 上皮样肉芽肿 | 缺乏,除非伴有隐窝破裂 | 存在 |
| 急性炎症反应 | 弥漫性 | 局灶性 |
| 隐窝炎 | 弥漫性 | 局灶性 |
| 隐窝脓肿 | 常见 | 不常见 |
| 神经纤维紊乱 | 罕见 | 常见 |
| 肌层肥大 | 缺乏 | 存在 |
| 潘氏细胞化生 | 存在 | 不常见 |
| 幽门腺化生 | 罕见 | 存在 |
临床表现为CD样特点,如左半结肠UC伴有盲肠或阑尾周围炎症反应或升结肠炎症反应,内镜及组织形态学上表现为病变不连续;重度全结肠UC伴有回肠累及,即倒灌性回肠炎;暴发性UC可见裂隙状溃疡、肠壁全层炎症及直肠豁免;UC因炎症反应破坏导致隐窝破裂,隐窝内的中性粒细胞和黏液漏入黏膜固有层内,并引起组织细胞聚集,形成黏液样肉芽肿,此种肉芽肿不要误认为CD肉芽肿[10,11,12,13,14]。儿童和治疗后的成人UC可以出现局灶性炎症反应和直肠豁免[15]。
临床表现为UC样特点。有报道指出约10% ~ 20% CD仅累及结肠,极少数结肠CD仅表现为黏膜炎症反应,伴黏膜下层轻微炎症反应或黏膜下层正常;少数结肠CD呈连续性全结肠炎,内镜和组织学上极似UC,称为UC样或浅表型CD[16]。有研究报道,73例单独结肠受累的CD和45例回结肠CD,分别有14%和13%呈UC样改变,多见于年轻患者[17]。除非其他部位有典型CD的表现,如远端小肠典型病变或肛周病变,或发现真正意义上的上皮样肉芽肿或节段性病变,或绝对的直肠豁免,否则不要轻易诊断为CD[18,19]。
未定型结肠炎(indeterminate colitis,IC)只是暂时性的诊断。需要特别强调的是,未定型结肠炎不能用于内镜活检黏膜,只能用于手术切术标本。不能由于临床、内镜及影像学信息不充分,或者对IBD少见亚型不了解而滥用这个诊断名称。


























