
探讨添加ω-3鱼油脂肪乳的早期全肠外营养(TPN)对克罗恩病(CD)患者术后并发症的影响。
回顾性分析浙江大学医学院附属邵逸夫医院普外科2017年1月至2018年5月186例行肠段切除的CD患者的临床资料,分析TPN联合ω-3鱼油脂肪乳的CD患者围手术期指标变化,再根据有无并发症分为无并发症组(n = 103)和有并发症组(n = 83),进行组间比较和多因素Logistic回归分析。
TPN联合ω-3鱼油脂肪乳组的CD患者术后C-反应蛋白水平显著低于无ω-3鱼油脂肪乳组[(43.5 ± 3.9)mg/L比(57.2 ± 5.3)mg/L,P = 0.047],且手术总体并发症(24.1%比40.8%,P=0.016)、术后重度并发症发生率(9.6%比23.3%,P = 0.014)、术后住院天数[(9.3 ± 0.6)d比(12.1 ± 1.1)d,P = 0.041]均显著低于TPN不含ω-3鱼油脂肪乳组。术前使用生物制剂、术后TPN联合ω-3鱼油脂肪乳、术前C-反应蛋白、手术时间、腹腔镜手术与术后并发症发生率有关(P均<0.05)。多因素回归分析显示术前使用生物制剂、术后TPN联合ω-3鱼油脂肪乳分别是CD患者术后并发症发生的独立危险因素和保护因素。
TPN联合ω-3鱼油脂肪乳有利于减轻术后炎症反应,从而降低CD患者术后并发症,加速患者康复。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
克罗恩病(Crohn′s disease,CD)是一种可累及全消化道的慢性炎症性疾病,病因不明,约80%的CD患者至少需要接受1次手术[1,2,3,4]。CD术后并发症发生率高。营养不良、术前治疗药物、术前合并肠瘘或者腹腔脓肿是术后并发症的主要影响因素[5,6]。ω-3不饱和脂肪酸主要从鱼油中提取,可促进细胞、血液以及组织中二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)和二十二碳五烯酸(DPA)的产生,不仅对人体有营养作用,还可抑制炎症反应、提高机体免疫力、调节肠道菌群稳态[7,8,9]。应用ω-3不饱和脂肪酸可降低胃肠道肿瘤、肝癌以及部分胃肠道良性疾病的术后并发症[9,10,11,12]。本研究通过比较术后有无添加ω-3不饱和脂肪酸的早期全肠外营养(total parenteral nutrition,TPN)的CD患者并发症的发生情况,探讨添加ω-3不饱和脂肪酸的早期TPN对CD术后并发症的影响。
回顾性分析2017年1月至2018年5月在浙江大学医学院附属邵逸夫医院普外科经手术治疗的186例CD患者的临床资料。所有CD患者信息均来源于我院炎症性肠病中心数据库。纳入标准:(1)根据病史、影像学、内镜检查及病理学结果明确诊断为CD;(2)行肠道切除术;(3)术后使用TPN支持治疗。排除标准:(1)术后使用TPN支持治疗时间小于4 d者;(2)急诊行肠道切除术者;(3)临床资料不完整者。本研究已获得浙江大学医学院附属邵逸夫医院伦理委员会批准(批准号20180925-8)。
纳入的186例CD患者中,男性115例,女性71例,平均年龄(38.8 ± 13.5)岁,体质指数(BMI)平均值为(19.2 ± 3.1)kg/m2,其中,121(65.1%)例患者行腹腔镜手术。
收集并记录研究对象的一般临床资料、疾病分型、术前用药、围手术期实验室指标、手术相关资料、术后TPN情况、术后30 d内并发症情况、术后住院时间等。
本中心行CD肠切除术患者从术后第1天开始TPN治疗,当口服或肠内营养能量能满足机体60%能量供应时,停用TPN。研究对象所需的总热量根据间接能量测定仪计算静息能量消耗而确定。研究对象均接受经中心静脉全肠外营养支持治疗,在维持内稳态的基础上,热氮比为(418.4 ~ 502.1)KJ∶1 g。
术后并发症包括腹腔感染、术后肠梗阻、切口感染、吻合口瘘、腹腔出血、发热、输血、二次手术等。并发症定义主要根据Clavien-Dindo分级,Ⅰ~Ⅱ级为轻度并发症,Ⅲ~Ⅳ级为重度并发症,Ⅴ级为死亡[13]。本次研究重点关注切口感染及腹腔感染并发症情况。
根据术后TPN治疗的肠外营养液配置中是否加入10% ω-3不饱和脂肪酸(尤文,华瑞制药公司),剂量为0.1 ~ 0.2 g·kg-1·d-1,把研究对象分为鱼油组和非鱼油组。非鱼油组的肠外营养液中只含有结构脂肪乳,不含尤文。根据每位患者情况配置相应总能量、糖、脂肪和氨基酸总量。比较两组患者的临床特点。
根据术后是否发生并发症,把研究对象分为有并发症和无并发症组两组,比较两组患者的临床特点,并分析发生并发症的危险因素。
采用SPSS 20.0软件进行统计分析。计数资料用例数(%)表示,正态分布的计量数据采用(Mean±SD),偏态分布的计量资料采用M(P25,P75)表示。采用Logistic回归模型对CD患者术后并发症的影响因素进行单因素及多因素分析。P<0.05为差异具有统计学意义。
在186例CD患者中,受累部位为末端回肠、结肠、回结肠和上消化道患者分别有96例(51.6%)、9例(4.8%)、70例(37.6%)和11例(5.9%);疾病行为为狭窄型和穿透型的患者分别占137例(73.7%)和67例(36.0%);52例(28.0%)患者伴有肛周病变。62例(33.3%)患者术后出现并发症,仅出现轻度并发症患者30例(16.1%),仅存在重度并发症患者15例(8.1%),同时合并轻度和重度并发症患者17例(9.1%)。6例(3.2%)患者出现腹腔脓肿,13例(7.0%)患者发生切口感染。出现并发症的患者经积极治疗后,均好转出院。
186例CD患者中,鱼油组83例(44.6%),非鱼油组103例(55.4%)。与鱼油组比较,非鱼油组患者术后C-反应蛋白水平更高、并发症发生率更高、Clavien-Dindo分级为Ⅲ-Ⅳ级(重度)并发症的发生率更高、住院时间更长。两组术前实验室检查指标、术后轻度并发症的比例等差异均无统计学意义。两组患者的临床资料比较见表1。
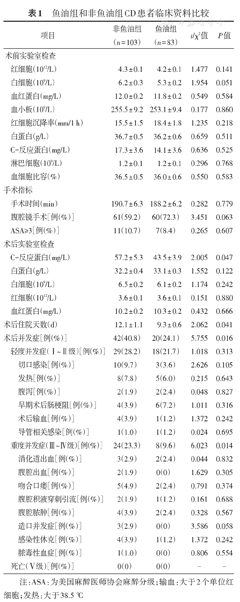
鱼油组和非鱼油组CD患者临床资料比较
鱼油组和非鱼油组CD患者临床资料比较
| 项目 | 非鱼油组(n = 103) | 鱼油组(n = 83) | t/χ2值 | P值 | ||
|---|---|---|---|---|---|---|
| 术前实验室检查 | ||||||
| 红细胞(1012/L) | 4.3 ± 0.1 | 4.2 ± 0.1 | 1.477 | 0.141 | ||
| 白细胞(109/L) | 6.2 ± 0.3 | 5.3 ± 0.2 | 1.954 | 0.051 | ||
| 血红蛋白(mg/L) | 12.0 ± 0.2 | 11.8 ± 0.2 | 0.549 | 0.584 | ||
| 血小板(109/L) | 255.5 ± 9.2 | 253.1 ± 9.4 | 0.177 | 0.860 | ||
| 红细胞沉降率(mm/1 h) | 15.5 ± 1.5 | 18.4 ± 1.8 | 1.235 | 0.218 | ||
| 白蛋白(g/L) | 36.7 ± 0.5 | 36.2 ± 0.6 | 0.659 | 0.511 | ||
| C-反应蛋白(mg/L) | 17.3 ± 3.6 | 14.1 ± 3.6 | 0.636 | 0.525 | ||
| 淋巴细胞(109/L) | 1.2 ± 0.1 | 1.2 ± 0.1 | 0.296 | 0.768 | ||
| 血细胞比容(%) | 36.5 ± 0.5 | 36.0 ± 0.6 | 0.550 | 0.583 | ||
| 手术指标 | ||||||
| 手术时间(min) | 190.7 ± 6.3 | 188.2 ± 6.2 | 0.282 | 0.779 | ||
| 腹腔镜手术[例(%)] | 61(59.2) | 60(72.3) | 3.451 | 0.063 | ||
| ASA≥3[例(%)] | 11(10.7) | 7(8.4) | 0.265 | 0.607 | ||
| 术后实验室检查 | ||||||
| C-反应蛋白(mg/L) | 57.2 ± 5.3 | 43.5 ± 3.9 | 2.005 | 0.047 | ||
| 白蛋白(g/L) | 32.2 ± 0.4 | 33.1 ± 0.3 | 1.552 | 0.122 | ||
| 白细胞(109/L) | 6.5 ± 0.2 | 6.1 ± 0.2 | 1.174 | 0.242 | ||
| 红细胞(1012/L) | 3.6 ± 0.1 | 3.6 ± 0.1 | 0.151 | 0.880 | ||
| 血红蛋白(mg/L) | 10.2 ± 0.2 | 10.3 ± 0.2 | 0.432 | 0.666 | ||
| 术后住院天数(d) | 12.1 ± 1.1 | 9.3 ± 0.6 | 2.062 | 0.041 | ||
| 术后并发症[例(%)] | 42(40.8) | 20(24.1) | 5.755 | 0.016 | ||
| 轻度并发症(Ⅰ~Ⅱ级)[例(%)] | 29(28.2) | 18(21.7) | 1.018 | 0.313 | ||
| 切口感染[例(%)] | 10(9.7) | 3(3.6) | 2.626 | 0.105 | ||
| 发热[例(%)] | 8(7.8) | 5(6.0) | 0.215 | 0.643 | ||
| 腹泻[例(%)] | 2(1.9) | 2(2.4) | 0.048 | 0.827 | ||
| 早期术后肠梗阻[例(%)] | 4(3.9) | 6(7.2) | 1.011 | 0.316 | ||
| 术后输血[例(%)] | 4(3.9) | 1(1.2) | 1.372 | 0.242 | ||
| 导管相关感染[例(%)] | 1(1.0) | 1(1.2) | 0.024 | 0.695 | ||
| 重度并发症(Ⅲ~Ⅳ级)[例(%)] | 24(23.3) | 8(9.6) | 6.023 | 0.014 | ||
| 消化道出血[例(%)] | 3(2.9) | 2(2.4) | 0.044 | 0.832 | ||
| 腹腔出血[例(%)] | 2(1.9) | 0(0) | 1.629 | 0.305 | ||
| 吻合口瘘[例(%)] | 5(4.9) | 2(2.4) | 0.791 | 0.374 | ||
| 腹腔积液穿刺引流[例(%)] | 2(1.9) | 1(1.2) | 0.161 | 0.688 | ||
| 腹腔脓肿[例(%)] | 4(3.9) | 2(2.4) | 0.328 | 0.567 | ||
| 造口并发症[例(%)] | 3(2.9) | 0(0) | 3.586 | 0.058 | ||
| 感染性休克[例(%)] | 4(3.9) | 1(1.2) | 1.372 | 0.242 | ||
| 脓毒性血症[例(%)] | 1(1.0) | 0(0) | 0.806 | 0.554 | ||
| 死亡(Ⅴ级)[例(%)] | 0(0) | 0(0) | - | - | ||
注:ASA:为美国麻醉医师协会麻醉分级;输血:大于2个单位红细胞;发热:大于38.5 ℃
有无并发症的两组CD患者比较,结果显示术前使用生物制剂(P = 0.015)、术后肠外营养(含鱼油)(P = 0.016)、术前C-反应蛋白水平(P = 0.001)、手术时间(P = 0.008)、腹腔镜手术(P = 0.017)的差异具有统计学意义,见表2。
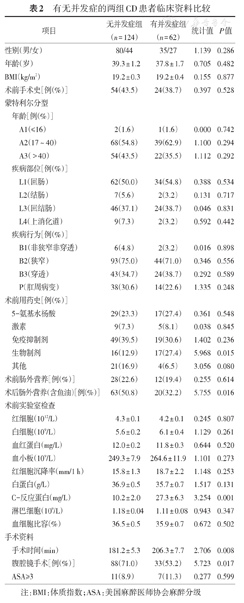
有无并发症的两组CD患者临床资料比较
有无并发症的两组CD患者临床资料比较
| 项目 | 无并发症组(n=124) | 有并发症组(n=62) | 统计值 | P值 | ||
|---|---|---|---|---|---|---|
| 性别(男/女) | 80/44 | 35/27 | 1.139 | 0.286 | ||
| 年龄(岁) | 39.3±1.2 | 37.8±1.7 | 0.705 | 0.482 | ||
| BMI(kg/m2) | 19.2±0.3 | 19.2±0.4 | 0.155 | 0.877 | ||
| 术前手术史[例(%)] | 54(43.5) | 24(38.7) | 0.397 | 0.528 | ||
| 蒙特利尔分型 | ||||||
| 年龄[例(%)] | ||||||
| A1(≤16) | 2(1.6) | 1(1.6) | 0.000 | 0.742 | ||
| A2(17 ~ 40) | 68(54.8) | 39(62.9) | 1.100 | 0.294 | ||
| A3(>40) | 54(43.5) | 22(35.5) | 1.112 | 0.292 | ||
| 疾病部位[例(%)] | ||||||
| L1(回肠) | 62(50.0) | 34(54.8) | 0.388 | 0.534 | ||
| L2(结肠) | 7(5.6) | 2(3.2) | 0.131 | 0.717 | ||
| L3(回结肠) | 46(37.1) | 24(38.7) | 0.046 | 0.831 | ||
| L4(上消化道) | 9(7.3) | 2(3.2) | 0.592 | 0.442 | ||
| 疾病行为[例(%)] | ||||||
| B1(非狭窄非穿透) | 6(4.8) | 2(3.2) | 0.016 | 0.898 | ||
| B2(狭窄) | 93(75.0) | 44(71.0) | 0.346 | 0.556 | ||
| B3(穿透) | 43(34.7) | 24(38.7) | 0.292 | 0.589 | ||
| P(肛周病变) | 38(30.6) | 14(22.6) | 1.335 | 0.248 | ||
| 术前用药史[例(%)] | ||||||
| 5-氨基水杨酸 | 29(23.3) | 17(27.4) | 0.361 | 0.548 | ||
| 激素 | 9(7.3) | 5(8.1) | 0.038 | 0.845 | ||
| 免疫抑制剂 | 49(39.5) | 19(30.6) | 1.402 | 0.236 | ||
| 生物制剂 | 16(12.9) | 17(27.4) | 5.968 | 0.015 | ||
| 其他 | 21(16.9) | 4(6.5) | 3.056 | 0.080 | ||
| 术前肠外营养[例(%)] | 28(22.6) | 12(19.4) | 0.255 | 0.614 | ||
| 术后肠外营养(含鱼油)[例(%)] | 63(50.8) | 20(32.2) | 5.755 | 0.016 | ||
| 术前实验室检查 | ||||||
| 红细胞(1012/L) | 4.3±0.1 | 4.2±0.1 | 0.245 | 0.807 | ||
| 白细胞(109/L) | 5.6±0.2 | 6.1±0.4 | 1.129 | 0.261 | ||
| 血红蛋白(mg/L) | 12.0±0.2 | 11.8±0.3 | 0.644 | 0.520 | ||
| 血小板(109/L) | 249.3±7.9 | 264.6±11.9 | 1.101 | 0.273 | ||
| 红细胞沉降率(mm/1 h) | 15.8±1.3 | 18.7±2.2 | 1.148 | 0.253 | ||
| 白蛋白(g/L) | 36.9±0.5 | 35.7±0.7 | 1.517 | 0.131 | ||
| C-反应蛋白(mg/L) | 10.2±2.0 | 27.3±6.3 | 3.254 | 0.001 | ||
| 淋巴细胞(109/L) | 1.18±0.04 | 1.11±0.08 | 0.943 | 0.347 | ||
| 血细胞比容(%) | 36.5±0.5 | 35.9±0.7 | 0.672 | 0.502 | ||
| 手术资料 | ||||||
| 手术时间(min) | 181.2±5.3 | 206.3±7.7 | 2.706 | 0.008 | ||
| 腹腔镜手术[例(%)] | 88(71.0) | 33(53.2) | 5.723 | 0.017 | ||
| ASA≥3 | 11(8.9) | 7(11.3) | 0.277 | 0.599 | ||
注:BMI:体质指数;ASA:美国麻醉医师协会麻醉分级
多因素Logistic回归分析结果显示,术前使用生物制剂是CD患者术后发生并发症的独立危险因素(OR:2.644,95%CI:1.137 ~ 6.152,P = 0.024),而术后肠外营养(含鱼油)是术后发生并发症的独立保护因素(OR:0.492,95%CI:0.249 ~ 0.974,P = 0.042),见表3。
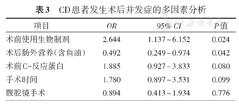
CD患者发生术后并发症的多因素分析
CD患者发生术后并发症的多因素分析
| 项目 | OR | 95% CI | P值 |
|---|---|---|---|
| 术前使用生物制剂 | 2.644 | 1.137 ~ 6.152 | 0.024 |
| 术后肠外营养(含鱼油) | 0.492 | 0.249 ~ 0.974 | 0.042 |
| 术前C-反应蛋白 | 1.885 | 0.927 ~ 3.833 | 0.080 |
| 手术时间 | 1.780 | 0.897 ~ 3.531 | 0.099 |
| 腹腔镜手术 | 0.894 | 0.413 ~ 1.934 | 0.776 |
本研究回顾性分析了行肠切除术的CD患者的临床资料,结果显示肠外营养液中添加ω-3鱼油脂肪乳有利于减轻术后炎症反应,降低术后并发症,尤其是重度并发症的发生率,从而有利于患者加速康复。此项研究为首次重点关注CD患者术后TPN中使用ω-3鱼油脂肪乳与术后康复的关系。
人体必需脂肪酸主要包括ω-6不饱和脂肪酸和ω-3不饱和脂肪酸,其中ω-3不饱和脂肪酸主要从鱼油中提取,可促进细胞、血液以及组织中二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)和二十二碳五烯酸(DPA)的产生[7]。
关于ω-3鱼油脂肪乳在外科手术患者中的作用仍然具有争议,一项前瞻性随机对照研究显示48例胃癌患者应用鱼油,术后炎症反应得到显著改善[14]。Zhang等[15]发现对于肝硬化肝癌患者行手术肝切除后,TPN中添加鱼油后有利于改善术后恢复、降低术后并发症、以及缩短住院时间。Zhao等[16]通过荟萃分析发现对于胃肠道肿瘤患者,早期应用ω-3鱼油脂肪乳有利于改善机体免疫力、减轻术后应激反应、增强机体抗肿瘤转移或复发。然而,同样有研究显示在结直肠肿瘤或者食管癌手术患者中,鱼油与术后并发症减少无明显相关性[7,17]。我们研究结果显示对于CD患者行肠道切除术后,TPN中添加鱼油有利于降低术后炎症反应、促进肠道功能恢复、降低吻合口瘘发生、减少腹腔脓肿形成等重度并发症,然而,术后切口感染的发生率并未显著降低。CD疾病特点表现为肠道免疫系统异常激活,炎症反应较重,术后鱼油的应用一方面降低手术创伤应激导致的炎症反应,另一方面也有利于该疾病本身炎症反应的控制[18]。
ω-3鱼油脂肪乳有利于术后患者康复可能途径包括以下几点:(1)调节花生四烯酸途径和控制前列腺素、血栓烷类、白三烯等分子,从而降低炎症分子水平,如IL-6、IL-8、TNF-α等[19];(2)通过调节甾醇调控元件结合蛋白(SREBP-1)、蛋白酰化反应和钙离子释放等影响细胞膜的完整性、稳定性和流动性,从而减少细胞因子的产生和释放,降低术后机体炎症反应[20];(3)通过改变T淋巴细胞膜磷脂成分和细胞功能、增强抗原呈递细胞功能和自然杀伤细胞的细胞毒性、调节树突状细胞功能等影响机体免疫功能[21]。
目前国内外关于炎症性肠病患者TPN中添加ω-3鱼油脂肪乳对于术后恢复的影响我们尚未检索到有关文献报道。本次研究属于回顾性分析,因此不可避免会出现病例选择的偏倚等局限性。本研究结果有待多中心随机对照研究进一步证实。
所有作者均声明不存在利益冲突



























