
炎症性肠病(IBD)可累及肠外器官,而与IBD相关的肺损伤因其发病率低,容易被忽视。本文对IBD相关肺损伤进行综述,提高临床医生的认识,为临床医生提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
炎症性肠病(inflammatory bowel disease,IBD)是一种肠道慢性非特异性炎性疾病,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn′s disease,CD),超过1/3的患者有肠外表现[1],可累及关节、眼、皮肤、肝脏等,而与IBD相关的肺部疾病因发病率低,容易被忽视。本文对IBD相关的肺损伤进行综述,为临床医生提供参考。
目前关于IBD相关肺损伤的发病机制尚不明确,主要认为有以下几点:(1)肠道和肺在胚胎时期共同起源于内胚层的前肠区域,拥有相似的免疫学特性;(2)呼吸道和肠道共同暴露于受污染的空气中,大大增加了呼吸系统疾病的发病率,而污染物通过吞咽等被肠道吸收,引起全身或局部免疫反应,肠道产生的免疫复合物会在呼吸系统沉积;(3)呼吸系统和肠道有共同的黏膜免疫系统,肠道的淋巴细胞会循环并定位在呼吸道黏膜表面,从而导致呼吸系统疾病[2,3,4]。
早在1999年,有学者表明IBD相关肺部疾病发病率虽然低,但至少有一半无肺部症状的IBD患者存在肺功能或支气管肺泡灌洗液检测异常[5]。最常见的表现是支气管内径增大、支气管壁增厚等。Ji等[6]对尚未开始治疗的64例IBD患者进行肺功能检测,结果表示第1秒用力呼气容积、用力肺活量、用力呼气中段流量和一氧化碳肺弥散量的测量值均显著低于健康对照组,差异有统计学意义。Herrlinger等[7]对66例无呼吸道症状的IBD患者和30例正常对照者进行肺功能测定,42%的IBD患者出现了肺功能异常,只有3%的对照组受检者出现了异常。此外,Ateş等[8]发现,在无吸烟史、无既往呼吸道疾病史的IBD患者中,也多有肺功能检测异常,这表明肺功能检测可作为一种有效的无创检测来评估IBD患者的肺部情况。此外,高分辨率CT(high resolution CT,HRCT)也可以检测无明显呼吸道症状的IBD患者的肺部受累情况。
IBD相关气道病变最早由Kraft等[9]于1976年发现,气道病变是最常见的肺损伤,可涉及咽、喉、声门、气管及支气管。支气管病变最常见的是支气管扩张,其次是慢性支气管炎[1]。呼吸道症状与IBD的疾病活动度并不平行,在IBD疾病缓解期也可出现。
支气管扩张以咳嗽、咳脓痰为主要表现,其特征为支气管树不可逆的扩张,在UC中较为常见,且多发于结肠切除术后的患者[10,11]。在以支气管扩张为代表的大气道病变中,支气管镜的典型表现为红斑和气管黏膜弥漫性散在白色病变,活检显示上皮化生、炎性细胞的肉芽肿浸润和黏膜溃疡[12]。吸入性或全身系统性使用激素可作为一线治疗选择。对于难治性病例,建议通过纤维支气管镜进行支气管灌洗,以提高局部糖皮质激素的有效浓度[13]。但有学者认为,吸入性糖皮质激素对IBD相关的支气管扩张无效,原因可能是支气管表面布满分泌物,影响吸入性糖皮质激素的吸收[2]。
Protopapas等[14]测定了27例IBD患者和39例健康对照者肺泡内一氧化氮浓度(CANO)、呼出气一氧化氮水平(FeNO),结果发现IBD组的FeNO水平明显高于对照组,且IBD患者的CANO水平显著升高,差异有统计学意义。作为小气道炎症反应的标志,CANO水平在IBD患者中显著高于健康对照组,说明相较于健康对照组,IBD患者更容易存在小气道炎症反应[15]。
不少学者提出,气道病变的患者新发IBD的风险也高于健康对照组,这可能与遗传、吸烟史、环境污染、免疫调节等相关[4,16]。
IBD相关肺损伤患者中,大约1/4的患者是肺实质受累,其中UC引起的肺实质受累比CD更常见[17,18],最常见的肺实质受累是间质性肺病(interstitial lung disease,ILD)[19]。
间质性肺病包括机化性肺炎(organizing pneumonia,OP)、非特异性间质性肺炎、特发性肺纤维化等,常表现为干咳、胸闷、发热、体质量减轻等,症状不典型,且与疾病活动度无关[20]。ILD常见是由美沙拉嗪和柳氮磺胺吡啶引起的药物反应,但也有少数与药物无关的纤维性肺泡炎和嗜酸性粒细胞肺炎的报道[21]。IBD相关的ILD肺功能检测可能是正常的,也可能显示不同程度的限制性通气障碍,典型的支气管肺泡灌洗液检查表现为细胞总数增多和淋巴细胞轻度升高,HRCT扫描常可表现为磨玻璃样阴影、肺泡充盈等[22]。IBD相关的ILD通常对全身性激素使用反应良好,可使用中等剂量的泼尼松0.5 mg/kg qd治疗,但在逐步减少剂量的过程中要注意ILD的复发[2]。
肺结节病也属于IBD相关的肺实质性疾病。坏死性肺结节常见于CD,组织学上这些结节由无菌的中性粒细胞构成,并伴有坏死,放射学上与韦格纳肉芽肿、感染性肺栓塞相似[19,23]。IBD相关的肺结节病通常可使用糖皮质激素治疗,若无效可使用英夫利西单克隆抗体。IBD相关的肺实质性疾病预后通常较好,但偶有致死病例的报道[24,25,26,27]。
肺静脉血栓栓塞是导致IBD死亡的重要原因,McCurdy等[28]对81 900例出院的IBD患者(62 848例接受内科治疗、19 052例接受手术治疗)与非IBD对照组进行追踪观察,发现内科治疗IBD患者出院后12个月的静脉血栓栓塞发生率为2.3%,手术患者为1.6%,IBD患者出院后静脉血栓栓塞的发生率是对照组的1.7倍。Chung等[29]对11 445例IBD患者和45 780例健康对照组进行分析,发现IBD患者发生深静脉血栓(deep vein thrombosis,DVT)和肺栓塞(pulmonary embolism,VE)的风险分别是健康对照组的1.98倍和1.80倍,这都表明IBD是肺静脉血栓栓塞的危险因素。Ra等[30]对974例IBD患者进行了回顾性研究,发现未接受药物预防血栓的IBD患者和接受药物预防血栓(如低分子肝素)的患者术后大出血的发生率无显著差异,静脉血栓的预防与IBD患者外科手术后的大出血无关,这表明,对于IBD患者而言,药物预防血栓形成是安全有效的,但是关于全身抗凝持续时间的决定必须考虑个体性肠出血的风险。
关于IBD相关的胸膜疾病较少报道,胸膜受累主要表现为气胸、胸膜增厚、胸膜炎和胸腔积液[12],多发于UC静止期的年轻男性患者[26]。美沙拉嗪和柳氮磺胺吡啶的使用也会诱发胸腔积液,与IBD直接相关的胸腔积液通常是单侧的。全身性糖皮质激素的使用是治疗的一线方法。
瘘的形成在CD患者中并不少见,然而IBD合并肠-肺瘘却并不多见,其机制尚不清楚。Alameel等[31]报道了一例52岁的男性CD患者,表现为呼吸困难、咳嗽、咳粪臭味痰,胸部增强CT示左下叶空洞性肺炎,腹部CT示脾曲处的结肠与左支气管间隙之间有瘘状交通,术中见一条纤维束从脾曲延伸至左肺。当IBD患者尤其是CD患者出现不明原因的肺炎并伴咳脓臭痰时应高度怀疑是否有肠-肺瘘,并尽快手术治疗。
美沙拉嗪、柳氮磺胺吡啶、甲氨蝶呤、英夫利西单克隆抗体(infliximab,IFX)等是治疗IBD的常用药物,药物引起的肺损伤可在药物使用后几天至几年内发生,严格意义上说,药物引起的肺损伤并不属于IBD相关肺损伤,但因其是IBD患者中最常见的肺损伤,所以在此进行阐述。
(1)美沙拉嗪和柳氮磺胺吡啶:美沙拉嗪和柳氮磺胺吡啶属于氨基水杨酸制剂,是治疗UC的主要药物,对CD的治疗效果较小。这类药物可以导致的肺损伤包括嗜酸性粒细胞肺炎、间质性肺炎和纤维性肺泡炎等[32],常见临床症状是呼吸困难(76%)、发烧(68%)、胸痛(65%)和咳嗽(22%)[33]。
美沙拉嗪引起肺损伤的机制尚不明确,可能与以下几方面相关:(1)药物的氧化损伤;(2)药物对肺泡毛细血管内皮细胞的直接细胞毒作用;(3)细胞内磷脂沉积介导的损伤[34]。柳氮磺胺吡啶的活性部分为5-氨基水杨酸(5-aminosalicylicacid,5-ASA),磺基吡啶部分为载体分子。这种磺基吡啶成分(含有偶氮键)被广泛认为是大多数超敏反应的原因[35],但致病机制目前尚不明确。
Foster等[36]发现,3例IBD患者使用美沙拉嗪治疗后出现程度不等的呼吸道症状,美沙拉嗪使用时间与出现呼吸道症状时间各不等,且没有剂量依赖性。临床上许多医生使用糖皮质激素来治疗美沙拉嗪引起的肺损伤,也有学者提出,即使停用美沙拉嗪后不进行糖皮质激素治疗,患者也能获得良好预后。
Parry等[37]在比较有无使用糖皮质激素继续治疗柳氮磺胺吡啶引起的肺损伤时发现,没有证据表明使用糖皮质激素继续进行治疗能够改善患者的肺损伤。柳氮磺胺吡啶引起的肺损伤一般预后良好,一旦诊断明确,立即停药,呼吸道症状会很快消失。
(2)硫唑嘌呤(azathioprine,AZA)和6-巯基嘌呤(mercaptopurine,6-MP):AZA是维持缓解期最常用的药物,不能耐受者可改用6-MP,骨髓抑制是其最常见的不良反应,关于肺损伤的报道则较少。Ananthakrishnan等[38]描述了3例使用AZA或6-MP的IBD患者,均出现了呼吸困难、胸痛、发热等症状,支气管镜检查均为阴性,排除感染后2例患者进行开胸肺活检,1例患者病理未见明显异常,1例为闭塞性毛细支气管炎机化性肺炎,停用AZA或6-MP后,3例患者临床症状均有所好转。AZA和6-MP引起的肺损伤罕见但严重,且与剂量相关,临床工作中对于使用AZA或6-MP的IBD患者应高度注意其肺损伤的发生。
(3)甲氨蝶呤(methotrexate,MTX):目前MTX导致肺损伤的机制尚不清楚,可能与超敏反应、直接毒性效应以及宿主对获得性或潜伏性病毒感染的抵抗力下降有关[39]。Margagnoni等[40]报道1例有10年CD病史的中年女性口服MTX治疗18个月后患者出现呼吸困难、咳嗽、发烧,HRCT显示双侧弥漫性磨玻璃影,肺功能检查显示轻度受限,一氧化碳弥散能力降低,考虑MTX诱导的肺损伤,予停药、激素治疗后,症状迅速改善,4周后肺功能检查和胸部HRCT扫描均正常。
MTX引起肺损伤的诊断是困难的,目前尚未提出诊断金标准,只能通过影像学、支气管肺泡灌洗液、病原学检查、肺活检、停药试验等进行排除性诊断,典型的支气管肺泡灌洗液表现为淋巴细胞增高,CD4+/CD8+比值倒置,肺活检常表现为间质性肺炎、肉芽肿形成和毛细支气管炎[39]。停药和使用全身性糖皮质激素是治疗的有效方法。
(4)抗肿瘤坏死因子(tumor necrosis factor,TNF)-α生物制剂:抗TNF-α生物制剂主要用于经激素及免疫调节剂治疗无效或不能耐受者。
长期使用IFX会增加机会性感染的概率,最常见的是结核分支杆菌感染,发病率可能增加2到7倍,且10%的病例可能发展为播散性疾病[41]。Byun等[42]研究了2001年1月至2013年12月接受抗TNF-α生物制剂治疗的873例IBD患者发现,抗TNF-α生物制剂增加了IBD人群中结核感染的风险。此外,真菌感染如隐球菌、肺曲霉菌,以及非感染性肺部疾病,如出血性肺泡炎、间质性肺炎也有报道[43,44]。
许多IBD患者接受了抗TNF-α生物制剂与氨基水杨酸制剂和/或免疫调节剂的联合治疗,因此难以确定某一种具体的药物在肺损伤中所起的作用,需要进一步的研究以确定多种药物联合使用是否会进一步增加肺损伤的风险。
当IBD患者出现肺部症状时,应首先排除感染性疾病,再判断是否由药物引起。笔者对IBD相关肺损伤的诊断流程进行整理(图1),为临床医生提供一定的参考。
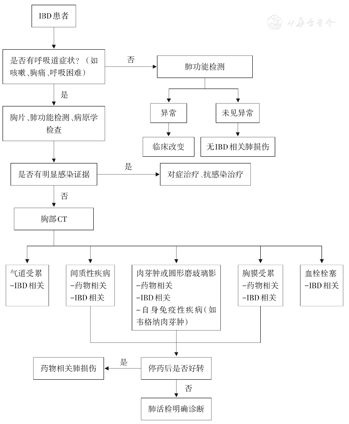

鉴别肺损伤是由药物引起还是IBD本身引起是非常困难的,没有单一明确的试验可以对两者进行鉴别,Eliadou等[45]认为,诊断药物引起的肺损伤应满足以下几个条件:(1)明确药物服用史,患者能够正确识别药物、明确用药时间和用药情况;(2)临床影像和组织病理学与早期观察到的相同药物相一致;(3)排除其他肺部疾病;(4)停药后情况改善;(5)再用药时症状复发。Kacprzak等[46]也提出,支持药物引起肺损伤的条件有以下几点:(1)开始服药和发病之间有明确的时间关系;(2)出现血嗜酸性粒细胞增多;(3)停药后症状好转。对于无呼吸道症状的IBD患者,应常规进行肺功能检测以明确是否存在潜在临床改变。
IBD相关肺损伤虽然发病率较低,但仍需要重视。对其进行全面系统的阐述有助于提高临床医生的认识,提高诊断的准确性及治疗的有效性,改善患者的预后,提高患者的生活质量。
所有作者均声明无任何利益冲突



























