
白介素(IL)-9由极性状态的Th2细胞分泌,其表达受到多种信号因子的调节,与细胞因子微环境密切相关。IL-9与自身免疫性疾病、变态反应性疾病等密切相关。炎症性肠病(IBD)是一种病因尚不明确的肠道非特异性慢性炎症性疾病。研究发现肠黏膜免疫平衡失调与其发病密切相关,IL-9通过调节紧密连接相关蛋白的表达影响肠黏膜的屏障功能,从而参与IBD的病理生理过程。本文对IL-9在IBD中的作用进行综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
炎症性肠病(inflammatory bowel disease,IBD)是一种慢性复发性肠道炎症,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn′s disease,CD),临床表现主要为腹痛、腹泻、发热、黏液脓血便及体质量减轻,病理表现主要为肠道黏膜慢性炎症及溃疡形成。其确切发病机制尚不明确,目前研究认为,遗传易感性和免疫功能紊乱是主要危险因素。CD4+ T细胞是适应性免疫的主要效应细胞,可以分化形成多个T细胞亚群,分泌大量的细胞因子参与IBD的病理生理过程。白介素9(interleukin 9,IL-9)是新近发现的与Th2细胞亚群相关的细胞因子,在肺炎、蠕虫感染、变态反应性炎症、抗肿瘤免疫中均有作用。近些年的研究显示,IL-9在IBD的发生发展中也发挥重要的作用。本文就IL-9的来源、表达调控及其在IBD中的作用作一综述。
IL-9最初在小鼠体内发现,被认为是一种T细胞生长因子,与IL-2、IL-4、IL-7、IL-15和IL-21均是共享γ链受体细胞因子家族成员。IL-9是一种相对分子质量为14 KDa的糖蛋白,包含144个氨基酸以及一段18个氨基酸的信号序列,阳性氨基酸残基比例较高,有4个N-连接糖基化位点。编码人类IL-9的基因位于5号染色体q31-35区,该区主要编码与Th2型细胞因子相关的基因,编码小鼠IL-9的基因位于13号染色体。人鼠IL-9的基因结构相似,包括5个外显子及4个内含子,其在核苷酸水平的同源性为69%,在蛋白水平的同源性为55%[1]。
IL-9在肥大细胞(mast cell,MC)、辅助性T细胞(helper cell,Th)、自然杀伤细胞(natural killer cell,NK)中均有表达,其中Th细胞是其主要来源[2]。Th细胞又称原始CD4+ T细胞,在胞外信号分子及信号传导与转录激活因子(signal transducers and activators of transcription,STAT)的共同作用下,原始CD4+ T细胞分化形成各个功能不同的亚群,包括Th1、Th2、Th17、调节性T细胞(regulatory cells,Tregs)等[3,4](图1)。IL-4是Th2型细胞相关的细胞因子,转化生长因子-β(transforming growth factor-β,TGF-β)属于TGF超家族。IL-4单独存在可以诱导原始CD4+ T细胞向Th2型细胞分化,而TGF-β单独作用则可以分化形成Tregs。
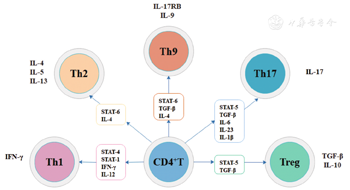

以往的观点认为,在IL-4及TGF-β的共同作用下,原始CD4+ T细胞分化形成能够分泌IL-9的T细胞亚群。与Th2型细胞不同的是,这一亚群可以诱发结肠炎及周围神经炎,被命名为Th9细胞[5]。目前有新的观点认为,分泌IL-9的细胞是Th2型细胞可逆转化形成的极性"Th9"细胞,转化过程与胞外细胞因子微环境密切相关[6,7]。在TGF-β及IL-4共同作用下,原始CD4+ T细胞向Foxp3+ Tregs细胞的分化过程被抑制,形成一群表达IL-9及IL-10的"Th9"细胞群。该群细胞是Th2细胞瞬时激活诱导产生的一个亚群——IL-9+ Th2细胞。大部分IL-9+ Th2细胞在静息状态下表达经典的Th2型细胞因子、转录因子以及趋化因子受体,比如IL-4、IL-5、IL-13、CCR4、CCR8;IL-4和IL-13表达量下降可瞬时激发IL-9表达,随着IL-4和IL-13的表达水平回升,IL-9的表达减弱。
IL-4与TGF-β的平衡是促进原始CD4+ T细胞分化形成IL-9分泌相关的T细胞亚群的关键因素[5,6,7]。E26转录因子(E26 transformation specific,ETS)家族的转录因子PU.1是TGF-β的下游信号分子,转录因子GATA3与STAT6均是IL-4下游的信号分子,DNA结合抑制物Id3和干扰素调节因子4(interferon-regulatory factor 4,IRF4)与IL-4及TGF-β均有关,这些信号分子通过与IL-4和TGF-β的直接或间接作用调节IL-9的表达[8,9,10,11,12]。PU.1和IRF4直接与IL-9启动子结合,促进IL-9相关的Th细胞形成,Id3也可以直接与IL-9启动子结合,通过TAK1-Id3-E2A-GATA3途径调节IL-9的表达。IL-4通过IL-4-STAT6途径抑制TGF-β诱导的Foxp3+ Tregs细胞生成,而GATA3则直接与Foxp3结合,产生表达IL-9及IL-10的Foxp3- Th细胞。DNA酶hgd40则通过与GATA3基因结合抑制GATA3的表达,从而降低IL-9的表达。
OX40配体是肿瘤坏死因子超家族成员4(tumor necrosis factor receptor super family 4,TNFSF4),受体为表达于活化T细胞表面的OX40,通过NF-κB途径进行信号转导。在TGF-β存在的微环境中,OX40激活泛素连接酶TRAF6,活化下游的经典及非经典NF-κB途径,抑制CD4+ T细胞和Foxp3- T细胞向Tregs及Th17分化,使其形成表达IL-9的T细胞亚群[13]。
IL-1家族的IL-1α、IL-1β、IL-18及IL-33在IL-4缺失的情况下可与TGF-β相互作用促进IL-9的表达[14]。另一成员IL-36γ通过IL-36R-MyD88-NFκBp50信号通路抑制Foxp3相关的Tregs的发育,同时通过IL-2-STAT5和IL-4-STAT6途径促进IL-9相关的Th细胞的分化,从而上调IL-9的表达[15]。
在IL-4及TGF-β共存的情况下,表达IL-9的细胞可同时表达IL-17受体B(interleukin 17 receptor B,IL-17RB),IL-17RB是IL-25的受体,IL-25可以调节IL-9的表达[16](图2)。
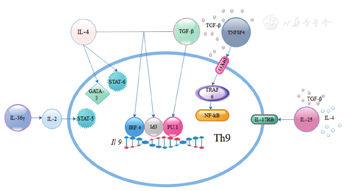

IL-9相关的T细胞亚群表达特征性的转录调节因子——过氧化物酶体增殖剂激活受体γ(peroxisome proliferators-activated receptor γ,PPAR-γ)与IL-9的表达密切相关。给予PPAR-γ阻断剂可以抑制IL-9的表达,并呈剂量依赖性,但是给予PPAR-γ激活剂并不能促进IL-9及其他Th2型细胞因子的表达[6]。
IBD确切病因目前尚不清楚,较多证据表明,免疫功能紊乱是其主要致病因素。CD4+ T淋巴细胞作为重要的免疫应答细胞,参与IBD的病理生理过程。IL-9是一种Th2细胞相关的细胞因子,可以调节淋巴细胞、肥大细胞以及上皮细胞功能,与结肠炎症的发生发展密切相关[17]。
研究发现,恶唑酮(oxazolone)诱导的结肠炎小鼠黏膜中表达IL-9的T细胞数量增加,IL-9缺失可以缓解炎症,并且IL-9抗体对结肠炎有治疗作用[18]。在三硝基苯磺酸(trinitron-benzene-sulfonic,TNBS)诱导的结肠炎小鼠模型中,敲除IL-9基因可以抑制炎症反应,同时检测其结肠黏膜紧密连接相关分子,发现闭合蛋白occludin的表达上调,密封蛋白claudin1的表达下调,但是成孔蛋白claudin2的表达量并无明显变化[19]。在葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的结肠炎小鼠中,阻断IL-9可以逆转结肠炎症[20],提示IL-9与实验性结肠炎相关并且可以调节紧密连接蛋白的表达。IL-1家族的IL-33及其受体ST2在UC患者及实验性结肠炎小鼠中表达异常[21],而IL-33可以正向调控IL-9的表达[14]。
另一研究发现,UC患者结肠黏膜表达PU.1和IL-9的T细胞数量增加[18],黏膜及血清中IL-9的表达量也明显增加,且与疾病活动度呈正相关[22],与IL-9表达相关的因子(Irf4、Smad2、Smad3)mRNA含量也明显升高,并且IL-9+-CD4+淋巴细胞数量较健康对照组也有所增加[23]。另外,Defendenti等[24]分析43例IBD患者血清后发现,CD患者血清IL-9的水平与疾病严重程度相关。Feng等[25]的研究发现,CD患者血清IL-9的水平不仅与疾病严重程度相关,并且与英夫利西单克隆抗体(infliximab,IFX)临床疗效相关,血清IL-9水平的降低可以预测疾病的临床缓解和黏膜愈合。以上文献提示IL-9及其表达调控相关因子在UC及CD患者中均异常表达,IL-9与疾病严重程度相关,可以预测药物治疗效果。
在活动性UC患者的肠上皮细胞中可以观察到IL-9受体(interleukin 9 receptor,IL-9R)高表达,IL-9会抑制Caco-2单层上皮细胞的生长[18,26],其作用靶点是位于肠上皮细胞的IL-9R。Li等[27]的研究进一步明确,IL-9是通过IL-9-miR21-CLDN8通路促进CD患者结肠黏膜炎症的发生。紧密连接相关的密封蛋白8(claudin8,CLDN8)是维持肠黏膜屏障功能的重要组成部分,IL-9可以上调miR21的表达,miR21抑制CLDN8的表达,使黏膜屏障受损,诱导炎症的发生。抗IL-9和抗miR21治疗均可以恢复结肠黏膜CLDN8表达水平,减轻TNBS诱导的结肠炎。Tian等[22]的研究还发现,IL-9可以抑制结肠上皮细胞伤口愈合能力及细胞因子信号转导抑制因子3(suppressor of cytokine signaling 3,SOCS3)的表达,提高STAT3的磷酸化水平,而SOCS3的过度表达也可以减轻IL-9的诱导效应。此外,IL-9还可以促进claudin2的表达,抑制claudin3和occludin的表达[22]。以上提示IL-9的作用靶点是肠上皮细胞的IL-9R,通过下游的信号通路调节紧密连接蛋白的表达,从而破坏肠黏膜屏障的完整性。
因此,在胞外及胞内各种信号分子的共同作用下,原始CD4+ T细胞分化形成可以分泌IL-9的T细胞亚群,IL-9与肠上皮细胞上的IL-9R结合,进一步激活下游的信号通路,调节肠上皮间紧密连接蛋白的表达,破坏肠黏膜机械屏障,从而诱导IBD的发生。
另外,目前新观点认为,分泌IL-9的T细胞亚群是原始CD4+ T细胞在胞外细胞因子微环境发生变化时激活形成的一群"瞬时"细胞。在其形成过程中,会抑制其他T细胞亚群,比如Th17、Tregs的形成。因此,"Th9"细胞亚群的形成会导致其他T细胞亚群分化失衡,也会促进IBD的发展。
目前免疫性疾病的治疗主要基于以往已知的Th1、Th2细胞亚群产生的细胞因子,但缺乏显著的临床疗效。因此,对其他T细胞亚群或细胞因子的研究也许可以为临床诊疗提供新的思路[28]。IL-9在结肠炎体外模型、UC及CD患者中表达均升高且与疾病活动度相关,其作用可能是损伤肠上皮屏障功能并且抑制组织修复能力。敲除IL-9基因或者给予IL-9抗体治疗均可以缓解结肠炎,提示IL-9可以作为治疗IBD的一个潜在靶点。
所有作者均声明不存在利益冲突



























