
皮肤是炎症性肠病(IBD)最常累及的肠外器官之一,其特异性和反应性皮损通常与IBD的发病机制相似。皮疹的出现往往与消化道疾病活动有关,预示着需要更加积极的治疗,包括早期使用生物制剂。本文阐述了常见的IBD皮肤表现及药物相关的皮疹及处理原则,希望能为消化科及皮肤科医生提供参考,共同强化对IBD相关皮肤病变的认识及优化治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
6% ~ 47%的炎症性肠病(inflammatory bowel disease,IBD)患者伴有肠外表现(extraintestinal manifestations,EIM)[1]。皮肤是EIM最常累及的器官之一,根据不同发病机制分为特异性和反应性[2,3,4]。特异性是指同一疾病的肠外表现,如转移性克罗恩病(Crohn′s disease,CD)或者皮肤黏膜CD。反应性是指相同的发病机制但是组织病理特征不同,如坏疽性脓皮病(pyoderma gangrenosum,PG)、Sweet综合征(Sweet syndrome)、结节性红斑(erythema nodosum,EN)、化脓性汗腺炎(hidradenitis suppurativa,HS)和银屑病(psoriasis,Ps)等。肠外皮肤表现代表更严重的肠道疾病活动[5]。IBD伴发肠外皮肤表现的患者在治疗过程中常使用抗生素,而使用糖皮质激素、免疫调节剂、钙调神经磷酸酶抑制剂和抗肿瘤坏死因子(tumor necrosis factor,TNF)-α生物制剂的比率也明显升高,IBD相关的手术率也增加。严重的IBD又是坏疽性脓皮病的诱发因素[6]。早期使用生物制剂可以阻止皮损的发展,但药物相关的不良反应,尤其是皮疹又可能导致停药或需转换生物制剂[7,8]。
(一)腔周CD:是指与消化道相连的部位如口腔及肛周的皮肤肉芽肿性疾病,但需要排除其他原因如结核感染等引起的肉芽肿,可早于CD数月出现。肛周及腔周皮损常表现为溃疡、结节、增殖性斑块、裂隙及瘘管(图1),若合并肛瘘需警惕CD[9]。40%的患者出现继发于淋巴水肿的肛周皮赘,10%的患者会出现阿弗他溃疡和唇部肿胀及肉芽肿性唇炎(图2)。口腔黏膜可表现为鹅卵石样外观、线状溃疡、增殖性脓性口炎、牙龈小结节、牙龈增生。腹部手术如结肠造口术、回肠造口术等也可能在造口附近出现肉芽肿性炎症反应。
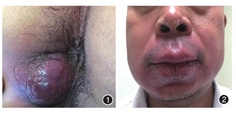

(二)皮肤转移性CD(cutaneous metastatic CD,CMCD):指与消化道不相连的部位出现的肉芽肿性皮损。在生殖器部位的皮疹通常表现为外阴、阴囊、阴茎部位肿胀、红斑、裂隙、淋巴水肿、皮赘和尖锐湿疣样增生。女性患者发生于阴唇部位者占65%,外阴通常表现为无压痛的红斑和大阴唇的肿胀,常延伸到阴蒂。男性患者发生在阴茎和阴囊部位者占78.6%[10,11]。除生殖器外可以见于腿部、皱褶部位、躯干、胸部、乳头、肚脐部、耳部等。皮疹表现多样,如脓肿形成、苔藓样、红斑块、脓疱等;皮疹可以无症状,但也有出现瘙痒、触痛和疼痛的情况。皱褶部位如腹股沟、肛周、腋窝或口腔黏膜的线状或者"刀砍征"(knife-cut)溃疡是皮肤CD相对特异的表现[12]。CMCD可以先于消化道症状出现,也可以同时或发生在消化道症状之后。儿童更容易出现CMCD且缺乏消化道症状。CMCD的发病与原发CD的严重程度无关,但是与发病部位有关。若发病部位在大肠,伴有转移性皮疹的情况更为常见[13]。皮肤CD的组织病理改变表现为肉芽肿性改变,但需排除感染性肉芽肿。同时出现苔藓样及肉芽肿性炎症反应加上肉芽肿性血管周围炎是本病的病理诊断依据。诊断皮肤CD时需要评估消化道情况。粪便钙卫蛋白能协助判断肠道炎症反应情况,尤其是只有CMCD而没有CD的儿童。CMCD可以局部外用糖皮质激素或钙调磷酸酶抑制剂,也可以局部注射糖皮质激素。严重CMCD且伴有肠道受累的患者需积极治疗肠道CD。
一项来自瑞士纳入3266例IBD患者的队列研究结果显示,19.2%的CD患者和9.5%的UC患者合并有皮肤疾病,其中合并结节性红斑的患者为7.6%,合并坏疽性脓皮病(PG)的患者为1.6%[5]。大约6.8% ~ 10.6%的IBD患者有化脓性汗腺炎(HS)[14];HS患者中IBD发病率是普通人群的4 ~ 8倍,发生于肛周部位的HS与IBD的关系更大[15]。银屑病、玫瑰痤疮、特应性皮炎患者中发生CD和UC的风险均较正常人群升高[16,17,18]。
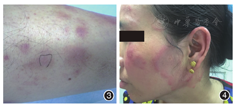
(一)结节性红斑(EN):EN是IBD最常见的皮肤表现,临床表现为成批出现的对称性疼痛性红斑性皮下结节(图3),皮疹不会破溃,好发于中青年女性胫前,偶尔可以累及大腿及前臂[19],可伴有发热、关节痛及全身乏力。结节性红斑与多种系统性疾病相关。IBD遗传相关的HLA-DRB10103、HLA-B27和HLA-B58与EN相关[20]。CD合并EN的情况更常见[21]。IBD患者出现EN的风险因素包括女性、结肠受累、既往IBD手术史、合并其他肠外表现如坏疽性脓皮病、家族遗传易感性[22]。EN与IBD疾病活动有关,与疾病严重程度无关[23]。

(二)嗜中性皮肤病(neutrophilic dermatoses):嗜中性皮肤病是一组组织病理上表现为皮肤血管周围或真皮弥漫性中性粒细胞浸润,但没有任何明确感染因素的疾病。其临床表现多样,中性粒细胞浸润可以发生在表皮、真皮甚至皮下脂肪组织,偶尔眼、关节、骨、肺和肾也可以发生类似的无菌性中性粒细胞浸润。临床分为皮下型(原型坏疽性脓皮病)、斑块型(原型Sweet综合征)、浅表及表皮型(急性发疹性发热性脓疱性皮病)。该组疾病与异常的中性粒细胞功能和细胞免疫受损有关,常与潜在的内脏疾病相关,IBD是其最常见的合并疾病之一[24]。
Sweet综合征可与CD及溃疡性结肠炎(ulcerative colitis,UC)并发,与中性粒细胞功能紊乱、Ⅲ型超敏反应有关[25]。该病女性多发,皮损表现为浸润性疼痛性丘疹及斑块(图4)。与坏疽性脓皮病一样,外伤或者针刺处可以出现特征性皮损(同形反应)。通常伴有发热等全身症状,常累及皮肤以外的器官。该病对于糖皮质激素治疗敏感,其他抑制中性粒细胞趋化活性的药物如氨苯砜、碘化钾、秋水仙碱也有效。沙利度胺、环孢素、甲氨蝶呤、阿那白滞素(白介素1受体拮抗剂)和TNF-α拮抗剂均可用于该病的治疗。
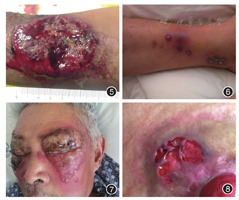
是以发作性皮肤疼痛性溃疡为特征的少见疾病。女性多见(占75%),高发年龄为20 ~ 50岁。儿童发病通常伴有系统性疾病如UC。PG临床分为溃疡型(图5)、脓疱型(图6,此型与IBD关系最为密切)、大疱型(图7)、浅表增殖型及腔周型(图8)。典型皮损初起时为疼痛性丘脓疱疹,周围紫色斑块,随皮疹发展中央发生坏死溃疡,形成脓性基底,向外呈潜行性发展,愈合留下筛孔状瘢痕。通常溃疡进展非常迅速,也有慢性起病。皮损好发于下肢,也可发生于任何部位包括黏膜腔口部位[26]。PG没有特异性或者确诊性的实验室指标,组织病理学特点典型表现是毛囊中心性中性粒细胞血管反应,通常采取排他性方法诊断,必须排除各种感染、肿瘤等可能引起皮肤溃疡的疾病,因而误诊及延误治疗常见[27]。溃疡进展极为迅速、疼痛非常剧烈、有潜行性紫红色溃疡边沿、脓性基底、同形反应等临床特征强烈提示PG,系统使用糖皮质激素1月内皮损面积缩小50%有助于诊断。其他治疗包括秋水仙碱、氨苯酚、钙调磷酸酶抑制剂、沙利度胺、环磷酰胺和环孢素,静脉免疫球蛋白和高压氧也有治疗效果,需要注意伤口护理和避免机械创伤,可外用他克莫司或者激素喷雾剂,严重患者可以使用抗TNF-α生物制剂治疗。30% ~ 50%的PG合并系统疾病,其中以IBD(5% ~ 20%的UC,1% ~ 2%的CD)、血液系统疾病(占3.9% ~ 25%)、关节炎(占10% ~ 20%)最为常见[28]。IBD患者发生PG的危险因素包括炎症性肠病活动、CD的结肠或者回结肠部位受累、UC的广泛结肠受累和女性[28]。PG也是各种自身炎性疾病综合征中的表现之一,如PAPA综合征(指同时并发化脓性关节炎、坏疽性脓皮病和痤疮)及SAPHO综合征(指同时并发滑膜炎、痤疮、脓疱病、骨肥厚、骨髓炎),所以怀疑PG时需要关注可能累及的部位和器官。

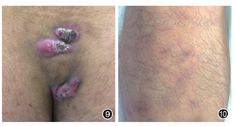
(三)化脓性汗腺炎(HS):HS是以皱褶部位如腋窝、腹股沟、肛周部位反复发生结节和脓肿,继之出现窦道和瘢痕为特征的慢性疾病(图9)。毛囊皮脂腺单位的原发性异常引起毛囊闭锁、囊肿形成、破裂,角化物进入真皮触发皮肤固有免疫系统的反应是其发病的始发因素。炎性因子TNF-α、IL-1β和IL-17通路在HS中均起作用。HS青春期前少见。发生于肛周的HS很难与皮肤CD鉴别,此时注意检查腋窝部位,后者少有腋窝受累[29]。治疗包括抗生素如四环素、克林霉素、利福平,系统使用维A酸类药物。严重者可以使用抗TNF-α生物制剂或手术加激光治疗、光动力治疗等。HS与各种固有免疫反应异常的疾病如坏疽性脓皮病、IBD相关关节炎等有关,是各种自身炎症反应综合征如PASH综合征(指同时并发坏疽性脓皮病、痤疮和化脓性汗腺炎),PAPASH综合征(指同时并发化脓性关节炎、坏疽性脓皮病、痤疮和化脓性汗腺炎),PAC综合征(指同时并发坏疽性脓皮病、痤疮和溃疡性结肠炎)的表现之一。

(四)银屑病:典型皮损以边界清楚的鳞屑性丘疹斑块为特征,刮屑试验阳性。全身皮肤均可以受累,以头皮、肘部及膝部最常见,冬季好发。临床分为寻常型、关节病型、脓疱型和红皮病型四大类,其中掌跖脓疱病及Hallopeau连续性肢端皮炎现在认为是银屑病的罕见类型。10%的银屑病患者伴有其他炎性疾病。CD、UC和银屑病都与骶髂关节炎和HLA-B27相关。IBD和银屑病共同享有MHC相关6p21位点易感基因,IL-23R和IL-12B是银屑病和IBD发病中共同通路,IL-12B在银屑病及IBD发病中也产生影响。银屑病患者肠道微生态多样性和丰富性下降与IBD患者类似[30]。消化道皮肤轴的理论提出强调了消化道微生态失衡与皮肤表现的紧密关系[31]。
(五)肠病相关性皮炎关节痛综合征(bowel-associated dermatosis-arthritis syndrome,BADAS):通常表现为中性粒细胞皮炎伴随有发热、关节痛、肌痛及胃肠道症状,可在肠道旁路术后3个月至5年出现,也与憩室炎、消化道溃疡及IBD有关[32]、皮疹好发于四肢及躯干,表现为瘙痒性或者有压痛的红斑、斑块、丘疹、丘脓疱疹或者可以触及的皮下结节。皮疹持续4周左右。我们曾经报道一例皮损表现为结节性动脉炎的患者(图10)[33]。
(六)其他:特应性皮炎(atopic dermatitis,AD)以慢性复发的剧烈瘙痒为特点,常合并其他特应性疾病如过敏性鼻炎、哮喘、结膜炎、食物过敏等。IBD和AD有共同的发病机制,即在基因异常基础上,由于皮肤或肠道菌群失衡引起一系列的炎症反应,IBD选择性免疫相关的基因位点与AD显著相关[34]。玫瑰痤疮以面中部皮肤阵发性潮红、持续性红斑及丘疹脓疱为特点,该病与IBD有部分共同的基因背景及环境危险因素[35]。玫瑰痤疮与IBD的疾病严重程度相关。
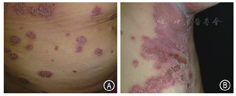
抗TNF-α生物制剂是目前应用最广的生物制剂之一。一项纳入917例使用抗TNF-α生物制剂治疗的IBD患者的队列研究分析发现,29%(264/917)的患者出现皮疹[36]。已报告的药物相关皮肤不良反应包括银屑病加重、脓疱性皮疹(掌跖脓疱病、皱褶部位脓疱性皮病等)、化脓性汗腺炎、湿疹反应、红斑狼疮、皮肌炎、结节病、环状肉芽肿、苔藓样反应、结节性多动脉炎、血管炎、斑秃、白癜风和局部注射反应等。由于抗TNF-α生物制剂同时可用于治疗其中一些疾病,如银屑病,因而称之为自相矛盾的炎性皮肤反应。英夫利西单克隆抗体、阿达木单克隆抗体和赛妥珠单克隆抗体治疗IBD诱导银屑病或者加重银屑病均有报道,银屑病样皮疹(图11A)通常发生于抗TNF-α生物制剂治疗IBD临床症状缓解期,平均时间13.79月,也有延迟至105个月的情况[36]。与典型银屑病不同,药物导致的银屑病样皮疹最易出现在皱褶部位(图11B)如腋窝、腹股沟,生殖器部位和头皮。大部分出现皮疹的患者不需要停药,外用糖皮质激素治疗及对症治疗后一般随访6个月左右皮疹消退,但依然有10.6%的IBD患者由于皮疹瘙痒严重、发生在面部不能接受、反复发作等原因而停用抗TNF-α生物制剂。另一项纳入7415例抗TNF-α生物制剂治疗IBD的队列研究显示其引起银屑病的发生率为1.7%[37]。这种矛盾皮疹发生的危险因素包括吸烟、高体质量指数、CD、基因易感性和女性,UC和免疫抑制药物的使用是其负相关的因素。药物导致的银屑病样皮疹以Th17和Th1细胞浸润为主,表达IL-17A阳性T细胞的数量与皮疹的严重程度有关,Ⅰ型干扰素(interferon,IFN)在TNF-α拮抗剂引起的银屑病样皮疹及盘状红斑狼疮或者扁平苔癣中均有发现,从而提示抗TNF-α生物制剂引起的银屑病样皮疹不同于真正的银屑病。抗TNF-α生物制剂使IFN-α表达增加导致银屑病样皮疹[38]。治疗包括外用糖皮质激素、戒烟、润肤、角化治疗、维生素D衍生物、光疗、甲氨蝶呤或硫唑嘌呤。严重皮疹可以转换乌司奴单克隆抗体,目前认为其疗效显著,同样被推荐用于IBD相关的中性粒细胞皮病[39]。抗TNF-α生物制剂治疗IBD引起狼疮样皮疹也有报道[40]。与出现银屑病样皮疹大部分维持原治疗不同,一旦确诊了狼疮样皮疹,所有患者均选择停药。乌司奴单克隆抗体引起皮疹也有报道[41]。在CD治疗中维多珠单克隆抗体与抗TNF-α生物制剂相比发生新的EIM风险更高[42]。

综上所述,皮肤和消化道是人体与外界相通的两大保护屏障器官,一旦屏障破坏,皮肤黏膜表面菌群失衡,在遗传因素影响下天然免疫和适应性免疫启动,会导致一系列的炎症反应,累及各个系统包括皮肤和消化道而引起不同的疾病症状。本文集中总结了几个与IBD相关的常见皮肤疾病,其中的特异性及反应性皮肤疾病与IBD的致病机制相似,治疗方式亦可互相参照。伴有皮肤表现的IBD往往需要更加积极的治疗,但需要关注生物制剂可能引起的矛盾反应。因而识别IBD相关的肠外皮肤表现非常重要。精准的诊断和治疗方案选择需要消化科、皮肤科及风湿科等相关科室医生携手合作。
所有作者均声明不存在利益冲突



























