
通过人体成分分析方法评估慢性放射性肠炎患者的营养状况,探讨人体成分分析的临床应用价值。
前瞻性纳入2013年1月至2017年10月于中山大学附属第六医院诊断为慢性放射性肠炎的57例患者作为慢性放射性肠炎组,其中放射性小肠炎18例,放射性直肠炎39例。同时选取同期57例健康体检者作为正常对照组。收集受试者的一般资料,评估其营养状况,采用人体成分分析仪检测各种人体成分。比较慢性放射性肠炎和正常对照组人体成分的差异,以及放射性小肠炎和直肠炎之间人体成分的差异。
慢性放射性肠炎患者发生营养风险和营养不良的比例均高于正常对照组(均P<0.05)。放射性小肠炎患者细胞内液[(15.42 ± 2.21)L比(17.14 ± 2.21)L]、总液量[(24.75 ± 3.69)L比(27.14 ± 3.08)L]、外液比值(0.37 ± 0.01比0.35 ± 0.02)、蛋白总量[(7.54 ± 1.45)kg比(8.53 ± 1.75)kg]、脂肪总量[(9.72 ± 4.53)kg比(15.15 ± 5.86)kg]、瘦组织[(34.59 ± 4.95)kg比(38.12 ± 4.40)kg]、手臂肌肉围度[(19.52 ± 1.40)kg比(21.06 ± 2.00)kg]、体质量指数[(19.39 ± 3.51)kg比(20.50 ± 3.10)kg]均显著低于放射性直肠炎患者,差异均具有统计学意义(均P<0.05)。
人体成分分析可以提供简便和准确的人体测量,适用于评估慢性放射性肠炎患者的营养状态。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性放射性肠炎是盆腹腔、腹膜后恶性肿瘤经放射治疗后出现的肠道损伤,往往在放疗结束3个月后出现,表现为便血、腹泻、腹痛、肛门疼痛、里急后重等一系列症状。随着放疗技术的发展,越来越多的盆腹腔恶性肿瘤患者接受根治性或姑息性放疗,导致放射性肠炎发病率逐年上升,而迁延反复的肠道不适症状严重影响患者生活质量。由于多次放化疗、既往手术和肿瘤负荷的影响,放射性肠炎患者多数在短期内出现体质量的下降。此外,肠道症状会造成患者巨大的心理压力,进食量明显减少。因此,放射性肠炎患者往往存在不同程度的营养不良,成为疾病康复的掣肘。
人体成分分析可快速准确地测量人体中各组成成分的含量,判断蛋白质、脂肪、水分等物质是否正常,对人体的营养状况起到指示作用,可作为营养评估的重要方法。本研究旨在通过对放射性肠炎患者和正常人群人体成分的比较以及不同部位放射性肠炎人体成分的比较,为放射性肠炎的营养干预提供理论依据。
前瞻性纳入2013年1月至2017年10月于中山大学附属第六医院诊断为慢性放射性肠炎的57例患者。纳入标准:(1)年龄18 ~ 75岁。(2)既往无其他肿瘤性疾病,已治愈的宫颈原位癌、子宫内膜癌、睾丸癌、阴道癌、前列腺癌除外。(3)无严重的心理障碍。(4)无严重胃肠道疾病如中重度十二指肠溃疡、胃溃疡、溃疡性结肠炎(UC)、克罗恩病(CD)等,以及穿孔、出血、肠梗阻等术后并发症。(5)住院1 d以上。(6)神志清。(7)入院次日8时未行手术者。排除标准:(1)住院不足1 d。(2)肝功能不全及自身免疫性疾病患者。(3)急诊手术患者。(4)病程在6个月以内的急性放射性肠炎患者。
慢性放射性肠炎诊断标准:主要依据既往肿瘤病史、放化疗史、临床症状和影像学检查结果进行综合判断[1]。所有患者行血液肿瘤标志物检测和盆腔MRI检查,部分患者诊断存在肿瘤复发。按发病部位分为放射性直肠炎和放射性小肠炎。直肠炎患者均有明显鲜血便症状,均通过纤维结肠镜检查明确直肠黏膜存在出血或溃疡。小肠炎患者均有腹痛症状,加行CT小肠造影(CTE)明确小肠炎诊断,部分患者并发不完全性肠梗阻。
同时选取同期57例健康体检者作为正常对照组,纳入标准:均无心血管系统疾病,无肿瘤病史,无糖尿病等代谢性疾病,无手术史,未使用激素治疗。本研究获得中山大学附属第六医院伦理委员会审批。
记录受试者的年龄、性别、病程等。患者入院后第2天清晨空腹抽血,测定血红蛋白、白蛋白、前白蛋白等指标。
NRS2002是由欧洲肠外肠内营养协会(ESPEN)于2002年提出并推荐使用的,以循证医学为基础的营养风险筛查工具。NRS2002评分≥3分即存在营养风险。此次入组者均符合NRS2002评定标准,由统一培训的护士进行一般情况调查及病史问诊,填写营养风险筛查表。患者筛查后如有营养风险,再进行营养评估。
结合临床,将出现以下指标之一即定义为营养不良:BMI<18.5 kg/m2,白蛋白<35 g/L,前白蛋白<0.2 g/L。
按照24 h入院诊断填写表格,根据最后诊断进行调整;空腹、排空大小便、免鞋后测定身高(精确到0.5 cm)、体质量(精确到0.5 kg)。
所有受试者检测前6 h内不可进食,2 h内不可沐浴、静脉补液及体力活动,检查前排空大小便。常规测量身高和体质量后,采用韩国拜斯倍斯公司S10型人体成分分析仪进行人体成分测定。受试者赤足平躺于检查床上,两腿伸直,两足分开与肩部平行,足部相应的电极夹在双足跟,手部相应的电极夹住相应的手指(双手拇指及中指分别置于电极套中),输入编号、姓名、年龄、身高、体质量及性别后即开始测量,测量时间2 ~ 3 min。记录受试者的细胞内外液、总液量、蛋白总量、脂肪总量、肌肉质量、瘦组织、手臂肌肉围度(full girth of the arm muscles,AMC)、体质量指数(bmipython,BMI)和基础代谢率(basal metabolic rate,BMR)的数值,并计算内液比值和外液比值。细胞内液或细胞外液比值=细胞内液或细胞外液/总液量。
采用SPSS 22.0统计软件,计量资料以(Mean±SD)表示,两组间比较采用独立样本t检验;计数资料采用例和(或)百分比表示,两组间比较采用χ2检验。以P<0.05为差异具有统计学意义。
57例放射性肠炎患者中,女性55例,男性2例;年龄37 ~ 88岁,平均(53.86 ± 8.32)岁。正常对照组中,女性55例,男性2例;年龄28 ~ 72岁,平均(56.58 ± 9.86)岁。两组在年龄和性别上差异无统计学意义(P>0.05)。
根据营养风险筛查NRS2002标准,放射性肠炎组28例有营养风险,营养风险发生率为49.1%(28/57),正常对照组营养风险发生率为10.5%(6/57)。根据营养不良的诊断标准,放射性肠炎患者总体营养不良发生率为45.6%(26/57),正常对照组总体营养不良发生率为7.0%(4/57)。放射性肠炎患者发生营养风险和营养不良的比例均高于正常对照组,且白蛋白、血红蛋白、前白蛋白均显著低于正常对照组,差异具有统计学意义(均P<0.05)。见表1。
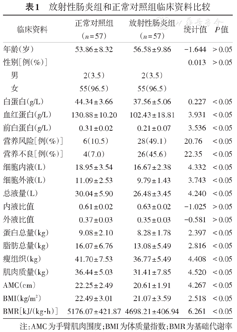
放射性肠炎组和正常对照组临床资料比较
放射性肠炎组和正常对照组临床资料比较
| 临床资料 | 正常对照组(n = 57) | 放射性肠炎组(n = 57) | 统计值 | P值 | |
|---|---|---|---|---|---|
| 年龄(岁) | 53.86 ± 8.32 | 56.58±9.86 | -1.644 | >0.05 | |
| 性别[例(%)] | 0.013 | >0.05 | |||
| 男 | 2(3.5) | 2(3.5) | |||
| 女 | 55(96.5) | 55(96.5) | |||
| 白蛋白(g/L) | 44.34 ± 3.66 | 37.56±5.06 | 0.227 | <0.05 | |
| 血红蛋白(g/L) | 130.88±10.20 | 102.43±18.81 | 3.931 | <0.05 | |
| 前白蛋白(g/L) | 0.31 ± 0.02 | 0.21±0.07 | 3.536 | <0.05 | |
| 营养风险[例(%)] | 6(10.5) | 28(49.1) | 20.76 | <0.05 | |
| 营养不良[例(%)] | 4(7.0) | 26(45.6) | 22.35 | <0.05 | |
| 细胞内液(L) | 18.95 ± 3.54 | 16.67±2.38 | 4.332 | <0.05 | |
| 细胞外液(L) | 11.09 ± 2.53 | 9.79±1.43 | 3.743 | <0.05 | |
| 总液量(L) | 30.04 ± 5.90 | 26.48±3.45 | 4.240 | <0.05 | |
| 内液比值 | 0.61 ± 0.02 | 0.63±0.02 | -1.025 | >0.05 | |
| 外液比值 | 0.37 ± 0.03 | 0.35±0.03 | -0.581 | >0.05 | |
| 蛋白总量(kg) | 9.08 ± 2.10 | 8.28±1.78 | 2.397 | <0.05 | |
| 脂肪总量(kg) | 16.07 ± 6.76 | 13.08±5.49 | 2.816 | <0.05 | |
| 瘦组织(kg) | 41.70 ± 7.53 | 36.77±5.49 | 4.408 | <0.05 | |
| 肌肉质量(kg) | 36.44 ± 5.03 | 31.41±7.85 | 4.520 | <0.05 | |
| AMC(cm) | 22.25 ± 2.49 | 20.61±1.91 | 4.267 | <0.05 | |
| BMI(kg/m2) | 22.49 ± 3.01 | 21.07±3.59 | 2.518 | <0.05 | |
| BMR[kJ/(kg·h)] | 5176.07±421.87 | 4698.21±406.94 | 6.261 | <0.05 | |
注:AMC为手臂肌肉围度;BMI为体质量指数;BMR为基础代谢率
人体成分分析结果中,放射性肠炎组患者细胞内外液、总液量、蛋白总量、脂肪总量、瘦组织、肌肉质量、AMC、BMI、BMR均显著低于正常对照组,差异具有统计学意义(均P<0.05)。见表1。
57例放射性肠炎患者中,放射性小肠炎18例,放射性直肠炎39例。由表2可见,放射性小肠炎组与放射性直肠炎组患者的年龄、性别、白蛋白、前白蛋白、血红蛋白、营养风险和营养不良的比例差异无显著统计学意义(P>0.05)。
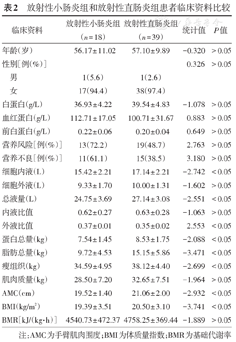
放射性小肠炎组和放射性直肠炎组患者临床资料比较
放射性小肠炎组和放射性直肠炎组患者临床资料比较
| 临床资料 | 放射性小肠炎组(n = 18) | 放射性直肠炎组(n = 39) | 统计值 | P值 | |
|---|---|---|---|---|---|
| 年龄(岁) | 56.17±11.02 | 57.10±9.89 | -0.320 | >0.05 | |
| 性别[例(%)] | 0.326 | >0.05 | |||
| 男 | 1(5.6) | 1(2.6) | |||
| 女 | 17(94.4) | 38(97.4) | |||
| 白蛋白(g/L) | 36.93 ± 4.22 | 39.54±4.83 | -1.078 | >0.05 | |
| 血红蛋白(g/L) | 112.71±17.05 | 100.71±31.67 | 0.883 | >0.05 | |
| 前白蛋白(g/L) | 0.22 ± 0.06 | 0.20±0.04 | 0.649 | >0.05 | |
| 营养风险[例(%)] | 13(72.2) | 19(48.7) | 2.763 | >0.05 | |
| 营养不良[例(%)] | 11(61.1) | 15(38.5) | 3.180 | >0.05 | |
| 细胞内液(L) | 15.42 ± 2.21 | 17.14±2.21 | -2.742 | <0.05 | |
| 细胞外液(L) | 9.33 ± 1.70 | 10.00±1.31 | -1.602 | >0.05 | |
| 总液量(L) | 24.75 ± 3.69 | 27.14±3.08 | -2.551 | <0.05 | |
| 内液比值 | 0.62 ± 0.27 | 0.63±0.28 | -1.063 | >0.05 | |
| 外液比值 | 0.37 ± 0.01 | 0.35±0.02 | 2.553 | <0.05 | |
| 蛋白总量(kg) | 7.54 ± 1.45 | 8.53±1.75 | -2.088 | <0.05 | |
| 脂肪总量(kg) | 9.72 ± 4.53 | 15.15±5.86 | -3.471 | <0.05 | |
| 瘦组织(kg) | 34.59 ± 4.95 | 38.12±4.40 | -2.699 | <0.05 | |
| 肌肉质量(kg) | 28.50 ± 7.20 | 32.65±7.51 | -1.964 | >0.05 | |
| AMC(cm) | 19.52 ± 1.40 | 21.06±2.00 | -2.932 | <0.05 | |
| BMI(kg/m2) | 19.39 ± 3.51 | 20.50±3.10 | -3.741 | <0.05 | |
| BMR[kJ/(kg·h)] | 4540.73±472.37 | 4758.25±369.44 | -1.889 | >0.05 | |
注:AMC为手臂肌肉围度;BMI为体质量指数;BMR为基础代谢率
人体成分分析结果中,放射性小肠炎患者细胞内液、总液量、外液比值、蛋白总量、脂肪总量、瘦组织、AMC、BMI均显著低于放射性直肠炎组,差异具有统计学意义(均P<0.05),见表2。
放射性肠炎是盆腔恶性肿瘤放射治疗的常见并发症。对于女性的宫颈癌和子宫内膜癌,放疗是重要的治疗方案[2]。大多数妇科肿瘤会采用后装治疗方案,放射源于阴道近距离照射直肠,极易造成直肠损伤。主要表现为便血和肛门疼痛,症状反复,因此,放射性肠炎以女性多见,且多表现为放射性直肠炎。本组患者中女性占93%,放射性直肠炎占68.4%。因盆腔结构复杂,除直肠、膀胱、子宫和附件外,往往还有游离的小肠下坠至盆腔,放射治疗在治疗原发肿瘤的同时,不可避免会造成小肠损伤,进而导致放射性小肠炎[3]。约35%的患者可合并直肠溃疡[4]。
放疗导致小肠屏障功能被破坏,多数患者伴顽固性腹泻、脱水。长期腹泻导致营养物质不能充分消化吸收,是产生营养不良的重要机制之一。同时小肠进行性肠壁纤维化继发管腔狭窄可出现腹痛、腹胀等梗阻症状。梗阻导致摄入减少,更进一步加重营养不良。肠壁进行性纤维化也可继发肠瘘,相应可出现阴道排液、会阴部疼痛、尿路感染等症状,严重影响患者生活质量[5]。由此可见,疾病消耗和摄入不足会出现体质量的丢失,放射性肠炎患者常发生蛋白质-热能营养不良。放化疗、既往手术和肿瘤负荷亦是营养不良的危险因素,因此,放射性肠炎患者营养不良的发生率较高[6]。
BMI被认为是反映蛋白质热能营养不良的可靠指标[7]。根据联合国粮农组织推荐的BMI的诊断标准[8],结合白蛋白及前白蛋白的指标得出本组放射性肠炎患者有45.6%的营养不良发生率,与文献报道中44%的发生率基本相符[6],显著高于健康体检者7.0%的发生率。本研究放射性肠炎患者营养风险发生率为49.1%,而正常人群只有10.5%的发生率,说明放射性肠炎患者出现不良临床结局的风险远远高于正常人群。
实验室检查是评价营养状况的重要指标之一,血浆蛋白水平可以反映机体蛋白质的营养状况,临床常用指标有血清白蛋白、前白蛋白等,在应激状态下,白蛋白水平降低,如这种低水平维持1周以上,可表示有急性营养缺乏。血清白蛋白低于35 g/L,临床上常出现蛋白质营养不良。前白蛋白是肝脏合成的一种糖蛋白,高转化率使得其能够更加及时地反映营养状况和能量状况。但是炎性反应会影响前白蛋白的准确性,因而不能用于急性期。本研究中放射性肠炎患者几项蛋白指标均低于健康体检者,不同部位放射性肠炎间几种蛋白均无显著差异。血红蛋白亦是营养评价指标之一,本研究中放射性小肠炎和放射性直肠炎患者血红蛋白虽低于正常值,但两组之间差异无显著统计学意义。作者考虑可能由于放疗后造成的骨髓抑制以及严重的营养不良同样造成小肠炎患者严重的贫血。因此两组之间贫血程度相差不大。
放射性肠炎与健康人群在多项人体成分分析指标上存在差异,如脂肪含量、蛋白质含量、瘦组织、AMC等均显著低于健康人群。放射性小肠炎的上述指标又显著低于放射性直肠炎患者。
蛋白质-热能营养不良分为3种类型:消瘦型、水肿型、混合型[9]。不论是消瘦型还是水肿型,均有体液潴留从而发生水肿。水肿既存在细胞外液水分含量增加型水肿,也存在内外液均丢失且内液水分丢失比例更高的水肿,前者多见于疾病带来的水失衡,而后者通常发生营养状态异常,可能发生无凹陷浮肿体征[10]。本研究中,放射性肠炎患者液体总量、细胞内外液量均明显低于健康人群,说明放射性肠炎患者总体水分是缺乏的。此外,放射性小肠炎患者细胞内液和总液量明显低于直肠炎患者,而细胞外液比值显著高于直肠炎患者,提示小肠炎患者更容易发生营养状态异常型水肿,其营养状态更需要临床关注。
AMC是反映肌蛋白贮存和消耗程度的指标,数值越小说明肌肉发育状况越差。瘦组织由肌肉和无机质组成,而瘦组织群的减少是疾病预后不良的一个重要因素。
放射性肠炎患者的BMR明显低于正常对照组。除性别、年龄、疾病因素外,BMR随体质量、瘦组织及脂肪含量降低而降低,严重的饥饿或节食会导致BMR的下降。体力活动和应激状态均可以增加BMR。对于近期未行手术治疗的放射性肠炎患者来说,患者一般体力活动降低,应激不显著,体质量、瘦组织及脂肪含量也较未患病者低。因此,BMR显著低于健康人群。
放射性小肠炎的人体成分指标大多低于放射性直肠炎患者。究其原因,放射性肠炎的症状虽偶可自行缓解,但易反复发作,不作处理甚至可持续终身,疾病消耗和营养物质丢失时间较长,小肠炎尤甚。同时由于小肠是营养物质吸收的主要场所,吸收不良和营养素的丢失在小肠炎重于直肠炎,使得小肠炎患者的脂肪、蛋白质、瘦组织丢失以及水失衡的情况更为突出。
综上,当前虽然有很多营养评价方法,但至今仍没有"金标准",血清学指标有较多的缺陷,如半衰期太长,不能及时反映营养状态以及容易受炎性反应和肝肾功能影响。本研究发现,放射性肠炎患者发生营养风险和营养不良的比例均高于健康体检者,且人体成分中反映营养状态的蛋白含量、脂肪含量各项指标均低于健康体检者,而放射性小肠炎患者人体成分指标大多也均低于放射性直肠炎患者。结果说明人体成分分析可以提供简便和准确的人体测量,适用于评估放射性肠炎患者的营养状态。或许未来可作为放射性肠炎营养治疗和预后的参考。
所有作者均声明不存在利益冲突



























