
全结直肠切除(TPC)+回肠储袋肛管吻合术(IPAA)已成为外科治疗难治性溃疡性结肠炎(UC)、UC合并癌变以及家族性腺瘤性息肉病的标准术式。IPAA术后除了常见手术并发症外,还可能出现一系列与储袋相关的炎性疾病和功能异常,如储袋炎、储袋克罗恩病(CD)和直肠残端封套炎等,从而影响患者的手术恢复和生活质量,其中储袋炎是UC患者IPAA术后最常见的远期并发症,其累计发病率可达50%。随着我国IPAA手术的不断成熟和推广应用,越来越多的患者将会面临着储袋炎性疾病及功能障碍的困扰,而不同类型的储袋炎性疾病及功能障碍的诊断和治疗手段也不尽相同。本文就目前储袋炎性疾病及功能障碍的诊断和治疗进展进行汇总及论述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
全结直肠切除(total proctocolectomy,TPC)加回肠储袋肛管吻合术(ileal pouch-anal anastomosis,IPAA)于1978年首次由Parks提出,现已成为治疗溃疡性结肠炎(ulcerative colitis,UC)和家族性腺瘤性息肉病(familial adenomatous polyposis,FAP)的首选手术方法[1]。尽管UC的药物治疗方式得到不断的发展,但仍有30%的患者因内科治疗无效或出现不典型增生,需要接受手术治疗,其中大部分患者适合行IPAA[2]。IPAA不仅能够降低UC和FAP患者罹患结直肠癌的风险,还能够恢复肠道连续性,改善患者术后的生活质量。但与此同时,因疾病和术式的特殊性,IPAA术后除一般手术并发症外,还会出现一系列与储袋相关的炎性疾病和功能障碍,如储袋炎、储袋克罗恩病(Crohn′s disease,CD)、直肠残端封套炎、储袋易激综合征(irritable pouch syndrome,IPS)等,从而影响患者的术后效果及生活质量。其中储袋炎是接受IPAA手术的UC患者最常见的远期并发症,其累计发病率可达50%[3]。本文根据目前已有证据和笔者储袋炎专科大量病例的经验,总结储袋相关炎性疾病的多种诊断技术和治疗手段的疗效证据,为临床工作者制定诊疗决策提供参考。
研究显示,患者IPAA术后总体满意度较高,患者的一般状况得到改善,精神体力、人际关系、工作状态和社会活动等生活质量指标均有显著提高,术后1年的生活质量评分基本与正常人无异[4,5]。但在IPAA术后早期,排便次数增加是常见的现象,患者一般平均每天排便5 ~ 6次,夜间排便1 ~ 2次,尤其是在适应储袋前的最初几个月且不使用止泻药的情况下排便可达每日20余次[6,7]。同时,术后早期可能还会出现肛门渗液的情况,应使用具有隔离作用的软膏来保护肛周皮肤,以避免皮肤感染或开裂引起的瘙痒和疼痛不适。在经历1年的适应期后,患者排便次数逐渐减少并稳定在日间排便1 ~ 2次,仅在术后20 ~ 30年因肛门括约肌功能下降而少量增加[7]。在排便次数较多、肛周渗液或大便失禁的情况下,食用能够使大便增稠或者富含纤维素的食物能在一定程度上改善症状,必要时可适量使用洛哌丁胺等止泻药。内镜检查可见储袋黏膜正常,无明显充血,常见吻合口处线性溃疡,为术后正常改变。
储袋炎性疾病及功能障碍可表现为多种症状,包括发热、排便次数增加、大便失禁、便血、腹痛等[8],由于这些症状缺乏特异性,仅凭症状往往难以作出诊断。因此,储袋炎性疾病及功能障碍的诊断常需要结合多种检查手段以评估储袋的状态和功能,如内镜、病理、影像、实验室等检查以及肛门直肠测压(anorectal manometry,ARM)和球囊排出试验(balloon expulsion testing,BET)等。
内镜是评估储袋状态和功能的重要手段,对分辨储袋炎性疾病具有重要价值。储袋镜检查时,正确辨认储袋的标志性结构至关重要,这些结构包括储袋出入口、输入输出袢、储袋盲端、储袋体部和直肠封套部等[9]。储袋镜可以从每个不同的区域捕获图像,并加以存档。对于储袋炎性疾病,储袋镜可观察到储袋的扩张和充盈能力、炎症的程度和范围,以及是否存在储袋前回肠炎症、炎性息肉或封套炎等[9]。在发现孤立的输入袢溃疡时,应警惕CD[10]、非甾体抗炎药(NSAIDs)相关储袋炎[11]或储袋缺血的可能性,而局限于封套部位的炎症则应考虑直肠残端封套炎[12]。伪膜的存在则提示艰难梭菌感染(Clostridium difficile infection,CDI)。储袋非对称分布的炎症,尤其是沿缝合线出现的边界清晰的单侧炎症,往往提示储袋缺血的存在[12]。此外,储袋镜的另一优势是能够提供组织活检病理结果,能够为是否存在肉芽肿、病毒包涵体和不典型增生提供进一步的证据,但其对急慢性炎症的辨别作用较为有限[8]。
可用于诊断储袋炎性疾病和功能障碍的影像学检查包括计算机断层扫描小肠造影(computed tomography enterography,CTE)或磁共振小肠造影(magnetic resonance enterography,MRE)、盆腔磁共振成像(magnetic resonance imaging,MRI)、水溶性造影剂储袋造影以及钡剂或MR排粪造影等。CTE或MRE能够用于分辨储袋和小肠的脓肿、狭窄和炎症[9]。与常规的CT和MRI相比,CTE的优点在于能够更加清楚地显示小肠结构。而相对于CT,盆腔MRI能够更加准确地评估复杂性肛周疾病的类型、慢性窦道的走行和直肠袖套的长度。水溶性造影剂储袋造影可以用于储袋的解剖结构和形状的评估,而钡剂或MR排粪造影能够对储袋的功能进行动态的评估[8]。
麻醉下探查(examination under anesthesia,EUA)是评估储袋相关疾病的重要手段,其不仅能够用于储袋相关疾病的诊断,也可用于治疗。EUA是诊断储袋CD的有效手段,尤其适合于生理或心理上不能忍受非镇静检查的患者[8]。虽然EUA应用于IPAA患者的研究报道仍较少,但从目前CD合并肛瘘患者使用EUA的结果来看,在IPAA患者中推广应用EUA也是可行的。
实验室检查对于慢性储袋炎的诊断具有重要作用,尤其是在排除继发性因素引起的储袋炎症方面。肝酶检测有助于发现原发性硬化性胆管炎(primary sclerosing cholangitis,PSC),粪便检查能够发现是否存在CDI,而腹水血清学检测有助于排除其他腹腔疾病。进一步的实验室检查还能够发现患者是否存在贫血、维生素B12或维生素D缺乏的情况[8]。此外,一些炎性标志物,如C-反应蛋白、红细胞沉降率、钙卫蛋白和乳铁蛋白等,虽然没有特异性,但对于储袋炎性疾病的诊断也具有一定的参考价值。
如前所述,在怀疑储袋存在功能障碍时,影像学检查中的钡剂和MR排粪造影能够用于评估储袋的功能。此外,尽管目前尚缺乏IPAA术后患者肛门直肠测压和球囊排出试验的确切参考数值,但在评估储袋功能时,肛门直肠测压和球囊排出试验也是临床常用的检查方法[13]。
IPAA术后患者易发生各种储袋炎性疾病,其中储袋炎最为常见。储袋炎是回肠储袋的非特异性炎症反应,根据病程可以分为急性(<4周)和慢性(≥4周);根据抗生素治疗反应可以分为抗生素有效、抗生素依赖和抗生素抵抗型;根据发病原因可以分为特发性和继发性[14]。特发性常难以阐述其发生原因,而继发性的诱发因素则有很多,包括感染、缺血、储袋CD、PSC、放疗和NSAIDs等。继发性储袋炎占慢性储袋炎的20% ~ 30%[11],其治疗与特发性储袋炎存在一定的差异,因此,在临床诊断时应注意加以区分。
数据显示,约有50%的UC患者会在IPAA术后发生储袋炎[3]。而FAP患者在IPAA术后出现储袋炎的概率则相对低一些,但研究报道仍有20%的发病率[15]。大部分储袋炎是特发性的,发病机制目前仍不清楚,可能与易感人群肠道菌群失调引起的异常黏膜免疫反应有关[9,16]。研究发现,储袋炎多在粪便经储袋排出之后出现,且抗生素治疗能够缓解症状,推测储袋菌群可能在储袋炎的发病中起到重要作用[17]。同时,一些遗传易感因素已确认与储袋炎的发病密切相关。免疫遗传学的研究表明,遗传多态性如白细胞介素(interleukin,IL)-1受体拮抗以及胱冬蛋白酶激活与募集域15(caspase activation and recruitment domain 15,CARD15)基因突变可能增加储袋炎的发病风险[18,19]。此外,已有报道指出,储袋炎患者中存在黏膜固有免疫和获得性免疫的改变[20],炎性黏膜中幼稚浆细胞比例明显增多[21],且存在促炎和免疫调节因子之间的失衡[22]。
储袋炎患者可出现各种储袋疾病相关症状,包括排便频率增加、排便窘迫、里急后重、大便失禁、夜间渗漏、肛门出血、腹部绞痛和其他下腹部不适,也可出现发热、寒战和体质量减轻等全身性症状。但是这些症状缺乏特异性,仅靠症状不足以作出特发性储袋炎的诊断,常需要结合内镜和组织学检查以排除继发性因素。储袋内镜是储袋炎诊断和鉴别诊断的重要方法。内镜检查是判断储袋炎症程度最准确的方法,储袋炎内镜下表现包括红斑、水肿、结节颗粒增加、血管形态消失、黏膜质脆、出血、溃疡和糜烂等。虽然与内镜相比,组织学检查在判断储袋炎的炎症分级中作用有限,但其在储袋炎的诊断和鉴别诊断中仍有一定价值。急性炎症的组织学特征包括溃疡、中性粒细胞浸润及隐窝脓肿等,但绒毛变钝、隐窝细胞增生和固有层单核细胞数量增加等慢性病理变化可能只是储袋黏膜对粪便滞留所作出的适应性改变,而不一定是储袋炎的表现[23]。目前已有一些评分系统将症状和内镜结果相结合以帮助诊断储袋炎,其中储袋炎疾病活动度指数(pouchitis disease activity index,PDAI)是研究中最为常用的标准,PDAI得分≥7则提示存在储袋炎[24]。见表1。
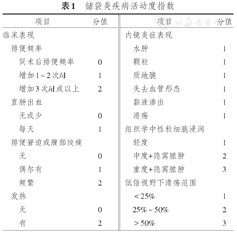
储袋炎疾病活动度指数
储袋炎疾病活动度指数
| 项目 | 分值 | 项目 | 分值 | |||
|---|---|---|---|---|---|---|
| 临床表现 | 内镜炎症表现 | |||||
| 排便频率 | 水肿 | 1 | ||||
| 同术后排便频率 | 0 | 颗粒 | 1 | |||
| 增加1~2次/d | 1 | 质地脆 | 1 | |||
| 增加3次/d或以上 | 2 | 失去血管形态 | 1 | |||
| 直肠出血 | 黏液渗出 | 1 | ||||
| 无或少 | 0 | 溃疡 | 1 | |||
| 每天 | 1 | 组织学中性粒细胞浸润 | ||||
| 排便窘迫或腹部绞痛 | 轻度 | 1 | ||||
| 无 | 0 | 中度+隐窝脓肿 | 2 | |||
| 偶尔有 | 1 | 重度+隐窝脓肿 | 3 | |||
| 频繁 | 2 | 低倍视野下溃疡范围 | ||||
| 发热 | <25% | 1 | ||||
| 无 | 0 | 25% ~ 50% | 2 | |||
| 有 | 2 | >50% | 3 | |||
抗生素是大多数急性特发性储袋炎的有效治疗手段。目前临床一线治疗为口服环丙沙星(500 mg,2次/d)或甲硝唑(500 mg,3次/d)治疗2 ~ 4周。一项小型随机对照试验比较环丙沙星和甲硝唑对急性储袋炎的治疗效果,结果显示环丙沙星降低PDAI的效果更加明显,且其发热、呕吐等不良事件的发生率较甲硝唑更低[25],环丙沙星有望成为储袋炎治疗中最常用的一线药物。长期使用甲硝唑会增加味觉异常和暂时性周围神经病变的风险[26],而长期使用环丙沙星可能会引起关节病、肌腱炎等不良反应[25],其他可能有效的替代药物有利福昔明、替硝唑、阿莫西林克拉维酸钾等,尽管这些抗生素治疗效果仍有待于进一步研究确认,但仍可考虑用于二线治疗或者在一线单药治疗无效时与单药联合使用[27,28,29]。
5% ~ 19%的储袋炎会发展为慢性储袋炎,随着病程的进展,其中一部分储袋炎最终会导致储袋失败[9]。慢性储袋炎的治疗目前仍缺乏高质量的临床证据,对抗生素的反应是影响用药的重要因素,部分患者存在抗生素依赖现象,一旦停用抗生素则很快复发,针对这部分患者应选择延长疗程的低剂量抗生素或交替使用抗生素的治疗方案,以尽量减少抗生素耐药的风险。对于抗生素抵抗的慢性储袋炎,应首先排除继发性因素,在排除继发性因素后,其药物治疗与UC的治疗类似,包括局部或口服5-氨基水杨酸(5-ASA)、局部或口服皮质类固醇以及应用免疫抑制剂和生物制剂等。虽然支持应用5-ASA的证据级别较低,但其药物安全性较高,在抗生素无效的情况下也是值得一试的选择[30]。目前仅有一项小样本研究显示,口服布地奈德9 mg/d对诱导缓解有一定疗效[31]。此外,多项观察性研究和病例报告发现生物制剂对慢性抗生素抵抗型储袋炎具有治疗效果[32,33,34,35]。Huguet等[33]荟萃分析313例使用英夫利西单克隆抗体或阿达木单克隆抗体的储袋炎患者,结果显示这两种抗肿瘤坏死因子(tumor necrosis factor,TNF)-α单克隆抗体(简称"抗TNF-α单抗")治疗慢性储袋炎的短期临床缓解率仅为10%,远期缓解率为37%。而Bär等[34]则发现维多珠单克隆抗体对慢性储袋炎的疗效相对较好,其短期(12周)缓解率达到75%,长期缓解率为74%。生物制剂对慢性储袋炎的疗效仍有待于进一步研究。
高达80%的PSC患者会出现炎症性肠病(inflammatory bowel disease,IBD),且以UC最为常见[36]。合并PSC的UC患者行IPAA后,其储袋相关临床表现较为独特,这部分患者发生储袋炎的风险显著高于普通UC患者[37,38]。储袋镜下可见除了储袋内弥漫性炎症,PSC相关储袋炎还常伴有输入袢一段较长肠管的炎症,因此,对于存在明显储袋前回肠炎症的患者,均应该评估是否存在PSC[37]。此外,PSC相关储袋炎对抗生素治疗的反应普遍较差,但有时局部使用5-ASA有一定效果。另有一些研究显示,口服布地奈德对PSC相关的储袋炎具有一定的疗效。当抗生素治疗效果不佳时,5-ASA和布地奈德可以考虑用于试验性治疗[39]。
部分储袋炎的患者会出现储袋缺血的表现,特别是慢性抗生素抵抗型储袋炎。缺血性储袋炎的发生与术中因素密切相关,包括回肠末段供应血管的张力大、回结肠动脉或肠系膜上动脉供应回肠末段的分支被离断、肠系膜张力大或者肠系膜逆转等,这些因素均可能导致回肠末段的相对缺血缺氧状态[11]。男性肥胖患者和IPAA术后体质量增加过多的患者可能更容易因肠系膜的缩短而出现肠系膜张力增加[11,40]。研究发现,S型储袋发生缺血性储袋炎的概率低于J型储袋,其可能原因是S型储袋的肠系膜张力更小[40]。储袋镜下可通过炎症的不对称分布以及炎症和非炎症部位清晰的边界来识别缺血性储袋炎。内镜下可表现为炎症和溃疡局限于储袋远端并沿缝合线分布,也可表现为炎症和溃疡仅累及一侧储袋而不涉及另一侧[11,40]。一般来说,缺血性储袋炎的症状轻微,有时仅在内镜检查时发现,通常不需要特殊治疗[14]。但对于出现症状的缺血性储袋炎,抗生素治疗效果往往不佳,症状严重的患者可能需要再次手术以重新构建储袋[12,40]。
感染引起的常见储袋炎包括CDI和巨细胞病毒感染(cytomegalovirus,CMV)相关储袋炎。IPAA术后患者中CDI的真实感染率目前仍不清楚,但一项单中心临床研究数据显示,IPAA术后诊断储袋炎的患者中,高达10%的患者CDI呈阳性[41]。反复复发或慢性储袋炎的患者应该考虑是否存在CDI。感染性储袋炎的内镜下表现一般无特异性,仅在极少数的患者中可见到内镜下假膜[41]。CDI相关储袋炎的一线治疗方案是口服万古霉素。此外,粪菌移植(fecal microbiota transplantation,FMT)也可考虑用于难治性CDI相关储袋炎的二线治疗,但与一般人群相比,IPAA术后患者行FMT效果相对较差,疾病的复发率更高,可达40%[42]。CMV感染也可导致储袋炎的发生,免疫抑制剂的使用可能是导致CMV感染的危险因素[43]。CMV感染相关储袋炎的治疗与CMV感染引起的结肠炎类似,可使用缬更昔洛韦或更昔洛韦抗病毒治疗[43]。其他微生物感染可能也会引起储袋炎的发生,如弯曲杆菌、沙门氏菌和念珠菌等,但并不常见[11]。
术前诊断CD是IPAA的禁忌证,因为CD的复发会增加储袋并发症的风险,可能会导致储袋功能障碍、瘘管形成等情况发生,甚至造成储袋失败而需切除储袋[44]。虽然在术前诊断为UC的患者中,术后病理可能会诊断为CD[45],但这种情况极为少见,绝大多数储袋CD是术后数月至数年内新发的[46]。据报道,储袋CD的累计发病率为2.7% ~ 13.0%[45,46]。
储袋CD可分为炎症型、纤维化型和瘘管型,炎症型的临床表现与特异性储袋炎相似,缺乏特异性,而纤维化型和瘘管型又与储袋相关并发症难以鉴别[45]。储袋CD的发病时间是区分储袋CD与储袋相关并发症的关键因素。储袋CD一般出现于IPAA术后6 ~ 12个月,而储袋相关并发症在术后早期就会出现相应症状[44]。储袋镜是诊断储袋CD的关键,在未使用NASIDs的情况下,内镜下出现黏膜溃疡、瘘管和狭窄累及输入袢或储袋前其他部位小肠时,应该考虑储袋CD的可能[47]。组织活检病理出现肉芽肿是储袋CD的特征性表现,但这种典型的表现仅出现在10% ~ 12%的储袋CD患者中[48]。此外,CTE或MRE能够帮助发现储袋近端小肠的病变,并评估其范围和程度,为储袋CD的诊断提供参考[47]。
储袋CD的治疗手段包括药物、内镜治疗和手术治疗。储袋CD的药物治疗与慢性特异性储袋炎类似,包括抗生素、5-ASA、皮质类固醇、免疫抑制剂和生物制剂等。药物的选择在一定程度上取决于储袋CD的类型,瘘管型的治疗常常更为积极[46]。最近的系统性综述表明,抗TNF-α单抗治疗储袋CD的诱导缓解率高达64%[33]。此外,Khan等[49]报道,维多珠单克隆抗体治疗储袋CD的缓解率为66.7%。而另一项回顾性多中心队列研究发现,经乌司奴单克隆抗体治疗6个月后,储袋CD的缓解率为100%[50]。据现有研究结果来看,生物制剂对储袋CD具有较好的疗效,但仍缺乏大样本量的证据支撑。内镜球囊扩张对于狭窄型储袋CD有一定的治疗效果,但需要清楚的是,储袋CD是储袋失败的主要原因之一,当药物和内镜治疗无效或疾病反复复发时,手术切除储袋可能是储袋CD患者的最后选择[45]。
目前IPAA术中储袋肛管的主要吻合方式包括切除肛管移行区(anal transition zone,ATZ)黏膜后手工吻合或者吻合器吻合并保留ATZ。一般来说,吻合器吻合是首选方式,因其操作相对简便且保留ATZ可以改善储袋的功能。但保留ATZ的直肠黏膜,在改善储袋功能的同时也带来封套炎和残余黏膜癌变的风险。封套炎是IPAA术后直肠残余黏膜的UC复发造成的,其症状与储袋炎类似,但出血更为常见。封套炎的诊断需要通过内镜确定直肠残余黏膜的炎症改变以区别储袋炎,但两者又经常同时存在。大部分封套炎对抗生素的治疗无效,但可通过局部应用5-ASA或皮质类固醇治疗得到缓解。对于难治性封套炎,可考虑经肛门黏膜切除术予以治疗。
一般来说,储袋功能障碍多继发于包括储袋炎和吻合口狭窄等储袋相关疾病和并发症,但也有一部分储袋功能障碍的患者未合并炎症或其他并发症。目前其病因仍不明确,可能与手术引起的神经损伤有关,也可能与术后排便次数增加引起的肛门括约肌功能调节不良有关[13]。
储袋排空障碍的临床表现缺乏特异性,可出现腹痛、腹胀、便秘、排便不尽感和排便失禁等表现。临床上作出储袋排空障碍的诊断一般是排除性诊断,虽然肛门直肠测压和球囊排出试验可帮助诊断,但由于IPAA肛门部解剖结构已经发生改变,这两种检测目前没有对应的评价标准,其诊断效果缺乏较高等级的证据支持。此外,钡剂和MR排粪造影也可以为储袋排空障碍的鉴别诊断提供参考信息。目前,生物反馈治疗是储袋排空障碍的主要治疗手段,其有助于患者排便时肛门括约肌和盆底肌肉群保持松弛状态[51]。
总体上,IPAA能够改善UC和FAP患者的生活质量,但同时也可能会发生一些特有的储袋炎性疾病和功能障碍,其临床诊断和治疗也有一定的难度。在熟悉各种不同类型储袋炎性疾病和功能障碍临床表现的基础上,形成全面有序的诊疗思维,有助于对其作出正确的评估、诊断、治疗和监测,这对保护IPAA术后患者的储袋功能、降低储袋失败率及提高患者生活质量至关重要。
所有作者均声明不存在利益冲突



























