
本文报道中山大学附属第六医院收治的1例溃疡性结肠炎(UC)合并多形红斑病例,希望能够丰富临床医生对UC合并皮肤病变的诊治经验。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男性,18岁,因"大便习惯改变1年余,便血伴皮疹2个月"于2019年5月3日入中山大学附属第六医院。患者于2018年5月开始反复左下腹痛,排黄褐色糊状便3 ~ 4次/d,抗感染治疗后症状反复。2019年3月再发腹痛,排暗红色糊状便4 ~ 5次/d,伴双侧肘、膝关节散在皮疹,外院考虑"广泛结肠型溃疡性结肠炎(ulcerative colitis,UC)",予甲基泼尼松龙30 mg qd、美沙拉嗪缓释片1 g qid治疗后腹痛、皮疹均明显好转。2019年4月,患者在甲基泼尼松龙规律减量至12 mg qd后,皮疹、腹痛及血便症状加重,结合当地皮肤活检组织病理检查考虑"变应性小血管炎",每天予注射用甲基泼尼松龙琥珀酸钠(以下简称"甲强龙")40 mg静脉滴注,沙利度胺50 mg qn、美沙拉嗪缓释片1 g qid口服和美沙拉嗪灌肠液60 ml qn灌肠治疗3 d后,患者症状明显缓解。激素由静脉滴注改为口服后,患者再次出现左下腹痛伴四肢皮疹较前明显增多,排暗红色血便7 ~ 8次/d,量中,伴发热,最高达38.5℃,遂转诊至我院进一步治疗。患者自发病以来胃纳差、睡眠可,小便正常,体质量下降约10 kg。既往史、个人史、家族史无特殊。
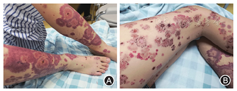
入院后体格检查:体温36.5℃,脉搏73次/min,呼吸20次/min,血压99/62 mmHg(1 mmHg = 0.133 kPa),患者腰臀部及四肢皮肤可见大量类圆形及不规则片状红斑,直径为1~7 cm不等,部分融合,伴水泡样改变(图1A)。腹软,左下腹有压痛,轻度反跳痛,肝脾肋下未触及,移动性浊音(-),肠鸣音正常。

实验室检查:血红蛋白95 g/L,白细胞计数11.5 × 109/L,中性粒细胞比例91.1% ,血小板计数344 × 109/L;大便常规:白细胞(++),红细胞(+++),尿常规未见异常,肝肾功能、电解质、肿瘤相关标志物均在正常范围,白蛋白29.9 g/L,红细胞沉降率45 mm/ 1 h,C-反应蛋白80.1 mg/L,D-二聚体8.0 μg/ml,cANCA(+),抗核抗体、抗双链DNA抗体、T淋巴细胞斑点实验、结核菌素试验、巨细胞感染、EB病毒感染指标均为阴性。
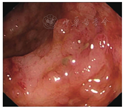
结肠镜检查提示:横结肠至直肠全程黏膜连续性充血红肿,伴糜烂及浅溃疡,血管纹理消失,黏膜脆性增加,可见自发性渗血(Mayo内镜评分为3分),见图2。活检组织病理检查提示乙状结肠黏膜内见淋巴细胞、浆细胞及散在中性粒细胞浸润,炎症分布不均匀,隐窝未见明显分支变形,病变倾向于UC治疗后。全腹盆腔CT提示:乙状结肠及直肠肠壁稍增厚并系膜多发轻度肿大淋巴结。

患者入院后初步诊断:(1)UC(慢性复发型,广泛结肠型,重度活动期);(2)皮疹原因未明,UC合并肠外皮肤表现可能。患者首先继续接受静脉滴注甲强龙60 mg qd、美沙拉嗪缓释片1 g qid、美沙拉嗪灌肠液60 ml qn灌肠及其他支持治疗。患者症状较前缓解,每天排4 ~ 5次血便,血量较前减少,但皮疹范围较前扩大,消退的皮疹边缘有新发的小环状红斑,伴有大疱或水泡形成(图1B),再次行皮肤活检。皮肤科会诊意见考虑UC合并大疱性皮肤病可能,建议暂予每天甲强龙250 mg静脉滴注。治疗3 d后,患者皮疹明显消退。
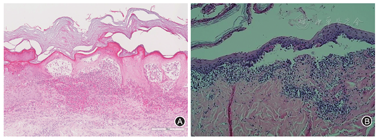
皮肤组织活检病理结果:外院会诊右踝关节皮肤活检切片,提示被覆鳞状上皮轻度增生,伴角化过度及角化不全,局部棘层水肿,伴表皮内及表皮下水疱形成,水疱、真皮层血管及血管壁见中性粒细胞浸润及核碎裂(图3A)。本院皮肤活检提示陈旧性表皮内水疱形成伴局部表皮下裂隙,疱顶表皮坏死,疱底表皮轻度增生伴局部基底细胞轻度空泡变性,真皮乳头血管扩张伴红细胞外溢,浅中层血管周围淋巴细胞、中性粒细胞及少许嗜酸性粒细胞浸润(图3B);直接免疫荧光:免疫球蛋白(IgA、IgG、IgM)、补体(C3)及纤维蛋白均为阴性。

综合两次皮肤组织活检病理结果,考虑患者皮肤病变为多形红斑可能性大。患者后续接受甲强龙逐渐减量至口服40 mg qd治疗并出院。患者出院时每天排1次黄色成形软便,无腹痛、发热,皮疹较前明显消退。随访期间,患者口服激素规律减量后,继续美沙拉嗪口服及灌肠维持治疗,每天排1次黄色成形大便,无腹痛、发热,原皮疹消退,仅残留色素沉着。随访至2020年5月,未再有新发皮疹。
炎症性肠病(inflammatory bowel disease,IBD)以肠道病变为主,但也可出现其他器官的肠外表现(extra-intestinal manifestations,EIM)[1]。既往研究表明,皮肤病变占IBD肠外表现的44.4%,与IBD原发病相关的皮肤病变发生率为14.9%[2]。结节性红斑是UC最常见的肠外皮肤表现,临床典型表现为双侧胫骨前区对称性的结节性红斑,出现压痛、红斑、温热、圆形或椭圆形的皮下结节(1 ~ 5 cm)[3],晚期病灶会变成瘀伤样外观,被称为挫伤红斑,是结节性红斑的特异性表现[4,5,6,7]。不同于结节性红斑,多形红斑是UC少见的皮肤病变[8]。其典型病变称为靶点或虹膜病变,多呈圆形,由3个同心圆组成:深色中心的外周包绕着呈浅粉色的环状病变,最外层为红色的环状病变。非典型病变可能只有两个色带,边界可不清晰[9]。病变最初对称地出现在四肢,特别是伸肌表面。病变通常向中心扩散,但患者躯干上的病变往往较少见[10,11]。
本例患者的皮肤病变诊断主要基于其皮肤病变形态、皮肤病理的改变。其中两次病理分别可见到变应性血管炎与多形红斑相对特异的病理表现。通过查阅文献可知变应性血管炎与多形红斑均为免疫相关的皮肤病变,均可以见于UC的肠外表现,其治疗原则均为以激素为主的免疫抑制治疗[12]。对于该患者,笔者除考虑其为UC的肠外表现,还需要考虑到其他可能如原发皮肤病合并肠道病变、血管炎同时累及肠道皮肤疾病[13]、UC基础上合并皮肤原发疾病和UC基础上合并药物诱发的皮肤急性免疫反应[14]等。
通过随访,在肠道病变控制稳定的情况下,笔者未针对皮肤病变进行维持治疗,患者也未再有类似皮疹的出现,故最终认为其仍为UC的肠外皮肤表现可能性最大。综合病理结果,考虑为UC合并多形红斑。随访中患者曾出现肠道炎症复发,但未见皮疹病变。根据上述皮肤病变表现,考虑该类型皮肤改变与肠道病变并不平行。
大多数肠外皮肤病变与肠道疾病活动有关,多形红斑的治疗取决于潜在的病因和疾病的严重程度[9]。因此,如果必须开始治疗,首要目标应该是控制潜在的肠道疾病活动。其次,支持性治疗可选择抬高腿部、使用止痛剂和碘化钾、穿着压缩长袜等[15,16]。病情严重时全身应用皮质类固醇[0.5 ~ 1.0 mg/(kg·d)]是一线治疗方法[12]。此外,一些病例报告显示英夫利西单克隆抗体和阿达木单克隆抗体等生物制剂对重症病变治疗有益[17,18]。目前对于IBD合并肠外皮肤病变的机制也尚不明确,有学者认为肠黏膜上的肠道细菌和滑液等可能通过共同抗原表位触发免疫反应,而被触发的免疫应答不能区分细菌和皮肤的抗原表位,导致皮肤发生病变[19]。相信随着IBD合并肠外表现机制的进一步阐明,将来的治疗必然会过渡到以分子靶点为基础的精准治疗。
所有作者均声明不存在利益冲突



























