
比较酪蛋白、乳清蛋白和大豆蛋白型膳食对结肠炎小鼠的影响。
50只C57BL/6小鼠随机分为5组,分别为空白对照组、一般饮食组、乳清蛋白组、大豆蛋白组及酪蛋白组,每组10只。以4种不同蛋白种类的纯化膳食连续喂养小鼠14 d,除空白对照组以外,其余4组在实验的第7天以葡聚糖硫酸钠(DSS)诱导急性结肠炎。期间观察并记录各组小鼠的疾病活动度评分。第14天取各组小鼠血清及结肠组织,以ELISA法检测血清和结肠组织的IL-6、TNF-α和IL-10水平,并计算结肠病理评分。
乳清蛋白组疾病活动度评分明显低于酪蛋白组和大豆蛋白组(P<0.05),高于空白对照组(P<0.05)。空白对照组的结肠病理评分平均低于其余4组(P均<0.05)。乳清蛋白组结肠组织病理评分低于酪蛋白和大豆蛋白组(P<0.05),与一般饮食组无显著差异。乳清蛋白组血清IL-6和TNF-α水平明显低于酪蛋白和大豆蛋白组(P<0.05),IL-10水平明显高于一般饮食、酪蛋白及大豆蛋白组(P<0.05),结肠IL-10水平明显高于酪蛋白组和大豆蛋白组(P<0.05)。
乳清蛋白型膳食用以缓解小鼠急性结肠炎的治疗效果明显优于一般饮食、酪蛋白及大豆蛋白型膳食。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
80%的炎症性肠病(inflammatory bowel disease,IBD)患者存在营养不良[1]。肠内营养(enteral nutrition,EN)治疗可诱导IBD临床缓解。既往研究发现不同类型的EN制剂在治疗IBD的效果上存在一定差异,有研究提示酪蛋白饮食可加重结肠炎小鼠肠道炎症[2,3,4,5]。因此,选择合适的EN制剂对治疗IBD至关重要。为比较不同类型的EN制剂治疗IBD的效果,本研究构建了乳清蛋白、酪蛋白和大豆蛋白3种自定义的小鼠膳食配方(compositionally defined diets,CDD),比较不同蛋白种类膳食对结急性结肠炎小鼠的治疗效果。
本实验采用50只雄性C57BL/6小鼠,周龄为8~12周,体质量为18~22 g,由南京大学模式动物研究所提供[动物合格证号:SCXK(苏)2016-0010]。小鼠饲养于SPF环境中,每笼10只,自由摄食饮水,饲养温度为(20 ± 2)℃,湿度约50%,光照时间为12 h/d。小鼠垫料更换频率为2次/周。
葡聚糖硫酸钠(加拿大Biomedicals公司),4%多聚甲醛固定液(中国碧云天公司),磷酸盐缓冲液(中国碧云天公司),无水乙醇(中国碧云天公司),苏木素-伊红染色液(北京博尔迈生物公司),蛋白裂解液RIPA(美国Sigma公司),蛋白酶抑制剂(美国Thermo Fisher),TNF alpha Mouse Uncoated ELISA Kit(苏州赛默飞生物),Mouse IL-6 Uncoated ELISA(苏州赛默飞生物),Mouse IL-10 ELISA Kit(杭州联科生物)。
按照完全随机原则将小鼠分为空白对照组、一般饮食组、乳清蛋白组、大豆蛋白组及酪蛋白组,每组10只。所有小鼠在造模前7 d均自由摄取正常水。在实验的第7天,将葡聚糖硫酸钠(dextran sulfate sodium,DSS)固体加至双蒸水中配制成2.5%DSS溶液。一般饮食组、乳清蛋白组、大豆蛋白组及酪蛋白组将正常水更换为2.5%DSS溶液,以诱导急性结肠炎模型。每隔3 d更换一次DSS溶液,空白对照组仍以正常水和一般饮食喂养。
本研究中所用的纯化膳食皆由江苏省协同医药生物工程有限责任公司提供,其中分离乳清蛋白粉剂由青岛纽特舒玛健康科技有限公司提供。3种不同蛋白种类膳食分别为由乳清蛋白、大豆蛋白和酪蛋白占成份比例为21.5%。脂肪来源均为玉米油,成份比例为12.5%;碳水化合物来源均为蔗糖、麦芽糖糊精和玉米淀粉,成份比例为66%;膳食纤维的为纤维素,成份比例为5%。每种纯化膳食中均添加了含量相同的矿物质混合物、碳酸钙、碳酸氢钙、维生素混合物及胆盐以满足小鼠正常生理需要。一般饮食组喂养小鼠日常所使用的饲料,由江苏省协同医药生物工程有限公司提供,蛋白来源为动植物蛋白混合物,成份比例接近各半。
实验前称取小鼠体质量,造模开始后,记录每组小鼠的疾病活动度评分(disease activity index,DAI)[6],标准如下:体质量下降<1%、1~5%、6~10%、11~18%和>18%分别记0、1、2、3和4分;粪便性状正常、软化但成形、软且不成形、腹泻稀便和水样腹泻分别记0、1、2、3和4分;无便血、轻度、重度、血便和肛门出血分别记0、1、2、3和4分;将上述3个部分评分分值相加,为每只小鼠的DAI评分。
(1)血清提取:在模型成功建立后的第14天用戊巴比妥钠麻醉小鼠,摘取小鼠眼球,将血液置于预备有分离胶的生化采血管中,静置30 min后放入高速离心机,以3500 r/min高速离心15 min(离心半径13.5 cm)。离心结束后取200 μl上清液置于EP管中,再放入-80℃冰箱中保存。(2)结肠组织提取:用手术刀依层次剪开皮肤、皮下,见腹白线后打开腹腔,在回盲部及肛门口处离断肠道,提取整段结肠。随后用组织剪分离附着于肠管周围的肠系膜、脂肪、网膜及结缔组织,保持肠管完整性,注意避免伤及肠道浆膜层。随后将分离好的肠管放至0.9%氯化钠溶液中小心清洗,去除肠管上的血渍,用剪刀将组织剪碎后放入超声波破碎仪中打碎,置于-80℃冰箱中保存。
将待检测的血清及结肠组织样品从-80℃冰箱中取出,置于精密天平上称量,放入离心管中,加入9倍体积的RIPA,再放入超声波细胞破碎仪中破碎组织。待破碎后组织外观颜色呈清亮无杂质后,以IL-6、TNF-α、IL-10 ELISA试剂盒检测。样品经过包被抗体、封闭、洗涤、加样温育、加酶标抗体、酶结合物及显色等步骤后,终止反应。样品浓度计算:在酶标仪450 nm处以空白对照孔吸光度A值为0,检测出各孔A值,根据标准品的浓度及A值做出标准曲线,再以标准曲线方程计算出样品浓度。
由黏膜层和固有层损伤评分二者相加而得,结肠黏膜结构正常完整、孤立灶损伤或缺损、出现糜烂和溃疡和结构严重变形、大部缺失分别记为0、1、2和3分。固有层无中性粒细胞浸润、有少量中性粒细胞浸润、聚集中等量炎性细胞和浸润大量炎性细胞分别记为0、1、2和3分。
采用Graphpad Prism7进行分析,符合正态分布的连续型变量以(Mean±SD)表示,组间比较采用独立样本t检验,P≤0.05为差异有统计学意义。
乳清蛋白组DAI评分明显低于酪蛋白组和大豆蛋白组,高于空白对照组,差异均有统计学意义(P均<0.05)。大豆蛋白组DAI评分亦高于一般饮食组(P<0.05)。
乳清蛋白组、酪蛋白组、大豆蛋白组及一般饮食组的结肠病理评分均高于空白对照组(P均<0.05)。乳清蛋白组结肠组织病理评分显著低于酪蛋白和大豆蛋白组(P均<0.05)。各组小鼠DAI和结肠组织病理评分见表1。
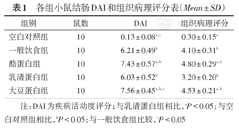
各组小鼠结肠DAI和组织病理评分表(Mean±SD)
各组小鼠结肠DAI和组织病理评分表(Mean±SD)
| 组别 | 鼠数 | DAI | 组织病理评分 |
|---|---|---|---|
| 空白对照组 | 10 | 0.13 ± 0.08a,c | 0.30 ± 0.15a |
| 一般饮食组 | 10 | 6.21 ± 0.49b | 4.10 ± 0.31b |
| 酪蛋白组 | 10 | 7.43 ± 0.57a,b | 4.80 ± 0.29a,b |
| 乳清蛋白组 | 10 | 6.03 ± 0.52b | 3.20 ± 0.20b |
| 大豆蛋白组 | 10 | 7.56 ± 0.45a,b,c | 4.53 ± 0.21a,b |
注:DAI为疾病活动度评分;与乳清蛋白组相比,aP<0.05;与空白对照组相比,bP<0.05;与一般饮食组比较,cP<0.05
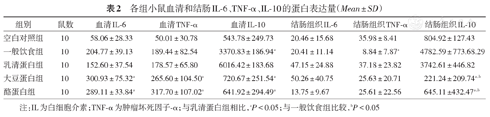
各组小鼠血清和结肠IL-6、TNF-α、IL-10的蛋白表达量(Mean±SD)
各组小鼠血清和结肠IL-6、TNF-α、IL-10的蛋白表达量(Mean±SD)
| 组别 | 鼠数血清IL-6 | 血清TNF-α | 血清IL-10 | 结肠组织IL-6 | 结肠组织TNF-α | 结肠组织IL-10 |
|---|---|---|---|---|---|---|
| 空白对照组 | 1058.06 ± 28.33 | 50.01 ± 30.78 | 543.78 ± 249.73 | 20.46 ± 15.68 | 35.98 ± 8.41 | 804.92 ± 127.43 |
| 一般饮食组 | 10204.77 ± 39.13 | 189.44 ± 82.54 | 3370.83 ± 186.94a | 20.41 ± 11.14 | 8.84 ± 7.87a | 4782.59 ± 773.68.29 |
| 乳清蛋白组 | 10152.60 ± 37.54 | 178.57 ± 65.80 | 6016.42 ± 183.68 | 47.15 ± 24.88 | 37.18 ± 23.82 | 3742.61 ± 446.82 |
| 大豆蛋白组 | 10300.93 ± 75.32a | 265.60 ± 104.50a | 720.67 ± 251.54a | 50.26 ± 40.75 | 25.63 ± 20.71 | 221.24 ± 209.74a,b |
| 酪蛋白组 | 10289.11 ± 33.84a | 317.70 ± 107.02a | 641.92 ± 294.49a | 13.75 ± 9.67 | 25.61 ± 22.56 | 645.11 ±432.47a,b |
注:IL为白细胞介素;TNF-α为肿瘤坏死因子-α;与乳清蛋白组相比,aP<0.05;与一般饮食组比较,bP<0.05
乳清蛋白组血清IL-6、TNF-α水平均低于酪蛋白组和大豆蛋白组,血清IL-10水平高于酪蛋白组、大豆蛋白组及一般饮食组(P均<0.05)。其余组间比较,差异无统计学意义。
乳清蛋白组结肠组织IL-6水平与其他各组相比,差异均无统计学意义。乳清蛋白组的结肠组织TNF-α水平却高于一般饮食组(P=0.013),IL-10水平明显高于大豆蛋白组(P=0.029)和酪蛋白组(P=0.040)。一般饮食组结肠IL-10水平高于大豆蛋白组(P=0.027)和酪蛋白组(P=0.016)。
IBD患者因存在肠道慢性持续性炎症及饮食中存在过敏原,可促使肠道免疫发生异常[7]。EN不仅对IBD患者提供营养支持,亦可维持炎症缓解,其作用与营养制剂中主要营养物质有关[8]。临床治疗中亦发现不同蛋白来源的EN在纠正营养不良、降低炎症及改善免疫紊乱上确有差异[9,10]。
本研究发现乳清蛋白膳食在对抗急性结肠炎所致的体质量丢失方面优于酪蛋白、大豆蛋白及一般饮食,且DAI评分及结肠病理评分也较其他组更低。既往研究发现乳清蛋白制剂可改善因脓毒症导致的肠缺血再灌注损伤,增加肠屏障蛋白表达[11]。乳清蛋白含有半胱氨酸和蛋氨酸,可抑制机体氧化应激,同时可改善肠道致病菌群相对丰度,因此保护了肠屏障。酪蛋白和大豆蛋白缺少蛋氨酸和甲硫氨酸,吸收率低,无法被机体所摄取和参与机体组织合成与生物转化[12]。
既往研究发现酪蛋白饮食通过增加肠道中拟杆菌相对丰度,减少厚壁菌丰度,导致肠道菌群紊乱,加重小鼠急性结肠炎,且结肠炎小鼠结肠组织核转录因子NF-κBα、NF-κBβ及NF-κBγ 3种亚型蛋白含量升高,同时IL-6和TNF-α表达量也随之明显升高[5,13]。在喂养了酪蛋白及大豆蛋白饮食后的结肠炎小鼠肠道中也发现了肠屏障蛋白ZO-1、Occludins和Claudins表达显著降低[14]。当机体处于炎症状态时,位于细胞质中处于抑制状态的NF-κB与IκB结合进入细胞核发挥其转录作用,胞核中NF-κB通路激活后,转录因子合成大量IL-6和TNF-α等炎性因子并进入外周循环中,加重炎症。内源性和外源性损伤分子通过损伤的肠屏障进入固有层,致使中性粒细胞迁移、巨噬细胞极化及固有免疫激活,释放炎性因子,造成肠道上皮细胞大量死亡,而死亡的上皮细胞亦可释放大量内源性损伤分子,造成恶性循环[15,16]。
本研究存在局限性,首先,研究未能比较各组小鼠结肠长度。其次,未能深入探讨其改善肠炎的具体机制。最后,本研究仅在动物层面证实,未在临床上进一步确认,需进一步研究。
所有作者均声明无利益冲突



























