
探讨结肠型克罗恩病(CD)与溃疡性结肠炎(UC)的临床及影像特征差异。
回顾性纳入2013年1月至2020年7月中山大学附属第六医院收治的40例结肠型CD与40例UC患者,所有患者均行CT肠道造影检查,且临床资料完整。比较两组患者临床特征及CT特征的差异,并将差异有统计学意义(P<0.05)的特征纳入到二元Logistic回归模型中,筛选可诊断结肠型CD的预测因子。
结肠型CD和UC患者在发病年龄[(29.3 ± 10.7)岁比(46.6 ± 13.4)岁,P<0.001]、体质指数[(18.4 ± 2.7) kg/m2比(21.0 ± 4.0) kg/m2,P = 0.001]、出现血便症状的比例(47.5%比90.0%,P<0.001),差异均有统计学意义。结肠型CD较UC更易出现升结肠受累(70.0%比20.0%,P<0.001)。UC患者比结肠型CD患者更常出现病变连续性分布(80.0%比57.5%,P = 0.03)及肠壁环周均匀性增厚(77.5%比47.5%,P = 0.006),更少见肠周炎性渗出(20.0%比67.5%,P<0.001)及肛瘘(10.0%比57.5%,P<0.001)。结肠型CD患者更多表现为不同部位严重程度不一致(75.0%比45.0%,P = 0.006),肠壁厚度多高于UC患者[(9.5 ± 3.4) mm比(8.1 ± 2.2) mm,P = 0.024]。多因素回归模型显示,升结肠受累(OR = 9.209,95%CI:2.238 ~ 37.902,P = 0.002)、肠周炎性渗出(OR = 9.861,95%CI:2.384 ~ 40.786,P = 0.002)及肛瘘(OR=19.263,95%CI:3.714 ~ 99.905,P<0.001)是诊断结肠型CD的独立预测因子。
综合CT特征与患者的临床表现,可在一定程度上鉴别结肠型CD与UC,为临床进一步的治疗决策提供重要的参考价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
炎症性肠病(inflammatory bowel disease,IBD)包括克罗恩病(Crohn′s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC),是一种累及消化道的慢性复发性炎性疾病,其发病机制尚未明确,在欧美等国家发病率较高,在我国的发病率也呈逐年上升趋势[1,2]。CD根据病变发生部位可分为多个亚型,其中结肠型CD(colonic Crohn′s disease)占所有患者的15% ~ 25%[2,3,4]。结肠型CD与UC的临床治疗方案存在差异,准确的鉴别两者具有重要的临床意义。然而,两者在临床症状、影像学特征、内镜下表现具有一定的重叠或相似之处,基于内镜下病理活检有时也不能明确的予以鉴别,约14%的患者可能在肠段切除或长期随访后修正最初的诊断[5,6]。目前,国内对于结肠型CD这一亚型的研究尚少,结肠型CD与UC的影像学差异尚未检索到相关的报道。我们旨在探索结肠型CD与UC的临床及影像学特征的差异,希望有助提高医师们对结肠型CD的认识,进一步改善IBD相关结直肠炎的诊断水平,从而为临床制订治疗策略提供参考,使患者获益。
本研究采用回顾性横断面研究方法,纳入2013年1月至2020年7月中山大学附属第六医院经临床、影像、病理综合诊断为结肠型CD或UC的患者共80例。纳入标准:(1)根据2018年中华医学会消化病学分会制定的炎症性肠病诊断共识意见[1]确诊为结肠型CD或UC;(2)疾病活动期行腹部CT肠道造影(CT enterography,CTE)检查;(3)患者临床、内镜及实验室资料完整;(4)我院初诊患者,既往无腹部肠管切除史。排除标准:(1)依据蒙特利尔分型诊断为上消化道型、回肠型或回结肠型CD[7];(2)疾病缓解期患者;(3)CTE图像质量不佳,肠管充盈差,评估受限者。本研究经中山大学附属第六医院伦理委员会批准(批件编号:L2020ZSLYEC-222)。
由1名医师在数字化电子病历系统中查询并记录患者临床资料,包括腹痛、腹泻、黏液便、血便、呕吐、消瘦症状,记录患者体质指数(body mass index,BMI),实验室检查包括C-反应蛋白(C-reactive protein,CRP)、红细胞沉降率(erythrocyte sedimentation rate,ESR)。
患者需禁食6 h以上,检查前45 ~ 60 min口服2.5%甘露醇溶液1500 ~ 2000 ml,根据患者耐受情况检查前予以结肠温水保留灌肠。扫描前10 ~ 15 min肌肉注射盐酸消旋山崀菪碱10 mg抑制肠道蠕动。患者取仰卧位,采用佳能Aquilion one 640螺旋CT扫描仪,扫描范围自膈顶至耻骨联合。扫描期相包括平扫、肠期、静脉期3期,其中肠期为动脉监测点(肾动脉水平处的腹主动脉)触发峰值150 ~ 220 HU后延迟14 s扫描[8]。扫描参数:管电压100 ~ 120 kV,管电流采用智能毫安,扫描速度0.5 s/转,螺距0.813,层厚、层间距分别为1 mm、1 mm。对比剂为优维显370(Ultravist 370,德国Schering),采用高压注射器静脉团注,注射速率3.0 ~ 4.0 ml/s,注射总量为1.3 ~ 1.5 ml/kg,注射对比剂前后相同注射速率分别注入生理盐水30 ml。
2名胃肠道影像诊断医师在对临床及疾病分类不知情的情况下进行影像学评估,连续变量资料采用2名医师测量的均值,分类变量由2名医师独立评估,结果不一致时由另1名高年资医师参与讨论后确定。评估影像学参数如下:(1)病变部位:将肠管分为6个部位评估,分别是盲肠、升结肠、横结肠、降结肠、乙状结肠、直肠;(2)病变肠管连续性:当病变之间无正常肠管时为连续性分布,反之为节段性分布;(3)肠壁增厚方式:环周均匀性增厚或不对称性增厚;(4)肠壁厚度:测量病变最严重处厚度;(5)肠壁强化方式:黏膜层伴或不伴有肌层强化,且黏膜下层无强化,即分层强化;肠壁全层均匀或不均匀强化,即非分层强化;(6)肠壁强化程度:分别评估肠期和静脉期肠壁强化程度,CT增强绝对值增加10 ~ 30 HU,即轻度强化;CT增强绝对值增加30 ~ 50 HU,即中度强化;CT增强绝对值增加50 HU以上,即明显强化;(7)铅管征:结肠袋消失、变浅,肠壁僵直;(8)肠腔息肉:肠壁黏膜面凹凸不平,腔内呈多发小结节状隆起;(9)不同部位病变严重程度:受累肠管不同部位之间严重程度是否一致;(10)梳样征:肠周血管明显增多、增粗,呈梳齿状排列;(11)脂肪爬行征:肠周脂肪增多、增厚,增生的脂肪可对邻近肠管推压;(12)肠周炎性渗出:病变肠周模糊,出现非液性密度增高影;(13)淋巴结肿大:表现为肠周淋巴结短径在5 mm之上;(14)淋巴结短径:测量最大的淋巴结短径;(15)腹水:腹腔出现游离液性密度影;(16)肛瘘:肛管或肛周出现管状或腔样强化灶。
比较结肠型CD与UC患者临床及影像特征的差异,并筛选可诊断结肠型CD的预测因子。
应用SPSS 26.0统计软件进行数据处理和分析。计数资料结果以频数和百分比表示,采用交叉表χ2检验。计量资料用Kolmogorov-Smirnov检验数据是否符合正态分布,符合正态分布采用(Mean ±SD)表示,偏态分布采用M(P25,P75)表示,依据数据的正态性采用独立样本t检验或Mann-WhitneyU检验,P值<0.05认为差异具有统计学意义。将差异具有统计学意义的影像特征输入到二元Logistic回归模型,其中计量资料根据ROC曲线截取最大Youden指数转换为二分类变量分析,采用向前步进条件法用于筛选可诊断结肠型CD的预测因子。
40例结肠型CD患者中,男性23例、女性17例,发病年龄(29.3 ± 10.7)岁,BMI(18.4 ± 2.7) kg/m2,出现腹痛30例、腹泻36例、黏液便20例、血便19例、呕吐1例、消瘦18例。40例UC患者中,男性19例、女性21例,发病年龄(46.6 ± 13.4)岁,BMI(21.0 ± 4.0) kg/m2,出现腹痛26例、腹泻38例、黏液便28例、血便36例、呕吐2例、消瘦14例。结肠型CD与UC患者在发病年龄、BMI、出现血便比例差异有统计学意义,CRP与ESR差异无统计学意义,见表1。
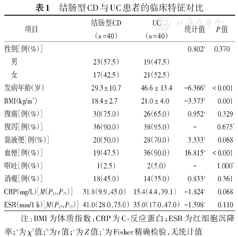
结肠型CD与UC患者的临床特征对比
结肠型CD与UC患者的临床特征对比
| 项目 | 结肠型CD(n = 40) | UC(n = 40) | 统计值 | P值 | |
|---|---|---|---|---|---|
| 性别[例(%)] | 0.802a | 0.370 | |||
| 男 | 23(57.5) | 19(47.5) | |||
| 女 | 17(42.5) | 21(52.5) | |||
| 发病年龄(岁) | 29.3 ± 10.7 | 46.6 ± 13.4 | -6.366b | <0.001 | |
| BMI(kg/m2) | 18.4 ± 2.7 | 21.0 ± 4.0 | -3.373b | 0.001 | |
| 腹痛[例(%)] | 30(75.0) | 26(65.0) | 0.952a | 0.329 | |
| 腹泻[例(%)] | 36(90.0) | 38(95.0) | - | 0.675* | |
| 黏液便[例(%)] | 20(50.0) | 28(70.0) | 3.333a | 0.068 | |
| 血便[例(%)] | 19(47.5) | 36(90.0) | 16.815a | <0.001 | |
| 呕吐[例(%)] | 1(2.5) | 2(5.0) | - | 1.000* | |
| 消瘦[例(%)] | 18(45.0) | 14(35.0) | 0.833a | 0.361 | |
| CRP(mg/L)[M(P25,P75)] | 31.8(9.9,45.0) | 15.4(4.4,39.1) | -1.824c | 0.068 | |
| ESR(mm/1 h)[M(P25,P75)] | 41.0(28.0,75.0) | 35.0(17.0,47.0) | -1.598c | 0.110 | |
注:BMI为体质指数;CRP为C-反应蛋白;ESR为红细胞沉降率;a为χ2值;b为t值;c为Z值;*为Fisher精确检验,无统计值
结肠型CD患者中,病变多累及降结肠(85.0%)、横结肠(80.0%)、乙状结肠(77.5%)和升结肠(70.0%);UC患者中,病变多累及乙状结肠(92.5%)、降结肠(77.5%)和直肠(72.5%),升结肠受累在两组患者中差异具有统计学意义。两组患者在累及结直肠部位数量上差异无统计学意义,见表2。
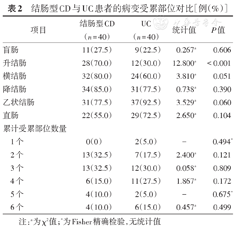
结肠型CD与UC患者的病变受累部位对比[例(%)]
结肠型CD与UC患者的病变受累部位对比[例(%)]
| 项目 | 结肠型CD(n = 40) | UC(n = 40) | 统计值 | P值 | |
|---|---|---|---|---|---|
| 盲肠 | 11(27.5) | 9(22.5) | 0.267a | 0.606 | |
| 升结肠 | 28(70.0) | 12(30.0) | 12.800a | <0.001 | |
| 横结肠 | 32(80.0) | 24(60.0) | 3.810a | 0.051 | |
| 降结肠 | 34(85.0) | 31(77.5) | 0.738a | 0.390 | |
| 乙状结肠 | 31(77.5) | 37(92.5) | 3.529a | 0.060 | |
| 直肠 | 22(55.0) | 29(72.5) | 2.650a | 0.104 | |
| 累计受累部位数量 | |||||
| 1个 | 0(0) | 2(5.0) | - | 0.494* | |
| 2个 | 13(32.5) | 7(17.5) | 2.400a | 0.121 | |
| 3个 | 13(32.5) | 12(30.0) | 0.058a | 0.809 | |
| 4个 | 6(15.0) | 11(27.5) | 1.867a | 0.172 | |
| 5个 | 4(10.0) | 2(5.0) | - | 0.675* | |
| 6个 | 4(10.0) | 6(15.0) | 0.457a | 0.499 | |
注:a为χ2值;*为Fisher精确检验,无统计值
与结肠型CD相比,UC患者的病变更多表现为连续性分布(80%比57.5%,P = 0.03)、肠壁呈环周均匀性增厚(77.5%比47.5%,P = 0.006),较少出现肠周炎性渗出(20.0%比67.5%,P<0.001)及肛瘘(10.0%比57.5%,P<0.001),差异均有统计学意义。结肠型CD病变肠壁厚度大于UC患者[(9.5 ± 3.4) mm比(8.1 ± 2.2) mm,P = 0.024],更多表现为不同部位的严重程度不一致(75.0%比45.0%,P = 0.006),差异均有统计学意义,见图1,图2,图3,图4。两组患者其余影像学特征差异无统计学意义(P均>0.05)。见表3。
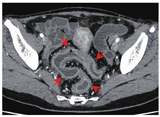

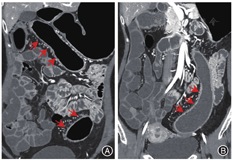

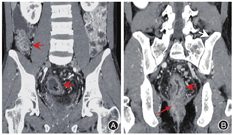

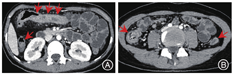

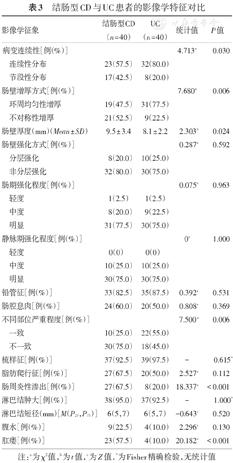
结肠型CD与UC患者的影像学特征对比
结肠型CD与UC患者的影像学特征对比
| 影像学征象 | 结肠型CD(n = 40) | UC(n = 40) | 统计值 | P值 | |
|---|---|---|---|---|---|
| 病变连续性[例(%)] | 4.713a | 0.030 | |||
| 连续性分布 | 23(57.5) | 32(80.0) | |||
| 节段性分布 | 17(42.5) | 8(20.0) | |||
| 肠壁增厚方式[例(%)] | 7.680a | 0.006 | |||
| 环周均匀性增厚 | 19(47.5) | 31(77.5) | |||
| 不对称性增厚 | 21(52.5) | 9(22.5) | |||
| 肠壁厚度(mm)(Mean ± SD) | 9.5 ± 3.4 | 8.1 ± 2.2 | 2.303b | 0.024 | |
| 肠壁强化方式[例(%)] | 0.287a | 0.592 | |||
| 分层强化 | 8(20.0) | 10(25.0) | |||
| 非分层强化 | 32(80.0) | 30(75.0) | |||
| 肠期强化程度[例(%)] | 0.075a | 0.963 | |||
| 轻度 | 1(2.5) | 1(2.5) | |||
| 中度 | 8(20.0) | 9(22.5) | |||
| 明显 | 31(77.5) | 30(75.0) | |||
| 静脉期强化程度[例(%)] | 0a | 1.000 | |||
| 轻度 | 0(0) | 0(0) | |||
| 中度 | 10(25.0) | 10(25.0) | |||
| 明显 | 30(75.0) | 30(75.0) | |||
| 铅管征[例(%)] | 33(82.5) | 35(87.5) | 0.392a | 0.531 | |
| 肠腔息肉[例(%)] | 24(60.0) | 20(50.0) | 0.808a | 0.369 | |
| 不同部位严重程度[例(%)] | 7.500a | 0.006 | |||
| 一致 | 10(25.0) | 22(55.0) | |||
| 不一致 | 30(75.0) | 18(45.0) | |||
| 梳样征[例(%)] | 37(92.5) | 39(97.5) | - | 0.615* | |
| 脂肪爬行征[例(%)] | 27(67.5) | 20(50.0) | 2.527a | 0.112 | |
| 肠周炎性渗出[例(%)] | 27(67.5) | 8(20.0) | 18.337a | <0.001 | |
| 淋巴结肿大[例(%)] | 38(95.0) | 37(92.5) | - | 1.000* | |
| 淋巴结短径(mm)[M(P25,P75)] | 6(5,7) | 6(5,7) | -0.643c | 0.520 | |
| 腹水[例(%)] | 9(22.5) | 4(10.0) | 2.296a | 0.130 | |
| 肛瘘[例(%)] | 23(57.5) | 4(10.0) | 20.182a | <0.001 | |
注:a为χ2值,b为t值,c为Z值,*为Fisher精确检验,无统计值
根据ROC曲线,将肠壁厚度截取最大Youden指数,其临界值为11 mm,转换为二分类变量分析。上述差异具有统计学意义的影像学变量纳入二元Logistic回归模型中,模型显示升结肠受累(OR = 9.209,95%CI:2.238 ~ 37.902,P = 0.002)、肠周炎性渗出(OR = 9.861,95%CI:2.384 ~ 40.786,P = 0.002)、肛瘘(OR=19.263,95%CI:3.714 ~ 99.905,P<0.001)可作为诊断结肠型CD的有效预测因子,见表4。
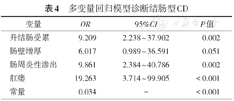
多变量回归模型诊断结肠型CD
多变量回归模型诊断结肠型CD
| 变量 | OR | 95%CI | P值 |
|---|---|---|---|
| 升结肠受累 | 9.209 | 2.238 ~ 37.902 | 0.002 |
| 肠壁增厚 | 6.017 | 0.989 ~ 36.591 | 0.051 |
| 肠周炎性渗出 | 9.861 | 2.384 ~ 40.786 | 0.002 |
| 肛瘘 | 19.263 | 3.714 ~ 99.905 | <0.001 |
| 常量 | 0.034 | - | <0.001 |
在IBD的临床诊治过程中,准确的鉴别结肠型CD与UC非常重要,这会直接影响治疗方案的选择[9]。本研究发现,两者不仅在发病年龄、BMI、是否伴有血便症状上有所不同,而且在CT影像中的病变连续性、肠壁增厚方式、厚度、不同部位严重程度、肠周炎性渗出等方面存在差异。基于临床及影像特征可在一定程度上鉴别两者。
本研究发现,相比于UC,结肠型CD患者发病年龄更早,BMI更低,血便症状更少,这与既往研究报道相一致[10,11,12]。另一方面,既往文献报道炎性指标可以反映IBD的炎症状态[13],但两组患者的CRP与ESR差异均无统计学意义,提示其不能作为有效的生物标志物区分IBD的不同亚型。
本研究中,尽管两组患者的病变部位多发生于远端结肠,但升结肠受累在结肠型CD患者中更常见,升结肠受累也是多因素回归模型中的有效预测因子。笔者猜测可能是由于UC为倒灌性结肠炎,病变初始发生在远端结直肠,本研究纳入人群为初诊的患者,广泛结肠受累的人群较少。直肠受累多见于UC,但本研究中55% CD患者也伴有直肠病变,两组差异无统计学意义。一项关于北美人群的流行病学显示,50%结肠受累的CD患者伴有直肠受累,与本研究结果一致[14]。在累及结直肠病变部位的数目方面,两组患者差异无统计学意义,提示两者均可同时出现多处结直肠病变。
与UC相比,结肠型CD更多表现为病变节段性分布、非对称性肠壁增厚,厚度多厚于UC,肠周炎性渗出及肛瘘也更加常见,多变量回归模型也提示肠周炎性渗出、肛瘘是诊断结肠型CD的有效预测因子。多节段性病变是CD的典型影像学表现,而UC患者更多表现为病变连续性分布,与既往报道的一致[15]。另外,结肠型CD患者以非对称性肠壁增厚为主,提示即使位于同一部位的病变,CD患者仍具有跳跃性的趋势,从而表现为影像学上单一节段的肠壁厚薄不均匀。这同样解释了结肠型CD患者在不同部位表现为炎症反应程度不一致的可能原因,而UC患者则更常出现结肠病变相一致的影像学表现。然而,进一步多因素回归分析显示,节段性病变与非对称病变并不能作为诊断结肠型CD的独立预测因子。在肠壁厚度上,结肠型CD患者厚于UC患者,我们认为这与CD表现为累及肠壁全层的透壁性炎症相关,除黏膜层受累之外,黏膜下层炎性水肿也常常同时出现,更有甚者累及肌层之外。而UC仅累及肠壁的黏膜层,病变浸润深度往往表浅,造成了两者影像学上的厚度差异,虽然多因素回归模型显示肠壁增厚没有显著差异(P = 0.051),但肠壁厚度越大,诊断结肠型CD仍具一定的优势比。Ellrichmann等[16]通过超声内镜比较UC与CD的结肠病变厚度,证实了CD黏膜下层厚度高于UC(P = 0.0001),CD平均肠壁厚度稍高于UC,但两者之间差异无统计学意义(P = 0.06)。本研究中,结肠型CD常伴有肠周炎性渗出,而UC患者少见,这或许依赖于两者在病理上累及肠壁的深度及层次有所不同,从而导致继发肠周炎性渗出改变的差异。肠周炎性渗出的出现明显提高了诊断结肠型CD的价值,这也是多因素回归模型中诊断结肠型CD的重要预测因子。另外,结肠型CD患者有50%以上会合并肛瘘,而UC少见,肛瘘是本研究中回归模型的关键预测因子,具有高优势比,其中的具体机制尚不明确,但肛瘘的出现对结肠型CD的诊断具有重要的参考价值。这也提示我们,IBD患者在行腹部检查时,放射医师应尽量覆盖肛管的扫描,这将进一步有助于临床诊断。
本研究尚存在一些局限性。首先,本研究为单中心回顾性研究,部分结果仍需要前瞻性研究给予证实。另外,本中心为胃肠道专科三级转诊中心,患者疾病严重程度分布不均衡,且纳入研究的样本量偏少,可能对结果产生一定的偏倚。其次,既往不同药物的使用可能对结肠型CD与UC的炎症分布及程度产生影响,这在一定程度上提高了两者影像学鉴别的难度。最后,本研究评估肛瘘征象是基于CT的诊断,受限于本身的软组织分辨率,部分早期无症状CD肛瘘可能存在假阴性结果。
综上所述,由于结肠型CD与UC表现不同的炎症发展进程及组织学浸润程度,两者在临床及影像上存在一定的差异。本研究有效地结合了患者的临床表现及影像学特征,为初诊医师鉴别结肠型CD与UC提供了可靠的渠道,为进一步的治疗决策提供了重要的参考价值。
所有作者均声明不存在利益冲突



























