
肠内营养(EN)是治疗克罗恩病(CD)的一个重要手段。虽然CD的发病机制不明,但CD患者相比于健康人群会出现一些显著的病理特征,如肠道菌群失调、肠黏膜过度炎症反应、肠黏膜损伤、肠系膜脂肪异常等。本综述探讨EN治疗CD的作用机制,以期能更好地理解EN在改变CD疾病进展中的作用,从而促进CD的临床管理。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
克罗恩病(Crohn′s disease,CD)是一种不可治愈且反复发作的慢性炎性肠病,可累及消化道的任何部位,目前治疗只能达到诱导缓解和维持缓解。CD的发病机制仍不明确,但目前被广泛认可的是由于基因、环境和免疫之间复杂的交互作用引起[1]。CD的病理特征包括肠道菌群失调、肠黏膜过度炎症反应、肠黏膜损伤、肠系膜脂肪异常等。
肠内营养(enteral nutrition,EN),尤其是全肠内营养(exclusive enteral nutrition,EEN),是CD诱导和维持缓解的一个重要手段[2,3]。根据蛋白质水解程度的不同,EN配方主要分为多聚物饮食、半要素饮食和要素饮食3种。从20世纪70年代早期,当第1个要素饮食治疗CD的效果被证实时,学者开始对EN治疗CD进行研究[4]。EN治疗除了改善CD患者营养状态外,还降低疾病活动程度,促进黏膜愈合,是一种安全可靠的治疗手段,但治疗机制目前尚不明确[5]。EN对CD的治疗效果可能通过调节CD患者肠道菌群,降低肠黏膜过度免疫应答,促进肠黏膜愈合和恢复肠系膜脂肪异常进行(图1)。本文基于现有研究证据,旨在探讨EN治疗CD的作用机制,从而更好地理解EN改变CD疾病进展的作用,促进CD的临床管理。
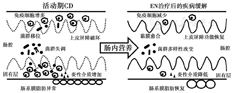

CD患者肠道出现明显的菌群紊乱,EN可通过改变细菌多样性和调节肠道优势菌群来改善疾病。人类肠道主要有厚壁菌门、拟杆菌门、放线菌门和变形菌门4类菌群。健康人的肠道中,超过90%的细菌属于厚壁菌门和拟杆菌门,而CD患者常出现厚壁菌门减少、变形菌门增多,以及整体细菌多样性下降[6]。研究发现,CD患者使用EEN治疗后,肠道中普雷沃菌(Bacteroides-Prevotella)和球形梭菌(C.coccoides)菌属的丰度明显降低,并且普雷沃菌的变化程度与EEN治疗时长具有显著相关性[7]。F.prausnitzii在CD患者肠黏膜中丰度明显升高,而使用EEN治疗后丰度降低,该结果与既往F.prausnitzii改善CD临床症状的研究结果相矛盾,说明F.prausnitzii在机体中扮演了一种复杂的角色[8]。Lewis等[9]发现EEN治疗主要是干预耐胆汁、氨基酸代谢相关的细菌,包括降低Dialister、Dorea、Streptococcus、Gordinibacter和Haemophilius丰度,增加Alistipes菌属。Shiga等[10]发现CD患者接受要素饮食的EEN治疗后脆弱拟杆菌(Bacteroides fragilis)明显减少,而总的细菌多样性却没有变化。此外,对于同样使用EN的CD患者,达到临床缓解和未缓解患者肠道菌群变化也有明显差异。使用治疗EN达到缓解的患者Akkermansia muciniphila和Bacteroides菌属丰度明显升高,而未达到临床缓解的患者Proteobacteria丰度增加[11]。也有研究指出,EEN可以降低包括共生菌在内的菌群多样性,引起菌群结构的显著变化,也就是说,EEN治疗反而将肠道菌群转变为了一种更加失调的状态[12]。由此可见,EN治疗CD在不同的研究中造成的菌群变化以及最终的治疗结局不同,这可能是由于研究队列的异质性,取材的差异性(粪便标本或者肠黏膜样本)以及营养制剂配方的差异等造成。
细菌本身可以作为一种抗原物质外,其发挥效应的另一个重要原因就是细菌代谢产物对机体生理和免疫功能的调节,但EN对CD患者肠道菌群代谢功能的研究较少。已有研究指出,EN治疗可以使CD患者粪便中的细菌代谢产物减少,包括短链脂肪酸、正丙醇、正丁醇和短链脂肪酸酯类等[13]。Gerasimidis等[7]发现EEN治疗显著减少了CD患者粪便中丁酸盐浓度,而增加了硫化物水平。这些证据表明EN治疗CD的其中一个机制可能是因为EN能够恢复肠道菌群正常的代谢功能。
总的来说,EN对CD患者肠道菌群的调控主要是通过改善肠道菌群多样性以及调节细菌代谢产物。然而,目前EN在CD患者肠道菌群方面的研究存在一定局限性,由于粪便标本更易获得,绝大多数研究中选取的均是粪便标本,而肠黏膜往往更能直观地表现出肠道菌群的定植情况,且粪便菌群也不能够很好地反应黏膜菌群情况,所以未来需要利用一系列肠黏膜样本进行更深入的菌群研究,以进一步探讨EN对CD的治疗作用机制。
CD患者肠黏膜中出现大量免疫细胞浸润,导致炎性介质过度释放。临床试验揭示EN在治疗CD过程中具有显著的免疫抑制作用,能抑制肠黏膜炎性细胞因子的产生。Yu等[14]在结肠炎模型中证实了EEN在机体内可以通过抑制丝裂原活化蛋白激酶(p38)或丝裂原应激激活蛋白激酶1(MSK1)信号通路来调控NF-κB活化,进而减少了血清中和结肠组织中促炎介质的产生。Wedrychowicz等[15]发现CD患者血清中TGF-β水平显著降低,而在EEN治疗后明显升高。TGF-β在抑制肠黏膜Th1炎症反应中发挥重要作用,并有临床研究发现包含TGF-β的肠内营养制剂能够降低肠黏膜中IL-1β、IL-2和IFN-γ等细胞因子的表达[16]。
此外,学者对不同类型、不同配方EN制剂对CD的治疗效果进行研究。de Jong等[17]利用肠上皮细胞的体外炎症模型,探讨多聚物饮食的抑炎效应,发现多聚物配方可以直接抑制肿瘤坏死因子(tumor necrosis factor,TNF)-α诱导的上皮细胞IL-8产生,并能推迟上皮细胞中IκBα降解而调节NF-κB转录。Nahidi等[18]利用基因芯片发现多聚物饮食配方可以调控与NF-κB通路相关的多个基因,说明EN可以通过改变细胞内信号通路的活性来发挥作用。Alhagamhmad等[19]发现多聚物饮食配方中的主要营养素谷氨酰胺、精氨酸和维生素D3均可抑制肠上皮细胞的炎症反应,多聚物配方总体产生的抑炎效应优于这3种营养素结合后的效果,说明聚合物饮食配方中存在目前未被鉴别出的抗炎物质。研究进一步证明了聚合物配方中的谷氨酰胺和精氨酸可以通过竞争性结合腺苷5′三磷酸而阻断NF-κB和p38的磷酸化,进而抑制了主要的促炎因子产生[19]。多聚物配方会导致上皮细胞表面的癌胚抗原相关细胞黏附分子-6(CEACAM6)蛋白表达增加,CEACAM6是一种黏附分子,能促进侵袭性大肠杆菌对上皮细胞的黏附,从而加剧CD患者肠道对此病原菌的固有免疫应答。Wagner等[20]发现含谷蛋白的半要素饮食可以减少CD4+T细胞活化,从而对CD样回肠炎具有明显的改善作用,并证实谷蛋白在肠炎中是作为一种抗原非依赖性的疾病调节因子。此外,有研究发现富含中链甘油三酯的肠内营养制剂是一种合适的脂肪能量来源营养物,并比普通的低脂要素饮食配方更能改善肠黏膜炎症[21]。
EN可以明显减少CD患者肠黏膜中的炎性介质,通过抑制细胞内主要的炎性信号通路而发挥作用改善CD肠炎。此外,一些特定的EN成分对抑炎特性有明显贡献,最显著的是谷氨酰胺和精氨酸,而其他具有此作用的营养成分,需进一步研究确定。
肠上皮破坏造成的黏膜损伤是CD的显著特征,而损伤的肠上皮由于通透性增加会造成肠腔内细菌等微生物以及腔内抗原物质的移位,从而促进黏膜免疫应答,进一步加剧肠损伤。因此,促进黏膜愈合是CD治疗的一个重要治疗目标。既往研究证实EN可以通过促进黏膜愈合来治疗CD,甚至发现相比于激素,EN能够诱导更高的黏膜缓解率[22]。Levine等[23]探讨了饮食对肠道通透性和黏液层完整性的影响,发现了一些特定的饮食组分,如小麦、乳剂和一些脂肪酸,可能会损害肠上皮细胞紧密连接以及黏液功能,而EN能通过排除这些对屏障功能有不利影响的食物而恢复上皮和黏液屏障。Nahidi等[24]研究了多聚物饮食配方对肠上皮紧密连接的影响,利用体外细胞实验发现上皮细胞在TNF-α刺激下通过上调肌球蛋白轻链激酶(MLCK)而减少了紧密连接完整性,而多聚物配方的EN能够完全反转MLCK上调造成的肠上皮通透性增加。该团队同样在体内实验性结肠炎模型中发现,使用多聚物饮食配方可以下调破坏紧密连接蛋白的促炎细胞因子基因表达(如MIP-2,LIX,TNF-α),从而维持肠屏障的完整性。TNF-α诱导的MLCK表达增加主要由NF-κB活化引起,而EN治疗可以通过抑制NF-κB活性而下调TNF-α诱导的MLCK表达,这也再次证实了EN是通过阻断细胞内的主要信号通路来发挥作用[24,25]。此外,Budd等[26]利用体外细胞实验证实多聚物饮食配方还可以促进肠上皮细胞的增殖和分化,从而进一步促进黏膜愈合。
对于接受肠切除手术的CD患者,肥大的肠系膜脂肪通常被外科医生用于描绘疾病活动区域的一个解剖标志。脂肪组织不仅是一个被动的能量储存和释放器官,还是一个功能活跃的内分泌器官,可以释放脂肪因子,如TNF-α、瘦素、脂联素和抵抗素等,从而促进代谢和免疫功能。研究发现,CD患者肠系膜脂肪组织脂联素释放明显增加,并且这些脂肪因子水平的升高与肠道炎症显著相关,说明内脏脂肪在CD发病过程中起到一定致病作用[27]。Feng等[28]发现经过EN治疗的CD患者,其回肠手术标本中的脂肪细胞远多于未接受EN治疗的CD患者,并且接受EN治疗的CD患者回肠中TNF-α和瘦素等促炎脂肪因子的基因和蛋白表达水平明显下调,说明EN可以通过恢复脂肪细胞形态和减弱肠系膜脂肪的炎症微环境来改善CD肠损伤。此外,有研究发现肠系膜脂肪组织是CD中C-反应蛋白(CRP)的重要来源,包括炎症和细菌刺激在内均可以引起肠系膜脂肪细胞产生CRP[29]。Li等[30]发现EN治疗能够减少CD患者的内脏脂肪和肠系膜脂肪指数(定义为内脏脂肪与皮下脂肪的比值),而肠系膜脂肪指数与活动期CD患者的CD活动指数和CRP水平密切相关。
活性物质如羟自由基、一氧化氮和次氯酸盐离子等,与CD患者肠黏膜炎症相关,并且CD患者循环和结肠组织中的中性粒细胞和单核细胞等能产生大量氧自由基。活性物质诱导的脂质过氧化能引起局部炎症,而中性粒细胞来源的氧化剂会诱导细胞损伤,造成黏膜通透性增加。研究发现,CD患者的抗氧化系统不管是在全身还是在局部肠黏膜都受到严重损伤,这导致一些氧自由基和过氧化物无法被及时清除,从而会造成进一步细胞损伤[31]。Phylactos等[32]研究了多聚物饮食配方的EN对儿童CD患者血液红细胞中铜锌超氧化物歧化酶(Cu/Zn-SOD)和硒谷胱甘肽过氧酶(Se-GPx)这两种抗氧化物酶的活性,发现使用EN前后血细胞中的抗氧化物酶未发生明显变化,而血液中的炎性指标CRP和TNF-α水平明显下降。目前仅有此项研究探讨了EN对抗氧化酶的影响,长期使用EN是否能够改善抗氧化酶系统也不清楚,所以EN对抗氧化酶的作用暂无法下定论,需要进一步研究。
肠内营养在CD的治疗中发挥重要作用,除了可以改善患者的营养不良状态,还能够调节肠道菌群,减少过度激活的免疫应答,促进肠黏膜愈合,恢复肠系膜脂肪状态,以及可能影响抗氧化酶活性。
目前EN已是儿童CD公认的一线治疗方法,而成人CD患者使用EN治疗尚未达成共识。我们认为,EN治疗成人活动期CD目前虽不被指南所推荐,并不代表EN的治疗效果差。因为指南的制定主要参考一些大型的多中心随机对照临床研究,但由于EN对于成年人在实际生活中的实施存在一些困难,比如缺少多学科的团队支持,缺乏使用经验和护理指导,营养管的使用会扰乱正常生活以及营养液适口性差等,导致成年人使用EN的依从性大大降低。除此之外,关于EN仍有一些问题需要解决:(1)目前对于已知的一些EN组分,如谷氨酰胺和精氨酸等,具有明显的抗炎效果,而是否存在其他的营养成分能表现出相似的甚至更强的治疗效果需进一步研究。(2)目前已证实EN可以改变细菌多样性和调节菌群代谢产物来改善CD,若使用EN的同时联合应用益生菌是否会进一步加强EN的疗效。(3)今后的研究还应聚焦于优化EN喂养途径(如使用营养管还是口服)和营养方案的具体细节(如EN干预时长、配方类型和剂量的选择)。克服这些障碍可以使更多成年CD患着受益于EN治疗,并能具有与儿童疾病相似的疗效。
所有作者均声明不存在利益冲突



























