
多种生物制剂已被批准用于治疗炎症性肠病(IBD)。但由于缺乏比较生物制剂间疗效和安全性的头对头的随机对照研究,以及缺乏准确预测生物制剂疗效的方法,临床医生常存在如何选择生物制剂的困惑。本文参考目前已有的临床研究证据,再结合国际主流意见和我国的应用经验,提出IBD治疗过程中生物制剂选择和转换的建议,供同行参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
20多年前,首个生物制剂抗肿瘤坏死因子(tumor necrosis factor,TNF)-α单克隆抗体(以下简称单抗)即英夫利西单抗(infliximab,IFX)被批准用于克罗恩病(Crohn′s disease,CD)的治疗,开启了炎症性肠病(inflammatory bowel disease,IBD)生物制剂治疗的新时代,其后不断有新的抗TNF-α单抗、不同靶点的生物制剂和低分子药物被批准用于CD和(或)溃疡性结肠炎(ulcerative colitis,UC)的治疗。这些获批药物的Ⅲ期临床试验结果见表1和表2。我国目前已批准IFX及维得利珠单抗(vedolizumab,VDZ)治疗CD和UC,阿达木单抗(adalimumab,ADA)及乌司奴单抗(ustekinumab,UST)治疗CD,本刊2021年刊登了规范使用这些生物制剂的专家建议意见[1]。
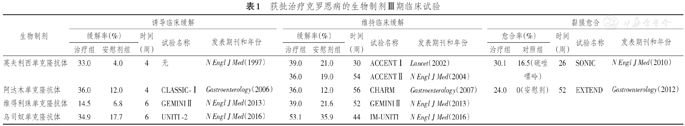
获批治疗克罗恩病的生物制剂Ⅲ期临床试验
获批治疗克罗恩病的生物制剂Ⅲ期临床试验
| 生物制剂 | 诱导临床缓解 | 维持临床缓解 | 黏膜愈合 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 缓解率(%) | 时间(周) | 试验名称 | 发表期刊和年份 | 缓解率(%) | 时间(周) | 试验名称 | 发表期刊和年份 | 愈合率(%) | 时间(周) | 试验名称 | 发表期刊和年份 | ||||
| 治疗组 | 安慰剂组 | 治疗组 | 安慰剂组 | 治疗组 | 对照组 | ||||||||||
| 英夫利西单克隆抗体 | 33.0 | 4.0 | 4 | 无 | N Engl J Med(1997) | 39.0 | 21.0 | 30 | ACCENTⅠ | Lancet(2002) | 30.1 | 16.5(硫唑嘌呤) | 26 | SONIC | N Engl J Med(2010) |
| 36.0 | 19.0 | 54 | ACCENTⅡ | N Engl J Med(2004) | |||||||||||
| 阿达木单克隆抗体 | 36.0 | 12.0 | 4 | CLASSIC-Ⅰ | Gastroenterology(2006) | 36.0 | 12.0 | 56 | CHARM | Gastroenterology(2007) | 24.0 | 0(安慰剂) | 52 | EXTEND | Gastroenterology(2012) |
| 维得利珠单克隆抗体 | 14.5 | 6.8 | 6 | GEMINIⅡ | N Engl J Med(2013) | 39.0 | 21.6 | 52 | GEMINIⅡ | N Engl J Med(2013) | |||||
| 乌司奴单克隆抗体 | 34.9 | 17.7 | 6 | UNITI -2 | N Engl J Med(2016) | 53.1 | 35.9 | 44 | IM-UNITI | N Engl J Med(2016) | |||||
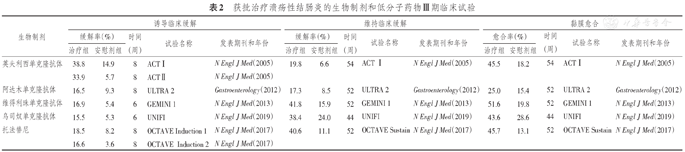
获批治疗溃疡性结肠炎的生物制剂和低分子药物Ⅲ期临床试验
获批治疗溃疡性结肠炎的生物制剂和低分子药物Ⅲ期临床试验
| 生物制剂 | 诱导临床缓解 | 维持临床缓解 | 黏膜愈合 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 缓解率(%) | 时间(周) | 试验名称 | 发表期刊和年份 | 缓解率(%) | 时间(周) | 试验名称 | 发表期刊和年份 | 愈合率(%) | 时间(周) | 试验名称 | 发表期刊和年份 | ||||
| 治疗组 | 安慰剂组 | 治疗组 | 安慰剂组 | 治疗组 | 安慰剂组 | ||||||||||
| 英夫利西单克隆抗体 | 38.8 | 14.9 | 8 | ACTⅠ | N Engl J Med(2005) | 19.8 | 6.6 | 54 | ACT Ⅰ | N Engl J Med(2005) | 45.5 | 18.2 | 54 | ACTⅠ | N Engl J Med(2005) |
| 33.9 | 5.7 | 8 | ACTⅡ | N Engl J Med(2005) | |||||||||||
| 阿达木单克隆抗体 | 16.5 | 9.3 | 8 | ULTRA 2 | Gastroenterology(2012) | 17.3 | 8.5 | 52 | ULTRA 2 | Gastroenterology(2012) | 25.0 | 15.4 | 52 | ULTRA 2 | Gastroenterology(2012) |
| 维得利珠单克隆抗体 | 16.9 | 5.4 | 6 | GEMINI 1 | N Engl J Med(2013) | 41.8 | 15.9 | 52 | GEMINI 1 | N Engl J Med(2013) | 51.6 | 19.8 | 52 | GEMINI 1 | N Engl J Med(2013) |
| 乌司奴单克隆抗体 | 15.5 | 5.3 | 6 | UNIFI | N Engl J Med(2019) | 38.4 | 24.0 | 44 | UNIFI | N Engl J Med(2019) | 43.6 | 28.6 | 44 | UNIFI | N Engl J Med(2019) |
| 托法替尼 | 18.5 | 8.2 | 8 | OCTAVE Induction 1 | N Engl J Med(2017) | 40.6 | 11.1 | 52 | OCTAVE Sustain | N Engl J Med(2017) | 45.7 | 13.1 | 52 | OCTAVE Sustain | N Engl J Med(2017) |
| 16.6 | 3.6 | 8 | OCTAVE Induction 2 | N Engl J Med(2017) | |||||||||||
目前尚无共识指导如何合理选择生物制剂治疗IBD,主要因为缺乏比较生物制剂疗效和安全性的头对头的随机对照试验(randomized controlled trial,RCT)研究,更缺乏对生物制剂疗效预测因素的研究。本文参考目前已有的临床研究证据,对这些药物的疗效和安全性进行分析比较,再结合国际主流意见和我国的应用经验,提出IBD治疗过程中生物制剂选择和转换的建议,供临床参考。
生物制剂适用于对糖皮质激素和(或)免疫抑制剂等传统治疗疗效不佳和(或)不能耐受的中重度CD患者[1]。一般根据克罗恩病活动指数(Crohn′s disease activity index,CDAI),把Harvey-Bradshaw简化CDAI≥8分或Best CDAI≥220分定义为中重度CD[2]。
但是,CDAI主要反映某个时间段CD的疾病活动程度,不能真实全面地反映疾病严重程度。因此,IBD国际组织(IOIBD)提出IBD总体疾病严重指数(overall disease severity index),其评估结果与疾病远期预后(疾病相关并发症、外科手术切除、对生存质量的影响)密切相关[3]。根据肠道结构损伤、炎症负荷和对生存质量的影响程度,IBD总体疾病严重指数中不良预后的高危因素如下(按影响程度由高到低排序):内镜或影像学所见肠黏膜存在深或大的溃疡、诊治时合并瘘管和(或)肛周脓肿、肠切除史(特别是小肠切除>40 cm)、存在肠造口、广泛肠道病变(回肠累及>40 cm或全结肠)、每周至少排10次烂便、诊治时存在肠狭窄、C-反应蛋白(C-reactive protein,CRP)显著升高、生物制剂和(或)免疫抑制剂对症状改善欠佳、低蛋白血症、存在肛管直肠的相关症状、贫血、每天腹痛、近1年使用糖皮质激素治疗。具有上述高危因素者可视为CD高危患者。对CD高危患者,特别是总体疾病严重指数高者,宜早期使用生物制剂治疗[4,5]。近期一项纳入25项RCT研究共6168例CD患者的Meta分析结果显示,生物制剂对短病程(≤18个月)的CD患者诱导缓解率显著高于长病程者,提示早期生物制剂治疗CD的疗效可能更好[6]。
对于轻中度CD患者,建议先采取传统治疗[糖皮质激素和(或)免疫抑制剂],其中治疗失败或复发频繁并存在客观炎症活动证据者,可考虑采用生物制剂治疗[4]。
生物制剂适用于对传统治疗[糖皮质激素和(或)免疫抑制剂]疗效不佳和(或)不能耐受的中重度UC患者[1]。一般把改良Mayo评分总分≥6分并内镜评分≥2分定义为中重度UC。根据Truelove和Witts标准,急性重度溃疡性结肠炎(acute severe ulcerative colitis,ASUC)是指住院UC患者血便≥6次/d,并伴至少1种全身毒性表现[心率>90次/min、体温>37.8℃、血红蛋白<105 g/L、红细胞沉降率(erythrocyte sedimentation rate,ESR)>30 mm/1 h][2]。
对可能需要结肠切除的高危UC患者,可考虑尽早使用生物制剂[7]。其高危因素包括广泛性结肠炎、肠黏膜深溃疡、年龄≤40岁、炎症指标(CRP和ESR)明显升高、起病即需要糖皮质激素治疗。美国胃肠病学会(American Gastroenterological Association,AGA)指南认可此观点[8],但欧洲克罗恩病及结肠炎组织(ECCO)指南有提及却未明确推荐[9],在临床实践中应如何把握尚需进一步探讨。ASUC患者经3 ~ 5 d足量糖皮质激素静脉用药无效时,应转换治疗。IFX与环孢素作为转换治疗的药物,疗效相似[7,8]。
目前尚无比较各种生物制剂疗效的头对头的RCT研究结果发表,主要借助针对安慰剂对照的RCT研究结果的网络Meta分析,进行生物制剂间的疗效比较,并以开发与评估(grading of recommendations assessment,development and evaluation,GRADE)框架对证据质量进行评价[10]。
AGA对各种生物制剂疗效的分析有一定代表性[10]。在一线生物制剂(先前未使用过生物制剂)诱导肠道CD临床缓解方面,分析8项RCT研究共1458例CD患者的结果后发现,IFX可能优于UST (OR = 2.14,95%CI:0.89 ~ 5.15)和VDZ(OR = 2.20,95%CI:0.79 ~ 6.07)(低质量证据),不能确定ADA是否优于UST和VDZ,UST和VDZ间疗效差异无显著统计学意义。在二线生物制剂(先前使用过抗TNF制剂)诱导肠道CD临床缓解方面,分析6项RCT研究共1606例CD患者的结果后发现,ADA、UST和VDZ均比安慰剂有效(证据质量分别为中、中和低),以及ADA和UST疗效可能优于VDZ,但由于证据质量非常低,3种生物制剂间的疗效差异尚不确定。在生物制剂维持临床缓解方面,ADA的疗效可能优于UST(OR = 2.19,95%CI:1.15 ~ 4.16)和VDZ(OR = 1.96,95%CI:0.93 ~ 3.85)(低质量证据),其他生物制剂之间疗效差异不能确定。
其他一些关于生物制剂治疗CD疗效的研究需要我们关注。一项尚未正式发表的、比较UST与ADA作为一线生物制剂治疗中重度CD的头对头的随机双盲双模拟对照研究(SEASVUE研究)结果显示,两种生物制剂的8周诱导临床缓解率相似(50.3%比47.7%),52周临床缓解率和无激素临床缓解率的差异均无显著统计学意义(65.9%比61.0%,P = 0.417;60.7%比57.4%,P = 0.485)。此研究将首次为证明UST作为一线生物制剂具有与ADA相同疗效提供较高质量证据。另一项研究比较IFX与UST作为一线生物制剂治疗CD的疗效,对2项RCT研究(420例)进行事后分析,结果显示两种生物制剂的6周临床缓解率(44.9%比37.9%,校正OR = 1.22,95%CI:0.79 ~ 1.89)和临床应答率(58.4%比54.9%,校正OR = 1.25,95%CI:0.82 ~ 1.90)差异均无统计学意义,该研究结果提示,IFX与UST作为一线生物制剂治疗时的起效速度相似[11]。关于VDZ与抗TNF制剂作为一线生物制剂治疗CD的疗效的比较,一项回顾性研究(EVOLVE研究)收集2017年9月至2018年12月间美国、加拿大和希腊的连续性CD病例进行分析,其中采用VDZ治疗215例,抗TNF制剂治疗266例,结果显示两种生物制剂治疗24周的临床缓解率差异无统计学意义(76.6%比68.5%,P = 0.10)[12]。
另外,还有不少真实世界的大样本观察性研究比较了UST与VDZ作为二线生物制剂治疗抗TNF制剂无效的CD的疗效。一项回顾性研究纳入239例抗TNF制剂治疗无效的CD患者,结果提示UST治疗48周的临床缓解率显著高于VDZ(54.4%比38.3%,OR = 1.92,95%CI:1.09 ~ 3.39)[13];另一项前瞻性登记研究纳入203例抗TNF制剂治疗无效的CD患者,结果提示UST治疗52周的无激素临床缓解并炎症指标缓解率显著高于VDZ(23%比10%,OR = 2.74,95%CI:1.23 ~ 6.09)[14]。VDZ疗效预测模型的研究提示,VDZ对既往使用过抗TNF制剂、有并发症的CD患者疗效欠佳[15]。
从疗效角度总体来说,根据目前的临床证据,当选择一线生物制剂时,可选择IFX和ADA,初步证据显示UST可作为并列选择,而选择VDZ作为一线生物制剂治疗CD的证据质量较低。对抗TNF制剂原发性失效者,首选UST治疗;继发性失效者,推荐ADA(最好参考IFX谷浓度和抗药抗体)或UST治疗。VDZ可用于抗TNF制剂原发或继发性失效且无并发症的中度CD[5]。一般来说,采用诱导缓解的药物来维持CD缓解。
(1)瘘管型CD:目前仅有IFX治疗CD瘘管的RCT研究,结果显示IFX诱导和维持瘘管愈合率显著高于安慰剂[16,17]。其他生物制剂治疗CD瘘管的RCT研究,主要来源于针对生物制剂治疗CD的RCT研究的事后亚组分析。UST诱导和维持瘘管愈合率高于安慰剂,ADA或VDZ维持瘘管愈合率高于安慰剂,但证据等级均较低[10]。上述研究中的绝大多数CD瘘管为肛瘘。
法国的回顾性多中心研究(BioLAP研究)提示UST对肛瘘有一定疗效[18]。该研究中99%患者先前接受过抗TNF制剂治疗。活动性肛瘘患者在UST治疗后6个月的肛瘘愈合率为38.5%(57/148),非活动性肛瘘患者在治疗后平均48周的随访期内肛瘘复发率为22.0%(13/59)。同时,BioLAP研究也总结了VDZ治疗肛瘘的疗效,显示VDZ对肛瘘治疗价值有限[19]。68%患者在平均33周随访期内因肛瘘或肠道症状无改善、发生不良反应等停药,活动性肛瘘患者在VDZ治疗6个月的肛瘘愈合率为22.5%(23/102),非活动性肛瘘患者在治疗后平均39周的随访期内肛瘘复发率为30.6%(15/49)。
最近一项比较VDZ常规剂量和增加剂量(第10周增加1次给药)治疗肛瘘的随机双盲对照研究[20],其中79%的患者曾接受过抗TNF制剂治疗,结果显示,30周肛瘘的总体愈合率为42.9%(12/28),两组间的肛瘘愈合率差异无统计学意义。该研究认为VDZ对肛痿治疗效果与抗TNF制剂相近,但该研究无安慰剂对照,且92%患者基线均有肛瘘挂线,对研究结论的可信度有影响。
总体来说,对CD肛瘘,中度证据支持IFX诱导和维持缓解,低度证据支持UST诱导和维持缓解,低度证据支持ADA维持缓解,尚需进一步研究结果支持ADA和VDZ诱导缓解[10]。
(2)IBD的肠外表现:除一项IFX治疗坏疽性脓皮病随机双盲安慰剂对照研究[21]之外,目前生物制剂治疗IBD肠外表现(extraintestinal manifestations,EIM)的疗效证据均来自治疗IBD的RCT事后分析或观察性研究。现已有文献分别系统综述了抗TNF制剂[22]、UST[23]和VDZ[24]治疗肠外表现的疗效。
近期发表的一篇生物制剂治疗肠外表现的评估及使用建议的文献可作为重要参考[25]。治疗与IBD肠道炎症活动性相关的肠外表现主要在于控制肠道IBD炎症活动。可能对肠外表现发挥针对性作用的生物制剂包括:①抗TNF制剂:对皮肤、关节及眼的肠外表现均有效。要强调的是,已有充足证据证明抗TNF制剂治疗中轴关节炎及坏疽性脓皮病的疗效,同时其对伴发的类风湿性关节炎和强直性脊柱炎的疗效早已得到风湿科认可。②UST:对外周关节炎或外周关节痛有效,特别适用于银屑病关节炎,但不适用于中轴关节炎;对皮肤肠外表现(结节红斑和坏疽性脓皮病)可能有效;对葡萄膜炎的疗效尚待进一步证实。③VDZ:目前无足够证据支持其对肠外表现有针对性疗效。随着VDZ对肠道炎症活动性的控制,与IBD肠道炎症活动性密切相关的肠外表现可能因此而改善,有报道其对外周关节炎或外周关节痛有效,但尚待进一步研究。
目前只有一项VDZ与ADA的头对头RCT研究(VARSITY研究)比较生物制剂治疗中重度UC的疗效,结果显示,VDZ治疗52周的临床缓解率和黏膜愈合率显著高于ADA(31.3%比22.5%,95%CI:2.5 ~ 15.0,P = 0.006;39.7%比27.7%,95%CI:5.3 ~ 18.5,P<0.001),而无激素临床缓解率间差异无统计学意义;进一步行亚组分析,发现两组间只有未接受过抗TNF制剂的UC患者疗效差异无统计学意义[26]。
在各种生物制剂治疗UC的疗效比较方面,近期发表的一篇网络Meta分析文献有一定代表性[27]。文献纳入了采用一线生物制剂治疗的15项RCT(3747例)研究,分析结果显示,临床缓解率和黏膜愈合率的累积排序概率图下面积(surface under the cumulative ranking curve,SUCRA)分别为:IFX 0.95和0.95,VDZ 0.76和0.63,托法替尼0.56和0.47,UST 0.49和0.44,ADA 0.32和0.35,其中IFX排在最高位。中度证据支持IFX诱导UC临床缓解率优于ADA,但其他生物制剂间的疗效差异无统计学意义。文献还纳入采用二线生物制剂治疗的7项RCT(1580例)研究,分析结果显示,临床缓解率和黏膜愈合率的SUCRA分别为:托法替尼0.91和0.87,UST 0.83和0.87,VDZ 0.34和0.48,ADA 0.26和0.15,其中托法替尼和UST排在高位。中度证据支持托法替尼和UST诱导UC临床缓解优于ADA及VDZ。各种生物制剂间维持临床缓解的疗效差异有显著统计学意义。
已有不少VDZ治疗中重度UC的真实世界的研究报道。一项比较一线生物制剂治疗中重度UC疗效的研究(EVOLVE研究),纳入376例采用VDZ治疗和221例采用抗TNF制剂治疗的UC患者进行回顾性分析,结果显示,两种生物制剂治疗24周的临床缓解率和黏膜愈合率差异无统计学意义(65.9%比48.6%,P = 0.09;86.6%比80.6%,P = 0.66)[12]。近期发表的另一项多中心回顾性研究纳入454例采用VDZ治疗和268例采用抗TNF制剂治疗的UC患者进行分析,结果显示,VDZ的无激素深度缓解率显著高于抗TNF制剂(HR = 2.819,95%CI:1.496 ~ 5.310);VDZ作为一线生物制剂的严重不良反应发生率显著低于抗TNF制剂(HR = 0.192,95%CI:0.049 ~ 0.754)[28]。一项澳大利亚的全国性登记研究报道各种生物制剂长期维持治疗情况,在中重度UC患者中,VDZ的长期维持治疗比例显著高于抗TNF制剂(HR = 1.67,95%CI:1.27 ~ 2.18,P<0.001),长期维持用药与既往未使用过生物制剂相关[29]。另一项疗效预测模型的研究结果显示,VDZ疗效与既往是否使用过生物制剂和起始用药时内镜的严重程度相关[30]。
从疗效角度总体来说,根据目前临床证据,推荐IFX和VDZ作为一线生物制剂治疗中重度UC,急性重度UC应使用IFX治疗,VDZ和IFX的疗效均优于ADA,但ADA用药方便,对于病情较轻者,仍可作为供选择的药物[8,9]。对抗TNF制剂原发或继发失效者,AGA及ECCO推荐UST或托法替尼治疗,疗效优于ADA或VDZ[8,9],但目前这两种药物在我国均未获批为UC适应证药物。在这种情况下可选择VDZ治疗,尤其对于UC病情较轻者[30]。对于VDZ治疗无效者,可换用IFX,但尚缺乏足够证据。一般来说,采用诱导缓解的药物来维持UC缓解。
各种生物制剂安全性的证据主要源于RCT、观察性研究及上市后的登记研究,目前已有较多相关的系统分析[31]和述评[32]。
抗TNF制剂有增加机会感染和严重感染的风险,尤其可能激活潜伏结核感染、增加新发结核感染和激活乙型肝炎病毒感染。一项纳入22项RCT研究的Meta分析结果显示,抗TNF制剂组的机会感染率高于安慰剂组(0.9%比0.3%,RR = 2.05,95%CI:1.10 ~ 3.85),其中结核感染率显著增高(RR = 2.52,95%CI:0.62 ~ 10.21)[33]。美国一项持续13年的登记研究(TREAT研究)结果显示,IFX治疗CD的严重感染率显著高于非生物制剂组(2.15/100人年比0.86/100人年)[34]。法国的一项全国性队列研究纳入190 694例IBD患者,根据治疗药物分成未接受巯嘌呤类药物及抗TNF制剂组、巯嘌呤类药物组、抗TNF制剂单药组和抗TNF制剂与巯嘌呤类药物联合治疗组,其严重感染率分别为8.4、10.5、18.9、22.4/1000人年,其中抗TNF制剂单药组高于巯嘌呤类药物组(HR = 1.71)、联合治疗组高于抗TNF制剂单药组(HR = 1.23);4组患者的机会感染率分别为0.4、1.7、2.1、4.1/1000人年,虽然抗TNF制剂单药组的总体机会感染率没有显著高于巯嘌呤类药物组,但结核感染却显著增加(HR = 1.98),联合治疗组的机会感染率高于抗TNF制剂单药组(HR = 1.96)[35]。疾病活动度、病程、合用激素和老年患者是IBD应用抗TNF制剂发生机会感染和严重感染的危险因素[31]。
一项纳入6个临床研究共2830例IBD患者随访5年的Meta分析结果显示,VDZ的严重感染率与安慰剂相似(4.3/100人年比3.8/100人年),无患者出现乙型肝炎病毒激活,艰难梭菌感染及结核分支杆菌感染发生率在VDZ治疗组很低,分别为0.4、0.1/100人年,但在安慰剂组中无人感染[36]。一项基于2家美国和1家法国保险公司数据库的统计研究共纳入VDZ组8768例和抗TNF制剂组26 656例IBD患者,两组的总严重感染率差异无统计学意义(HR = 0.95,95%CI:0.79 ~ 1.13),但VDZ治疗UC的严重感染率低于抗TNF制剂(HR = 0.68,95%CI:0.50 ~ 0.93),而在CD患者中无明显差异[37]。
UST最早用于银屑病的治疗。PSOLAR登记研究分析美国12 093例银屑病患者,UST、IFX和其他生物制剂组的严重感染率分别为0.93、2.91和1.91/100人年,IFX与其他生物制剂合用后与UST组比较,前者的严重感染率显著高于后者(HR = 1.96,P<0.001)[38]。一项来自结核病高发的韩国的研究结果显示,UST治疗银屑病的结核病发生率与普通人群无显著差异[39]。但UST治疗银屑病的剂量为治疗IBD的一半,因此其治疗IBD的安全性仍有待更多和更长期的研究确认。近期发表的UST治疗CD的IM-UNITI研究显示,UST治疗后随访5年,其严重感染率与安慰剂无显著差异(3.9/100人年比3.4/100人年),仅1例发生活动性结核[40]。一篇观察性研究的系统综述提示,UST治疗的严重感染率为5.6%,且无结核感染报道[41]。
总体来说,与抗TNF制剂比较,UST治疗的患者发生机会感染和严重感染(包括潜伏结核激活或新发结核)的概率更低,但由于其临床使用时间尚短,需进一步研究证实。VDZ的作用有肠道特异性,理论上不会增加其他系统及全身机会感染的风险,临床证据也显示其感染风险低于抗TNF制剂,该药可能是目前感染风险最低的生物制剂,但对肠道感染特别是艰难梭菌感染的风险尚待进一步研究。
既往研究认为淋巴瘤的发生风险与联用巯嘌呤类药物有关,尚不清楚抗TNF制剂是否会增加淋巴瘤的风险[42]。近年发表在JAMA的一项法国全国性队列研究随访189 289例IBD患者,平均随访时间6.7年,发现单用巯嘌呤类药物者和单用抗TNF制剂者与未使用这两种药物者比较,淋巴瘤发生风险均有增加,增加量虽少但有统计学意义;联用抗TNF制剂与巯嘌呤类药物的IBD患者的淋巴瘤风险高于单用巯嘌呤类药物者(校正HR = 2.35,95% CI:1.31 ~ 4.22,P<0.001)和单用抗TNF制剂者(校正HR = 2.53,95% CI:1.35 ~ 4.77,P<0.001) [43]。抗TNF制剂可能不增加非黑色素瘤皮肤癌的风险,但可能增加黑色素瘤风险,这一结论在风湿性疾病的研究中尚未得到证实[31,32]。
在治疗银屑病的PSOLAR研究中,未观察到UST会增加恶性肿瘤的发生风险[38]。目前也未在IBD研究中发现UST和VDZ会增加恶性肿瘤发生风险,但因临床应用时间尚短,有待进一步研究。
妊娠期使用IFX、ADA、VDZ和UST的风险级别均被美国食品和药物管理局(FDA)评定为B级(低风险)。新近一篇系统综述纳入48项研究共6963例使用生物制剂的IBD妊娠期妇女,结果显示,妊娠期使用上述药物的妊娠结局与普通人群差异无统计学意义[44]。既然已经明确IBD本身疾病活动会显著影响妊娠结局,而停用生物制剂易发生疾病复发,因此,如果病情需要,建议在整个妊娠期继续使用生物制剂[44,45]。虽然在妊娠后期IFX的胎盘通过率会增加,理论上可能会影响新生儿免疫功能,但在临床系统综述中并未观察到这一影响[44]。多伦多共识推荐在妊娠期全过程可以使用生物制剂,如有特殊考虑且病情控制较好者,可在妊娠后期暂时停用[46]。目前研究资料有限,暂无法比较各种生物制剂间对妊娠结局影响的差异[44,45]。
抗TNF制剂继发失效与其免疫原性(抗药抗体产生)相关,联用免疫抑制剂(巯嘌呤类药物或甲氨蝶呤)可降低其免疫原性。已有RCT研究证实IFX联用硫唑嘌呤治疗IBD的疗效优于IFX单药[5,8]。另一项RCT研究提示,当一种抗TNF制剂因继发性失效而转换为另一种抗TNF制剂时,联用硫唑嘌呤者的疗效明显优于单用生物制剂者[47]。但联合用药增加了不良反应的风险。UST和VDZ免疫原性低。一项系统综述显示,IFX、ADA、UST和VDZ的抗药抗体产生率分别为0 ~ 65.1%、0.3% ~ 38.0%、1.0% ~ 4.1%和0.7%[48]。目前研究证据未显示UST和VDZ与免疫抑制剂联用有更多疗效获益[5,8]。抗TNF制剂的免疫原性还增加了免疫性疾病发生的风险,如药物性红斑狼疮、皮肌炎和银屑病等,但UST和VDZ尚无相关报道[32]。
药物的选择需要权衡获益及风险比,既要考虑到患者疾病严重程度对药物疗效的需求,又要考虑身体状况对安全性的需求。根据上述对各种生物制剂疗效及安全性的比较分析,再结合国际主流意见和我国的应用经验,提出目前已批准使用的生物制剂治疗CD和UC的选择和转换的建议(图1和图2)。当然,具体使用时,医生需结合当地条件及患者意愿。IBD伴随其他临床情况如瘘管和肠外表现时,生物制剂的选择可参阅上文。
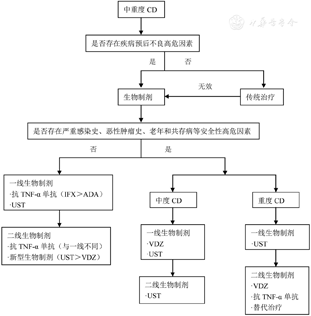

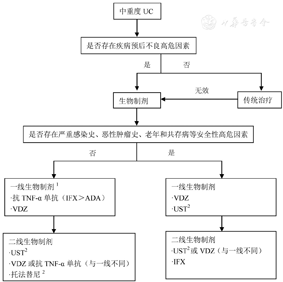

新的生物制剂将有助于提高IBD,尤其是难治性IBD的疗效,但同时增加了临床医师对药物选择和转换的困惑。目前的研究证据尚不足以对各种生物制剂疗效和安全性做出准确的评价,多数情况下临床医师根据经验进行药物选择和转换。未来需要更多的研究,特别是头对头的RCT研究,进一步比较各种生物制剂的疗效和安全性,还需要建立疗效预测模型,指导个体化用药。随着越来越多的生物制剂和低分子药物上市,如何高效解决这些问题显得非常迫切。
作者声明不存在利益冲突



























