
本文报道南京鼓楼医院收治的1例经病理明确诊断罕见的小肠特发性肠系膜静脉肌内膜增生症病例,并且就其临床病理学特点及与其他肠道病变鉴别诊断进行讨论,以加深临床及病理医生对该疾病的认识。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男性,25岁,因"反复腹痛伴恶心呕吐10年余加重1周"于2021年7月来我院就诊。患者2011年开始多于进食后出现反复脐周疼痛伴恶心呕吐、肠鸣,2017年于外院行胶囊内镜检查后诊断为克罗恩病(Crohn′s disease,CD),曾间断口服美沙拉嗪肠溶片,期间腹痛时有发作。近1周腹痛、腹胀加剧伴肛门停止排气,门诊拟以炎症性肠病(inflammatory bowel disease,IBD)伴小肠梗阻可能收入院。患者无黑便血便、胸闷心悸、发热恶寒等表现,近期体质量无明显变化。既往无肿瘤、感染、自身免疫性疾病及手术史。家族中亦无类似情况,否认家族遗传病。
体格检查:体温36.1℃,脉搏67次/min,呼吸20次/min,血压89/52 mmHg(1 mmHg = 0.133 kPa),体质量指数15.22 kg/m2,腹部膨隆伴脐周压痛,肠鸣音2次/min。
实验室检查:谷酰转肽酶10.0 U/L,总蛋白60.6 g/L,总胆汁酸18.8 μmol/L。免疫球蛋白IgA 1.47 g/L,IgG 6.7 g/L,IgM 0.25 g/L,IgE 128 IU/ml。抗U1核糖核蛋白/Sm(抗U1-RNP/Sm)抗体阳性。血常规、结核感染特异性T细胞检测、巨细胞和EB病毒血清学检查、抗核抗体谱、肿瘤血清标志物等均正常。
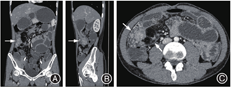
影像学检查:入院后给予禁食和静脉补液后患者腹痛缓解、肛门排气恢复,遂行全腹CT平扫加增强,显示右中下腹局部小肠肠壁水肿增厚,增强后明显充血,周围脂肪间隙浑浊伴多发渗出,见一3.5 cm × 4.1 cm的不规则软组织团块影,见图1A、1B;病变肠管周围多发扩张、迂曲血管影,见图1C;病灶近端肠管扩张,远端肠管内见多量液体。肠系膜上动脉CTA示动脉走行良好,未见充盈缺损或瘤样扩张,见图2A。

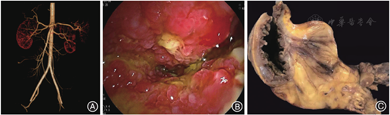

小肠镜检查:空肠中下段查见一处溃疡上覆白苔,此处管腔狭窄、周围黏膜息肉样增生,内镜无法通过,见图2B;近端肠管扩张伴大量积液,结直肠未见异常。空肠中下段溃疡边缘活检示活动性慢性肠炎伴幽门腺化生,黏膜层毛细血管未见异常,未见肿瘤及其他特异性组织学改变。
诊治经过:综合内镜和影像学结果,考虑小肠溃疡伴肠腔狭窄,肠壁外肿瘤不能除外,经与患者及其家属沟通同意后转外科手术治疗。术中探查小肠,距Treitz韧带约1.2 m处见长约10 cm小肠狭窄,伴区域肠系膜脂肪组织增生及多发淋巴结肿大,形成7 cm × 6 cm × 5 cm的团块,狭窄肠段近端约30 cm小肠扩张,与周围肠管及系膜粘连,未见肠管扭转坏死,遂行部分小肠切除及肠粘连松解术。
术后病理大体观察:切除小肠57 cm,距远端切缘20 cm处局部肠腔狭窄,狭窄段长约8 cm,此处肠黏膜呈灰褐色伴不规则溃疡及周围黏膜颗粒状增生,肠壁增厚伴肠系膜脂肪结节状增生、包绕,范围约7.0 cm × 7.0 cm × 3.5 cm,见图2C。肠管狭窄处至近端切缘之间肠管扩张、肠壁菲薄,散在肠黏膜糜烂。肠周查见淋巴结18枚,最大径0.5 ~ 2.0 cm。
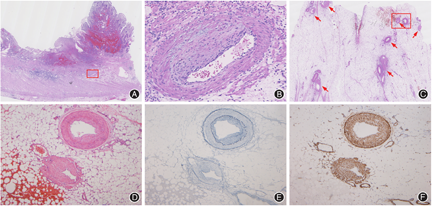
镜下观察:狭窄处小肠可见深达固有肌层的溃疡,同时伴急性浆膜炎和浆膜下层纤维化,溃疡周边肠黏膜示活动性慢性肠炎伴幽门腺化生和假息肉形成,见图3A,部分肠壁黏膜下层消失,并与固有肌层纤维性融合。狭窄区黏膜下层、浆膜下层和肠系膜内多数小至中等大小的静脉管壁异常,表现为静脉内膜平滑肌不规则增生,导致受累静脉管腔狭窄、甚至闭塞,无血管炎、血管内血栓和管壁周围纤维化等改变,伴行动脉无明显异常,见图3B~3D。经广泛取材未见肿瘤、透壁性炎症、肉芽肿等特异性组织学改变,近端扩张肠管示局部黏膜糜烂,肠壁及系膜内血管未见异常。弹力纤维染色显示增生的静脉内膜区域,免疫组化显示静脉内膜平滑肌肌动蛋白(smooth muscle actin,SMA)阳性,见图3E、3F。最终病理诊断为特发性肠系膜静脉肌内膜增生症(idiopathic myointimal hyperplasia of the mesenteric veins,IMHMV)。

术后未采取药物治疗,随访5个月,患者一般情况良好,未见病变复发。
IMHMV是一种罕见的慢性肠壁缺血性病变,通常由肠系膜或肠壁内小至中等大小静脉的非炎症性闭塞所致,其病因和发病机制尚不明确。该病由Genta等[1]于1991年首次提出,目前仅有30余例报道,常发生于中年男性,主要累及乙状结肠和直肠[2,3]。小肠IMHMV罕见,国外报道7例,国内报道1例[4]。临床常表现为反复发作的腹痛、便血等,个别病例可出现与本例相似的进食后腹痛现象[2],病程持续数月至数年不等,部分病例被误诊为IBD且经长期药物治疗未见好转[2]。随着疾病的进展,小肠受累患者常因出现肠道狭窄、梗阻症状前来就诊。患者缺乏潜在基础疾病,亦无自身免疫性疾病、系统性血管炎、药物性肠炎等证据,实验室检查无特殊。影像学检查显示受累肠壁进行性增厚,增强CT可见肠壁水肿性增厚伴周围血管迂曲、扩张[3]。Yun等[5]通过肠系膜下血管造影,显示结肠IMHMV患者肠系膜下静脉远端闭塞伴周围静脉扩张,认为结合肠壁增厚有助于术前诊断IMHMV。内镜下小肠IMHMV常表现为黏膜溃疡、肠壁增厚伴肠腔狭窄等,亦有病例首诊时被误诊为恶性肿瘤[3]。
IMHMV通常在手术切除标本中才能明确诊断,其特征性病理表现是病变区肠壁黏膜下层、固有肌层和肠系膜内小到中等大小静脉的内膜出现平滑肌增生。受累静脉内膜可呈环周性或偏心性肥厚并缺乏血管炎,进一步发展可导致血管腔完全或部分阻塞,从而引起肠壁缺血。免疫组化显示增生的内膜SMA阳性,证实IMHMV是静脉内膜平滑肌增生。弹力纤维染色可显示在增厚的静脉内膜外周残存的弹力纤维[3],部分病例中弹力纤维可因增生内膜的破坏而缺如[6]。在活检标本中,病变表面肠黏膜通常表现为非特异性慢性肠炎或缺血性改变。Yantiss等[7]观察到活检标本中病变区肠黏膜出现毛细血管管壁增厚(动脉化)、透明变性和血管内皮下纤维蛋白样物沉积,有助于IMHMV与其他缺血性病变相鉴别,但本例活检标本未检出上述组织学异常变化。
鉴于多种肠道疾病均可出现类似IMHMV的血管病变,故需要密切结合临床病史、影像和实验室检查进行鉴别。鉴别诊断包括:(1)小肠结肠淋巴细胞性静脉炎(enterocolic lymphocytic phlebitis,ELP)。ELP通常表现为仅累及右半结肠和(或)小肠的孤立性单器官血管炎,由于病灶中部分受累静脉可出现类似IMHMV的管壁平滑肌性增生,导致血管狭窄或闭塞,因此有学者认为两者属于同一疾病谱系,其中IMHMV为ELP的终末阶段[2,8]。然而ELP好发于老年人,常伴有基础疾病,典型病理特征是累及中小口径静脉的淋巴细胞性静脉炎,偶可见新鲜或机化的静脉内血栓,亦可观察到以受累静脉为中心的管壁周围纤维化[8]。而IMHMV发病年龄较轻,缺乏基础疾病,常累及左半结直肠或小肠,病理缺乏血管炎、静脉管周纤维化等可资鉴别。(2)肠系膜动静脉发育不良或血管病。多数病例发生于老年女性,小肠多见,主要病理表现为肠系膜动静脉中膜偏心或中心性平滑肌增生,常破坏动脉壁弹力纤维层,伴有不同程度的内膜增生和外膜纤维化[9]。(3)血管纤维平滑肌发育不良。该病多见于儿童,除累及中等大小血管外,主要波及近端大血管,由于血管狭窄和平滑肌丢失导致动脉缩窄和扩张交替出现,常可在血管造影时观察到"串珠状"改变[7]。(4)发生于小肠的IMHMV还需与CD鉴别。CD亦可出现血管改变,包括血管壁纤维化、中膜肥厚等,但较少出现血管壁平滑肌组织增生,且经广泛取材常显示特征性的透壁性炎症、"跳跃性"黏膜病变和非坏死性上皮样肉芽肿[10]。(5)肠白塞病。通常伴有全身多系统累及,肠道病变可累及全消化道,但以回盲部多见;内镜下典型表现为圆形或卵圆形深凿状溃疡,病理表现主要为小到中等大小血管伴有中性粒细胞或淋巴细胞浸润。此外,有文献报道长期服用氢氯噻嗪和肠溶氯化钾的高血压病患者[11]以及既往接受肠道手术患者的小肠和肠系膜标本中,亦发现类似IMHMV的血管病变,同样的病理改变也见于冠状动脉搭桥手术的大隐静脉移植物中。
小肠IMHMV较为罕见,针对反复治疗无效的炎症性肠道疾病、影像学出现进行性肠壁水肿性增厚伴周围血管扩张,需考虑到IMHMV的可能性,而病理医生则需要通过对活检和手术标本的精细检查给出提示性的诊断和鉴别诊断意见。
所有作者均声明不存在利益冲突



























