
探讨单形性嗜上皮性肠道T细胞淋巴瘤(MEITL)的临床病理特征、诊断及鉴别诊断。
采用描述性病例系列研究方法。回顾性收集中山大学附属第六医院2016年1月至2021年7月收治的13例MEITL的临床资料,对部分病例补充免疫组化检测及EB病毒编码RNA检测(EBER)。分析患者的临床、内镜、影像学、病理特征。
男性8例,女性5例。年龄34~65岁,中位年龄59岁。病变部位:小肠12例,结直肠7例,胃2例。肿瘤单发6例,其中小肠5例,结直肠1例;多发7例,分别是胃+小肠+结直肠2例,小肠+结直肠4例,空肠+回肠1例。5例患者内镜下可见黏膜充血水肿、小溃疡灶、息肉、肠壁狭窄和环周型肿物。11例CT显示胃壁或者肠壁增厚及肿块。肿瘤组织学显示,形态单一的小至中等大小淋巴样细胞弥漫浸润,伴显著嗜上皮性,背景无炎症细胞。免疫组化结果提示,CD56和T细胞胞质内抗原(TIA-1)均为阳性11例,CD4阳性1例,CD8阳性5例,CD4和CD8均阳性1例,CD4和CD8均阴性7例,1例异常表达CD20。12例行EBER检查,均为阴性。13例患者中,6例采用手术切除+化疗,3例采用单纯化疗,2例先采用手术切除但后续治疗不详,1例单纯手术切除,1例治疗方法不详。随访9例,时间1.0~16.1个月,7例死亡,2例存活,余4例失访。
MEITL是罕见的肠道原发的侵袭性T细胞淋巴瘤,预后差。诊断需结合形态学、免疫组化和EBER,同时要与其他淋巴瘤和炎症性肠病进行鉴别诊断。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
非霍奇金淋巴瘤最常见部位是淋巴结,结外也可累及。胃肠道是结外淋巴瘤最常发生的部位,原发胃肠道淋巴瘤占结外非霍奇金淋巴瘤的30%~40%[1]。原发消化道淋巴瘤以胃淋巴瘤为主,发生率达到60%~75%,而小肠仅占到20%[1]。原发消化道淋巴瘤包括B细胞来源和T细胞来源,两组比例为6∶1[2]。单形性嗜上皮性肠道T细胞淋巴瘤(monomorphic epitheliotropic intestinal T-cell lymphoma,MEITL)旧称Ⅱ型肠病相关性T细胞淋巴瘤(enteropathy-associated T-cell lymphoma,EATL),更为少见,不超过非霍奇金淋巴瘤的5%[3]。MEITL预后差,亚洲的多中心研究报道其中位生存时间是7个月,如果不积极治疗,患者将在数月内死于肠穿孔、肠梗阻或肠出血[4]。由于MEITL发生率低,认识有限,诊断和治疗给临床及病理医师带来极大挑战。本文总结13例MEITL的临床特征、内镜及影像学特点、病理学和分子生物学特征,以期提高对MEITL的诊断和鉴别诊断水平。
采用描述性病例系列研究方法。回顾性收集中山大学附属第六医院2016年1月至2021年7月行内镜下活检或外科手术切除后的13例MEITL的临床资料。纳入标准:(1)经病理HE切片、免疫组织化学染色(简称免疫组化)和EB病毒编码RNA(EBER)原位杂交证实,根据2017版WHO淋巴瘤分类标准,诊断为MEITL[5]。(2)有完整临床病理资料。排除标准:有免疫缺陷或移植相关的MEITL。本研究经中山大学附属第六医院医学伦理委员会批准(批准号:2022ZSLYEC-486)。
收集患者性别、年龄、临床表现、疾病部位、影像学检查、内镜检查、治疗方法和预后资料。治疗和预后通过查询电子病历系统或电话访谈获得,随访截止日期为2022年3月。总生存期(OS)定义为从诊断到随访结束的时间间隔或死亡。
所有标本均经10%甲醛固定,常规取材,石蜡包埋,HE染色。
免疫组化采用EnVision二步法,选用抗体CD20、CD3、CD5、CD4、CD8、CD56、T细胞胞质内抗原(T cell intracelluar antigen-1,TIA-1)、颗粒酶B(granzyme B)和Ki-67,所用抗体及EnVision试剂盒均购自福建迈新生物技术开发有限公司和北京中杉金桥生物技术有限公司,严格按照说明书进行操作。免疫组化判读结果:CD20、CD3、CD5、CD4、CD8、CD56阳性定位于细胞膜,TIA-1和颗粒酶B阳性定位于细胞质,Ki-67阳性定位于细胞核,均呈棕褐色。免疫组化结果经2位病理医师复查证实。
所有样本均行EBER原位杂交检测,试剂盒购自河南赛诺特生物技术有限公司,严格按照说明书进行操作,采用辣根过氧化物酶系统,DAB显色。判读结果:EBER定位于细胞核,阳性信号为棕黄色。
采用描述性统计方法,偏态分布的计量资料以中位数和范围表示,计数资料采用例数表示。
13例MEITL患者中,男性8例,女性5例;年龄59(34~65)岁。所有患者均没有乳糜泻病史。病变部位:小肠12例,结直肠7例,胃2例;所有患者均未见消化道以外病变。病变数量:单个部位病变6例,包括小肠5例和结直肠1例;多个部位病变7例,分别为胃+小肠+结直肠2例,小肠+结直肠4例,空肠+回肠1例。临床表现:腹痛8例、腹胀3例、便血2例、恶心呕吐1例、腹泻1例,7例患者伴有B症状(发热、夜间盗汗及体质量减轻),5例患者伴有急腹症,其中4例肠穿孔和1例不完全性肠梗阻。
13例患者中仅5例行内镜检查,表现为黏膜充血水肿、小溃疡灶、息肉、肠壁狭窄和环周型肿物。12例患者行CT检查,结果显示11例胃壁或者肠壁增厚,也可出现肿块,其中3例出现巨大肿块(最大直径大于5 cm);1例肠腔内见软组织密度灶。
9例患者的手术标本中,2例可见病变累及肠周淋巴结。
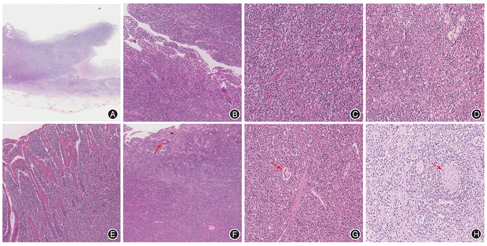
13例患者中,10例在镜下可见溃疡形成(图1A),黏膜腺体破坏减少,非典型淋巴细胞弥漫分布(图1B)。9例患者肿瘤细胞形态均相对比较一致,呈单形性,核小至中等大小,核圆形或稍不规则,深染,可见核仁及核分裂象(图1C)。其中7例患者见不同程度的核碎屑、坏死,个别病例表现大量坏死(图1D)。9例患者可见明显的嗜上皮现象(图1E)。9例患者肿瘤细胞向邻近区域扩散并浸润肠壁全层,肿瘤周边肠黏膜均可见绒毛萎缩(图1F)。5例患者可见血管破坏浸润(图1G)。2例患者可见神经束浸润,其中1例伴神经节细胞增生(图1H)。所有患者背景中炎症细胞均不明显。

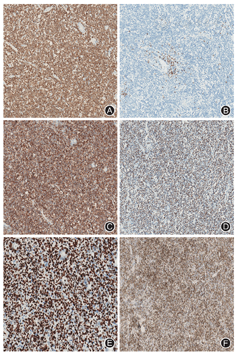
所有患者MEITL肿瘤细胞均表达CD3(图2A),不表达CD5(图2B)。12例患者行CD56、CD4、CD8、CD20、TIA-1、颗粒酶B、Ki-67和EBER检查,其中11例在MEITL代表性标志物CD56(图2C)和TIA-1(图2D)上呈高表达;11例Ki-67增殖指数较高,达到50%~90%(图2E);8例表达颗粒酶B;5例表达CD8;仅1例表达CD4;1例患者出现CD20异常表达(图2F)。12例患者EBER检测均为阴性。

13例患者中,6例采用手术切除+化疗,3例采用单纯化疗,2例先采用手术切除但后续治疗不详,1例单纯手术切除,1例失访,其治疗方法不详。随访9例,时间1.0~16.1个月,其中2例分别存活12个月和8个月,其余7例均在治疗后17个月内死亡。余4例失访。
MEITL是一种罕见的侵袭性外周T细胞淋巴瘤[5]。尽管MEITL与EATL(以前的Ⅰ型EATL)有许多共同的临床和遗传特点,但其具有独特的病理学和流行病学特征,作为一个新疾病整体被重新命名为MEITL[6,7,8]。绝大多数文献报道MEITL与乳糜泻之间没有关联[4,10,11]。然而近期也有报道1例与乳糜泻相关的MEITL[9]。MEITL可见于世界各地,亚洲为主,西方人群较少见[4,10,11]。中国学者分别报道了42例和20例MEITL病例[12,13],其余均为个案报道。MEITL虽然罕见,但其恶性程度高,病死率高,早发现早治疗是提高患者生存的必要条件,掌握其临床病理特征是诊断MEITL的基础。
临床特点:(1)男性多见,发病年龄广泛(23~89岁)。迄今为止最大宗病例系列研究中,中位年龄为58岁[4,10,11]。本组情况与文献基本相符。(2)最常见的发生部位是小肠(尤其是空肠和回肠,占80%~90%),其次是结直肠(<20%)、胃等,也可以发生肝、肺等远处转移[14,15,16,17,18,19,20,21,22]。本研究仅2例累及肠周围淋巴结,均未发生肠外累及。(3)大多数病例表现单发,也可多发。本研究中单发6例,多个部位累及7例,单发、多发比例相当,可能与病例数量较少相关。(4)MEITL一般起病隐匿,无特异性临床表现。Yi等[12]回顾性分析多中心42例MEITL患者,其中腹痛36例(86%),B症状20例(48%),腹泻14例(33%),穿孔12例(29%),出血7例(17%)。Chen等[13]单中心分析20例MEITL病例,其中贫血19例(95%),腹痛17例(85%),肠穿孔10例(50%)。本研究与上述结果相似,大多数患者有腹痛和B症状。(5)该病侵袭性强,进展快,预后差,中位生存时间7个月,1年总生存率仅为36%[4]。本组1例患者及时行手术切除确诊和化疗,存活时间最长(确诊后16.1个月死亡),然而也有1例因多部位累及和仅接受化疗,未行手术切除,在确诊后1个月死亡。
内镜及影像学特点:关于MEITL内镜方面的文献报道比较少见,Hong等[23]、Hideki Ishibashi等[9]和Tian等[24]总结了MEITL在内镜下的特点,大部分表现非特异性肠炎,黏膜充血水肿、有红斑、粗糙、血管纹理消失、细小颗粒样改变、小息肉、浅溃疡、黏膜弥漫增厚和少见明显的肿物改变。结果与本研究相似,同样看到非特异肠炎表现。虽然内镜对于诊断MEITL并非必须,但是对于诊断困难的患者有一定参考意义。本研究CT示大部分患者表现为肠壁增厚、溃疡和肿物,与文献报道类似[25]。
组织学、免疫组化和原位杂交特征:MEITL大体可以表现为单个或多个病变,通常有溃疡形成。镜下表现为形态相对一致的小至中等大小的淋巴细胞样细胞弥漫分布于肠壁全层,核圆形或稍不规则,核仁不明显,淡染或透亮的胞质,核分裂像易见;具有明显的嗜上皮现象,覆盖肿瘤的完整黏膜常表现为绒毛萎缩;肿瘤背景炎症细胞不常见,坏死、核碎屑和血管侵犯不明显。本研究组织病理学改变符合文献报道[12,13],其中7例可见核碎屑、坏死,程度不一,1例可出现非常明显的坏死现象,5例见血管破坏,4例同时有坏死和血管破坏,但是形态学、免疫组化、EBER及基因检测结果均支持诊断MEITL。此外,个别文献报道出现小细胞和中等至大细胞[26],但是免疫组化及分子生物学均支持MEITL。免疫组化常常表达CD2、CD3、CD7、CD8、CD56、CD103和巨核细胞相关酪氨酸激酶(megakaryocyte-associated tyrosine kinase,MATK),不表达CD5、CD4和CD30。大多数患者表达细胞毒性标志物TIA-1,而颗粒酶B和穿孔素的表达会相对少一些,表面受体T细胞受体(T-cell receptor,TCR)或TCRβ常见表达。本研究中12例表达CD56,免疫组化符合既往文献[4,10,11,13]。所有病例均不表达EBER,但报道3例表达EBER[27],近80%的患者有TCR-Γ和δ基因重排[28]。
诊断:由于MEITL缺乏特异性诊断标准,需要结合临床、内镜、影像、组织学、免疫组化和EBER,有时还需要结合基因检测进行综合分析。MEITL诊断要点如下:(1)老年男性,临床上常常出现急腹症(肠穿孔、肠梗阻或肠出血)就诊;(2)内镜和影像学常常见到小肠多处病变;(3)组织学形态相对一致的小至中等大小淋巴样细胞和明显的嗜上皮特征;(4)免疫组化表达CD3、CD8、CD56和TIA-1;(5)EBER阴性;(6)必要时,行T细胞基因测序,观察是否重排。对于切除的标本诊断相对容易,活检标本由于获取组织有限,又易受溃疡和坏死组织影响,与其他疾病不易鉴别,因而难以得出正确诊断。
鉴别诊断:MEITL在临床特征和病理学上需与以下疾病相鉴别。(1)EATL:EATL往往有乳糜泻相关病史,组织细胞形态多形,中等至大,没有明显的嗜表皮现象,免疫组化不表达CD8、CD56和MATK,而MEITL恰恰相反。(2)炎症性肠病:两者具有相同的临床表现、内镜特征和组织学表现,易误诊,特别在病史较长、活检取材不充分的情况下,更容易导致误诊。炎症性肠病病变相对表浅,无明显的异型淋巴细胞浸润黏膜层及黏膜下层,很少累及肌层,可见隐窝炎及隐窝脓肿,不破坏黏膜及腺体上皮,无明显的嗜表皮现象,免疫组化和基因重排可将两者区分开来。(3)黏膜相关结外边缘区淋巴瘤(extranodal marginal zone lymphoma of mucosa-associated lymphoid tissue,MALT淋巴瘤):对于内镜下取的活检标本,若表现出一致的小至中等大小淋巴样细胞,具有明显的嗜表皮现象,需要与MALT淋巴瘤进行鉴别。MALT淋巴瘤表达B细胞源性标记和B细胞基因重排,而MEITL表达T细胞标记,两者起源有本质不同。(4)胃肠道惰性T淋巴细胞增殖性疾病(indolent T-cell lymphoproliferative disorder of the gastrointestinal tract,GI-ITLPD):GI-ITLPD镜下为形态表现一致的小细胞,无明显多形性,常常不表达CD56,个别病例报道CD56阳性,Ki-67增殖指数低,一般不超过10%,而MEITL往往呈CD56阳性,Ki-67增殖指数高,另外内镜特征和临床过程也与GI-ITLPD不一致。(5)结外NK/T细胞淋巴瘤,鼻型(extranodal NK/T-cell lymphoma of the nasal type,ENKTL):ENKTL组织学形态可以表现出细胞小至中等且形态单一,血管破坏和坏死不明显,与MEITL在免疫组化存在较大程度的重叠,特别对于CD56阳性的ENKTL,易误诊。最关键的鉴别点是MEITL检测不到EBER,而ENKTL呈阳性。另外,ENKTL大多数是NK细胞表型,检测不到T细胞基因重排,而MEITL常常能够检测到。(6)间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL):ALCL形态具有多变性,可以表现出小细胞形态。对于ALK阴性的小细胞变异型ALCL,很难与MEITL进行鉴别。ALCL常常表达CD30,不表达MATK,而MEITL一般不表达CD30。(7)外周T细胞淋巴瘤,非特指(peripheral T-cell lymphoma,not otherwise specified,PTCL-NOS):PTCL-NOS作为一种排除性诊断,其组织学形态和免疫组化表现不一。肿瘤细胞表现多形性,大小不等,背景中较多嗜酸性粒细胞、组织细胞和浆细胞,而MEITL表现形态一致的小至中等细胞,明显的嗜表皮现象和典型的免疫组化、分子学特征(CD3+、CD8+、CD56+、CD5-、CD4-、TIA-1+、颗粒酶B-和EBER-)。
目前,关于MEITL的治疗尚无统一标准,环磷酰胺+多柔比星+长春新碱+泼尼松(CHOP)方案通常作为一线治疗,由于其常常伴有急腹症,需要紧急手术治疗。在亚洲MEITL系列报道中,72%的患者接受了化疗,而58%的患者同时接受了手术和化疗,尽管如此,患者中位生存时间仅7个月[4],预后差,生存时间短。然而,接受造血干细胞移植(hematopoietic stem cell transplantation,HSCT)的患者有更高的存活率。因此,HSCT应被视为一种合适的巩固治疗,特别是当自体HSCT没有骨髓浸润时,该方法更适合大多数MEITL患者。
综上所述,MEITL是肠道原发的侵袭性T细胞淋巴瘤,发病率低,侵袭性高,预后差。临床表现和组织形态学多样,然而目前大部分病理和临床医生对MEITL的诊断缺乏经验,易与其他肠道T细胞淋巴瘤和炎症性肠病相混淆,导致误诊和漏诊,因此诊断时需综合其临床特征、组织病理学形态、免疫表型和分子学特征等。本研究尚存在不足之处,病例数少,同时鉴于回顾性研究,部分患者出院后失访,无法完全掌握预后情况,期待未来有更多大样本研究进一步探讨病因、病理机制,提高疾病诊断水平。
所有作者均声明不存在利益冲突



























