
内镜检查对炎症性肠病(IBD)患者的诊断和监测具有十分重要的意义。目前传统内镜评分如克罗恩病内镜下严重程度指数、简化克罗恩病内镜评分、溃疡性结肠炎内镜下严重程度指数、Mayo内镜评分等,在临床应用均存在一定的局限性。近年来学者不断开发应用新型内镜评分,评价效果有待观察。本文将以多伦多IBD整体内镜报告(TIGER)评分、改良Mayo内镜评分等新型评分为例,重点分析传统和新型IBD内镜评分的临床应用及优劣势,为临床实践提供有效的评分依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
炎症性肠病(inflammatory bowel disease,IBD)主要包括克罗恩病(Crohn′s disease,CD)及溃疡性结肠炎(ulcerative colitis,UC),是一种慢性反复性肠道炎性疾病。消化内镜对IBD的诊断和鉴别诊断、疾病活动评估及疗效监测等十分重要。规范的IBD内镜评分能够实现报告标准化、可重复和统一性,是临床实践和研究的重要组成部分。目前传统评分包括克罗恩病内镜下严重程度指数(Crohn′s disease endoscopic index of severity,CDEIS)、简化克罗恩病内镜下评分(simple endoscopic score for Crohn′s disease,SES-CD)、溃疡性结肠炎内镜下严重程度指数(ulcerative colitis endoscopic index of severity,UCEIS)、Mayo内镜评分(Mayo endoscopic score,MES)等,但这些评分存在不同程度的复杂性以及无法准确判断疾病严重程度等局限性。近年来出现了不少新型内镜评分,例如改良Mayo内镜评分(modified Mayo endoscopic score,MMES)、多伦多IBD整体内镜报告(Toronto IBD global endoscopic reporting,TIGER)评分等,这些评分效果还有待进一步观察。本文将对比传统和新型IBD内镜评分的应用情况,为临床实践提供指导。
CDEIS由消化炎性疾病治疗研究组于1989年经过多阶段前瞻性研究提出,是第1个经过验证的反映CD严重程度的内镜评分[1]。CDEIS基于5个部位(末段回肠、右半结肠、横结肠、左半和乙状结肠、直肠)的4个参数(深溃疡,浅溃疡,表面受累范围,溃疡累及范围)进行评估,在单个节段的总分除以评估节段的数量后,加上是否存在狭窄得出范围在0 ~ 44分的总分,但无明确的黏膜愈合定义,见表1。更新版IBD治疗目标的选择(the Selecting Therapeutic Targets in Inflammatory Bowel Disease,STRIDE-Ⅱ)共识推荐,内镜应答是指CDEIS评分下降>50%,内镜缓解是CDEIS总分<3分[2]。目前CDEIS评分已被用于多项研究工作,并可作为临床试验的疗效终点。
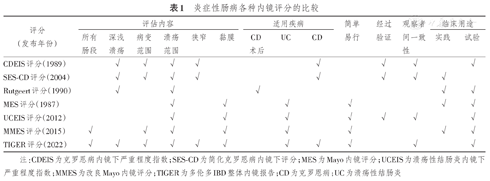
炎症性肠病各种内镜评分的比较
炎症性肠病各种内镜评分的比较
| 评分(发布年份) | 评估内容 | 适用疾病 | 简单易行 | 经过验证 | 观察者间一致性 | 临床用途 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 所有肠段 | 深浅溃疡 | 病变范围 | 溃疡范围 | 狭窄 | 黏膜 | CD术后 | UC | CD | 实践 | 试验 | ||||
| CDEIS评分(1989) | √ | √ | √ | √ | √ | √ | √ | √ | ||||||
| SES-CD评分(2004) | √ | √ | √ | √ | √ | √ | √ | √ | ||||||
| Rutgeert评分(1990) | √ | √ | √ | √ | √ | |||||||||
| MES评分(1987) | √ | √ | √ | √ | √ | √ | ||||||||
| UCEIS评分(2012) | √ | √ | √ | √ | √ | √ | √ | |||||||
| MMES评分(2015) | √ | √ | √ | √ | √ | √ | √ | √ | ||||||
| TIGER评分(2022) | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
注:CDEIS为克罗恩病内镜下严重程度指数;SES-CD为简化克罗恩病内镜下评分;MES为Mayo内镜评分;UCEIS为溃疡性结肠炎内镜下严重程度指数;MMES为改良Mayo内镜评分;TIGER为多伦多IBD整体内镜报告;CD为克罗恩病;UC为溃疡性结肠炎
CDEIS的局限性:(1)需要2位内镜医师同时进行评分,可能会影响观察者间的独立性;(2)未纳入疾病的某些重要部分,如吻合口狭窄或手术相关的内容;(3)CDEIS每个特征都是单独计算,权重不同使计算存在复杂性;(4)疾病严重程度所对应的评分阈值尚未被准确定义,不同的研究提出不同的阈值范围[3,4,5]。这些都限制了CDEIS的广泛使用。
为了简化CDEIS评分,2004年由Daperno等[6]提出SES-CD评分。SES-CD评分沿用CDEIS评分的4个参数,另外将肠段重新分为5段,即回肠、右半结肠(回盲瓣、盲肠和升结肠至肝曲)、横结肠、左半结肠(降结肠至脾曲和乙状结肠)和直肠;每个肠段均单独计算分值,5个肠段所有参数的总和为0 ~ 56分[6]。既往2项研究证实轻度活动为3 ~ 6分,中度活动为7 ~ 16分,重度活动为>16分[5,7]。STRIDE-Ⅱ共识推荐内镜应答是指SES-CD评分下降>50%;内镜缓解是SES-CD评分≤2分且无溃疡(包括口疮性溃疡在内的任何溃疡)。虽然SES-CD评分与CD活动性之间的关系尚未明确,但研究证实该评分与CD严重程度具有良好的观察者间一致性[7];SES-CD评分与CDEIS评分从基线到检查随访均具有良好的相关性[8]。鉴于上述优点以及应用的便利性,SES-CD评分已逐渐用于临床研究和实践。
SES-CD评分局限性:(1)虽然与CDEIS评分相比,SES-CD评分的计算量明显减少,但在实践中仍然可能比较复杂和耗时[9]。(2)SES-CD评分没有考虑到内镜不能观察到的肠段及手术切除的肠段。如果所有节段都表现出轻微的疾病活动,加分计算后则可能获得比单独一个节段出现严重病变更高的SES-CD评分,这可能对疾病严重程度的评估以及后续的治疗产生较大影响[7]。(3)黏膜瘢痕和假息肉等内镜特征对结直肠癌具有预后价值,但上述2种评分均未考虑在内。
Rutgeerts评分是唯一用于评估CD术后新末端回肠内镜下复发风险的评分系统,广泛用于临床实践和试验[10]。该评分包括疾病复发严重程度i0(正常)到i4(严重)的5个等级,根据新末端回肠溃疡的数量和性质进行评估。STRIDE-Ⅱ共识推荐内镜缓解定义为Rutgeerts评分≤i1。
Rutgeerts评分仅适用于评估回结肠切除术后新末端回肠和吻合口的炎症改变,未能考虑到回肠中段等其他肠段疾病的新进展,也不能用于随访药物治疗后疾病的改善。因此,在术后内镜评估中,除Rutgeerts评分外,其他肠段的病变仍需借助SES-CD或CDEIS进行评分。
MES是迄今为止临床试验中最广泛用于描述内镜活动的评分系统,包括五个方面,评分范围从0分(正常黏膜)到3分(严重疾病)[11,12]。MES黏膜愈合的定义为总分0或1分。研究已验证总分0 ~ 1分的患者的长期结局显著优于总分2或3分的患者,结肠切除风险更低[2]。
MES的主要局限在于仅有4个等级来区分UC内镜下炎症和病变程度,可能无法准确反映内镜黏膜外观的差异,也可能无法正确描述糜烂、溃疡或黏膜改变,观察者之间存在广泛差异。此外"黏膜愈合"的定义虽然常用,但尚未得到验证。越来越多的证据表明,MES=0分和MES=1分的UC患者之间临床结果不尽相同[13,14]。因此,目前更建议将MES=0分作为UC的治疗目标,作为UC内镜下黏膜愈合的定义。
为更好地定义UC内镜活动,2012年Travis等[15]提出了UCEIS,并通过独立队列研究验证其可靠性[16]。UCEIS评估指标包括三部分,每项指标分为3 ~ 4个等级,根据严重程度评分递增(0 ~ 8分),因此,它可能比MES更能准确地反映疾病严重程度和症状的变化[17]。同时UCEIS也被证明可以减少观察者之间的差异[15,18]。STRIDE-Ⅱ共识推荐内镜缓解目标是UCEIS总分≤1分[2]。目前判断疾病严重程度的潜在阈值尚未明确,研究建议将UCEIS≥4分作为考虑治疗升级的标准[19]。同时,有研究显示UCEIS判断UC预后的能力优于MES[20,21]。尽管UCEIS具有很高的可靠性和实用性,但尚未在临床实践中广泛应用。
UCEIS的局限性在于没有记录病变的范围,缺少黏膜愈合的定义,也未能明确针对轻度、中度或重度疾病的有效阈值。
为将黏膜炎症程度纳入MES评分中,Lobatón等[22]提出了MMES。MMES评分计算5个结肠段的MES评分总和,并与具有活动性炎症的结肠段数量相结合,改良了原有的评分体系。研究显示MMES评分与粪钙卫蛋白、临床指标和组织学评分显著相关[22,23]。
MMES的主要优势:(1)考虑了不同肠段的疾病活动程度,创新性地评估部分黏膜的愈合程度,从而有助于临床医生开展针对性管理[22]。对于直肠型或左半结肠型患者,乙状结肠镜检查足以计算MMES得分。(2)MMES的计算是基于大家熟知的MES评分,并未引入复杂的新变量,更简单易行。(3)MMES与临床、生化指标和组织学活动指标的相关性较好。由于其简单性以及与多种疾病活动参数的相关性,MMES不仅适用于临床试验,而且是日常临床实践中有前景和可行的评分工具。
当然,MMES仍有一些局限性:(1)该方法尚未得到验证,也没有评估观察者之间的一致性。(2)大多数患者来源于门诊,因此较高比例的患者处于临床和内镜缓解期。(3)MMES的计算是在内镜活动的最大范围内完成的,因此未能反映节段性结肠炎的影响。未来还需进一步研究改善该评分的局限性,以扩展其UC患者中的应用,同时还需要进行具有中心阅片的多中心前瞻性队列研究来验证MMES以及评估部分黏膜愈合对患者临床结局的价值。
对于内镜下难以区分的未定型炎症性肠病(inflammatory bowel disease unclassified,IBDU),如何评估以及采用何种评分尚无一致意见。因此,临床需要采用同一种内镜评分对CD、UC和IBDU的黏膜进行评估,以便简化和统一。TIGER评分是一种改进的内镜黏膜评分工具,其独特之处在于可以对疾病的严重程度进行全面评估。该评分基于一项纳入了40例不同内镜疾病活动性IBD患者的横断面队列研究,纳入了MES评分中的"黏膜一般外观",同时也纳入SES-CD评分的4个变量,对每个肠段进行评分,这样既可以评估CD也可以评估UC[24]。研究显示TIGER评分与粪钙卫蛋白(UC中的相关性强于CD)、C-反应蛋白(仅CD)和IBD残疾指数显著相关[25]。对同一病变进行评估时,TIGER评分与MES和SES-CD之间存在明显的一致性。此外,TIGER评分不为没有炎症或溃疡的狭窄加分。纤维性狭窄常表现为轻度或无活动性炎症,这些狭窄是由以前的炎症反应引起的,治疗上与严重的炎性狭窄不同。
TIGER评分较传统评分具有许多优势:(1)TIGER评分纳入了所有可观察到的肠段,这是UC内镜评分的进步。同时TIGER评分考虑了病变范围,且易于计算。(2)与SES-CD相比,TIGER评分对于中度以上内镜活动肠段有额外加分,这可以立即区分出单个严重受累肠段与几个轻度弥漫受累肠段的差别,这也可能具有额外的预后价值,因为CD患者溃疡大小,特别是回肠和直肠溃疡大小与内镜缓解的可能性更加相关[26]。(3)TIGER评分还提供了关于疾病程度和疾病负担的关键信息,能够更精确地描述疾病的严重程度。(4)在计算疾病严重程度的总体评分时,TIGER评分能够区分炎性和纤维性狭窄。(5)TIGER评分是第1个可以为CD、UC、IBDU患者同时提供内镜评分的系统。(6)评分相对简单,有助于在日常临床实践中广泛使用。
当然,TIGER评分也存在一定的局限性:(1)该评分为单中心研究,样本量偏少,对CD管腔狭窄的评估具有较低的观察者间可靠性[7,27]。(2)由于SES-CD评分严重程度阈值尚未得到完全验证,使得借鉴SES-CD评分的TIGER评分也需验证。未来应进一步研究狭窄对TIGER评分的影响以及TIGER评分的预测价值等。
综上,传统的IBD内镜评分系统相对复杂,且在检查部位和疾病类型方面具有局限性。新型IBD内镜评分系统如TIGER或MMES评分带来更简单且相对完善的内镜评估,值得在临床实践中进一步探讨。目前可用的评分在内镜评估中已经实现了一定的标准化,但仍然存在很多问题,例如尚未经过有效性验证、无法评估狭窄肠道、不能确定病变严重程度阈值等。因此,迫切需要一种经过验证的、阈值明确、便捷的内镜评分,能够准确地评估IBD的疾病活动,进一步提高临床诊疗水平,使更多患者受益。
所有作者均声明不存在利益冲突



























