
随着靶向、免疫等新治疗方法的出现,系统肿瘤诊治水平不断提高。这一方面带来患者生存期延长,但同时中枢神经系统转移肿瘤发病率上升。脑转移瘤的治疗决策,除了和原发肿瘤类型相关外,一个重要依据就是病灶数目。MRI已成为显示脑转移瘤首选检查方法,但显示病灶能力、数目和很多因素相关。标准化的影像检查,不仅能提高诊断准确性,更能为患者治疗决策和评估提供最直观和可靠的依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脑转移瘤是脑内最常见肿瘤,发病率远远高于原发脑肿瘤,统计发现癌症患者终生脑转移瘤发生率为10%~30%。国外报道原发肿瘤最常见依次为肺癌、乳腺癌和黑色素瘤,脑转移发生率分别为40%~50%、15%~20%、5%~20%[1]。以往认为癌症患者发生脑转移提示晚期及预后不良,但随着分子检测技术的进步及带来的相应靶向治疗、免疫治疗、局部立体定向放射外科治疗的进步,肺癌、乳腺癌、黑色素瘤等脑转移瘤的预后均得到明显改善[1]。
脑转移瘤近年来发病率有增高趋势,推测和系统肿瘤疗效的提高带来的患者生存获益有一定关系,并因此促进了对脑转移瘤的关注和其诊治的研究进展。国际、国内关于脑转移瘤的诊治也在逐步规范[2]。
2006年以前,脑转移瘤的影像评价大部分依据CT成像。随着MRI的普及应用,美国NCCN指南已明确要求把MRI作为脑肿瘤治疗前后评价的首选影像检查方法。2015年,国际上第一个脑肿瘤标准影像检查专家共识(简称BTIP)发布[3]。2020年,依据BTIP拓展的脑转移瘤影像检查专家共识(简称BTIP-BM)发表[1]。国内近年也发表了一些脑转移瘤相关专家共识,如《中国肺癌脑转移诊治专家共识(2017年版)》、《驱动基因阳性非小细胞肺癌脑转移诊治上海专家共识(2019年版)》、2019年CNS《成人脑转移瘤新型及试验性疗法的循证指南》以及《中国结直肠癌脑转移多学科综合治疗专家共识(2020版)》,但其中对MRI标准化检查尚没有提及确切要求[4,5,6,7]。
脑转移瘤的影像评价包含二部分,一是首诊病灶检测,二是病灶治疗后反应评价。前者主要关注转移瘤诊断,需要明确病灶数目、大小;后者需要准确评估病灶变化,这对药物或放疗的疗效评价及指导下一步治疗策略均有重要价值。
结合临床实践和文献复习,目前在脑转移瘤影像评价中需关注的关键问题主要有3个:一是病灶数目的准确检测;二是小病灶检出,这也决定了前述的转移瘤数目检出的准确性;三是鉴别治疗反应和肿瘤进展。针对上述需求,BTIP-BM专家共识中提出建议进行标准化MRI扫描。对照标准化MRI扫描的具体要求,笔者认为国内大多数医院可以做到,并因此推荐,以逐渐提高我国转移瘤诊治的规范化评估。
总体来说3T优于1.5T机器,尤其在小病灶检出方面。但是,由于RANO标准评估疗效时要求选择测量的脑转移瘤靶病灶必须是≥10mm病灶,而在≥10mm病灶的检出方面3T和1.5T机器没有明显差异;同时,对于需要进行立体定向放射外科治疗患者,3T图像变形会导致潜在放疗定位偏移,有作者认为1.5T对脑转移瘤评估可接受[8,9,10]。
MRI检查序列的选择,BTIP-BM提出一个分层的检查建议,即最低标准检查序列(minimum standard)和优化检查序列("ideal"protocol),详见表1、表2和图1、图2。

最低标准检查序列
最低标准检查序列
| 项目 | 3D T1 | 2D Flair | 2D DWI | 2D T2a | 2D T1a | 3D T1a |
|---|---|---|---|---|---|---|
| 指南 | GRE | TSE | EPI | TSE | TSE/SE | IR-GRE |
| 矢状面或横断面 | 横断面 | 横断面 | 横断面 | 横和/或冠状面 | 矢状面或横断面 | |
| 作者单位实践 | 2D/横断面 | 横断面 | 横断面 |
注:a注射造影剂

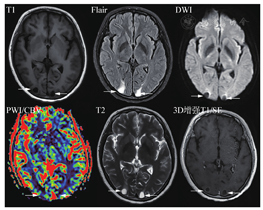
优化检查序序列
优化检查序序列
| 项目 | 3D T1 | 2D Flair | 2D DWI | DSC Perfusion(可选)a | 2D T2a | 3D T1a |
|---|---|---|---|---|---|---|
| 指南 | TSE | TSE | EPI | GE-EPI | TSE | TSE |
| 矢状面或横断面 | 横断面 | 横断面 | 横断面 | 横断面 | 矢状面或横断面 | |
| 作者单位实践 | 2D/横断面 | 横断面 |
注:a注射造影剂
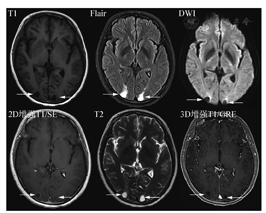


最低标准中,核心是强调了薄层扫描。3D是各向同性块扫描,重建后的单层图像可达到1mm或者0.6mm薄层厚度。共识建议3D扫描,如果不能进行3D扫描,2D扫描层厚要求是3mm;在序列选择方面,首选SE序列。SE是经典MRI序列,病灶显示度高,但扫描时间略长。如果不能进行增强后3DSE序列扫描而使用了3DGRE序列扫描(优点是快,缺点是由于白质信号增高而导致病灶对比度不够,皮质浅表病灶显示差,由于不能附加压脂导致颅骨转移瘤显示差,以及亮血效应带来的脑沟内血管过度显示),建议增加一个增强后2DSE序列。各序列实例比较见图2。
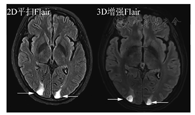
另外,DWI由于非常有诊断价值和扫描时间短,建议始终放在平扫序列里。而注射造影剂前的平扫中,只扫Flair序列,T2放在增强后扫描。优化标准中,主要增加了DSC灌注扫描(可能对鉴别肿瘤复发和放射性坏死有用)、增强后Flair(显示软脑膜转移病变较常规增强T1MRI效果好)以及增强后长时间延迟扫描(60~105 min,以期显示小病灶)。关于增强后Flair序列,对于脑膜转移的增强显示能力已被认可。对于脑实质内的转移瘤病灶,并不能增加诊断信息,但是对于靠近皮质的表浅病灶,显示能力超过常规增强T1,详见图3、图4。不同MR扫描机的序列名称不同,但序列的本质一致。


目前使用的MR对比剂均为钆的螯合物。不同厂家造影剂有弛豫率方面的一些差异,但不影响诊断效能。尽管双倍或三倍剂量可以提高病灶显示程度,考虑到钆可能在体内沉积和肾纤维化风险,共识只推荐单倍剂量,但强调在注射造影剂后扫描DSC PWI和T2,然后再扫描增强T1,相当于一定程度的延迟扫描,使病灶显示更明显。
在常规MRI扫描中,最低标准要求在注射造影剂后,插入一个T2序列,即不影响T2图像上病灶的显示,又能获得充分的病灶"强化"时间。优化序列中在注射造影剂后最先行DSC扫描,然后是T2扫描,最后是增强后T1以及后续不同时间的延迟扫描。笔者的实践体会是,首先,增强后短时间内T2图像和平扫T2图像显示的信息一致,不影响诊断;其次,DSC由于分辨率及变形问题,对非实性大病灶提供的增加诊断价值有限(图5);最后,转移瘤在DSC和T2后的增强T1扫描图像上,无论大小,基本都已显示,延迟扫描并不增加影响决策的诊断信息。
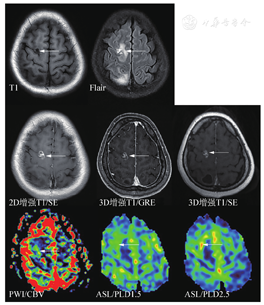

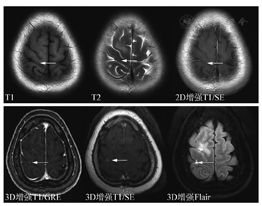
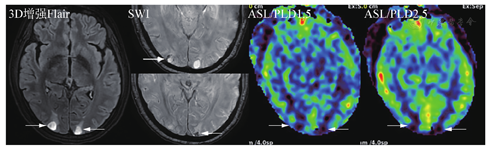
为了增加诊断信息和科研需求,可依据实际情况选择额外MRI序列,包括SWI、ASL及前面提到的增强后Flair等(图6)。笔者体会是转移瘤出血非常常见,常规MRI一些序列也可以分辨,但SWI显示更好。ASL的价值也有很多研究报道,转移瘤因瘤内成分不同而显示高、低灌注或混杂信号,在以囊性为主病灶中分辨率有限。但在鉴别转移瘤和非肿瘤病变中有价值,ASL值得推荐。但ASL扫描时间较长,且图像有变形,解读时以黑白图像评估可能更可靠。

GRE序列增强,由于不能附加压脂,会导致遗漏颅骨转移病灶,因此也是共识建议增强后增加一个2DSE序列的理由。但平扫DWI序列中附加了压脂,颅骨转移瘤一般平扫中会引起怀疑。
关于软脑膜转移,常规增强T1SE序列常难以发现,GRE序列由于血管增强效应,会导致脑沟内多发的条状或者点状高信号,即高估效应,带来假脑膜转移瘤征象。近年来,增强后Flair序列在显示脑膜转移瘤方面显示出一定优势,尤其在一定时间的延迟后,更可以确认脑膜转移的有无,从而准确评估预后和制定治疗决策。
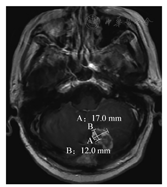
采用2015年发布的RANO-BM建议,依据2009年发布的RECIST1.1标准,评估中只测量脑实质内转移病灶,基线测量时靶病灶总数最多5个,可测量靶病灶需要实性强化最大单径≥10mm,不包括囊和腔[11],见图7。

MRI增强扫描在各种治疗后会在不同时间点出现原有病灶的强化增加或出现新的强化灶,使用常规CT或MRI鉴别治疗反应还是肿瘤复发常常存在困难。CT、MRI灌注成像,肿瘤复发多呈现血流增加,表现为高灌注,而放疗后坏死多呈低灌注。但是一部分患者放疗后短期或免疫治疗后,病灶对治疗反应复杂多样,病灶内部可能包含不同程度的炎症、血管反应等,也会造成灌注的异常增高或减低。
目前CT、MRI灌注成像鉴别二者的价值尚未得到充分验证。PET可以增加诊断信息,尤其标记氨基酸示踪剂的PET-CT在肿瘤复发病灶中多呈高代谢,但也存在假阳性,解读时需要综合考虑。
对免疫治疗后的患者进行评估时,RANO标准认为,治疗后6个月内如果显示MRI强化增加或者出现新强化灶,需再等待3个月后复查MRI来验证,即以MRI比较病灶改变,并结合临床,决策下一步治疗方案[12]。
本人与其他作者宣称没有任何利益冲突,未接受任何不当的职务或财务利益



























