
胸腺瘤是起源于胸腺上皮细胞的肿瘤,是一种具有良性细胞学特征、恶性生物学行为的肿瘤,国内外文献有对胸腺瘤远处转移的报道,常见的转移部位有肺、肝、纵隔等,发生于腹壁的转移罕见报道,且没有有效的治疗方法。本文就1例B2/B3混合型胸腺瘤腹壁转移病例进行报告,并回顾国内外相关文献报道,总结晚期转移性胸腺瘤的治疗方法。通过对腹壁转移灶的放疗,联合GM-CSF的应用,患者腹壁病灶退缩明显且不良反应轻微。该病例为合并肌无力的晚期转移性胸腺瘤的患者提供了新的治疗手段。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胸腺瘤是起源于胸腺上皮细胞的肿瘤,好发于前上纵隔,是一种具有良性细胞学特征、恶性生物学行为的肿瘤。因该病属于一种惰性肿瘤,一般生长缓慢,即便疾病进展患者的生存期仍相对较长[1]。国内外文献也有对胸腺瘤远处转移的报道,常见的转移部位有肺、肝脏、纵隔等[2],发生于腹壁转移的罕见报道。
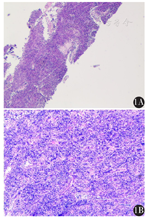
患者女,43岁,汉族,农民。2013年3月9日因"双上肢无力10天伴双眼睑上抬、闭合无力3天"就诊我院神经内科。查胸部CT:前纵隔不规则囊实性密度影,大小约6.7 cm×3.3 cm×7.5 cm,呈分叶状外观,局部与升主动脉分界欠清,考虑胸腺瘤可能性大。2013年3月20日于胸外科行全麻下胸腺瘤切除术。术中见腺体内多发囊性变,融合成团,上极呈囊性,下极分两叶;右侧约4 cm×4 cm×4 cm,左侧约4 cm×3 cm×3 cm,边界不清;右侧叶包膜尚完整,左侧叶侵及心包、胸膜、左上肺叶;因将膈神经包裹在内,遂改行胸腺瘤扩大切除+左上肺楔形切除术。术后病理:胸腺瘤(B2/B3混合型),侵犯肺组织(图1A),术后分期为胸腺瘤(B2/B3混合型,Masaoka Ⅲ期,肺)。术后予以瘤床区放疗60 Gy分30次。术后定期复查。

2016年6月15日查胸部CT示:胸腺瘤术后、放疗后,左肺结节影,左侧胸膜局部增厚。2016年8月8日复查胸部CT示:左肺结节影较前增大,考虑转移。2016年8月16日于当地医院行左肺病灶伽玛刀治疗。2016年9月20日查胸部CT示:左肺结节较2016年8月8日片明显缩小。2016年9月22日至2017年2月4日予以DP方案(多西他赛120 mg第1天+奈达铂30 mg第1-4天)化疗6个周期,期间定期复查左肺病灶稳定。2017年12月5日查胸部CT示:左上腹、近肝左叶左侧腹壁占位,大小约23.8 mm×8.5 mm。未予特殊重视。后定期复查,腹壁包块渐进增大,患者无特殊不适主诉。2019年10月6日查腹部彩超示:左上腹腹壁低回声实质性包块,大小约3.9 cm×4.0 cm×6.1 cm,界限可辨,血流丰富。胸部CT示:肝左叶旁左侧腹壁不规则软组织密度影,宽基底贴近腹壁,大小约5.6 cm×2.8 cm,增强后强化不均匀(图4A)。门诊以"左侧腹壁肿块待查"收入我科,入院诊断:①左侧腹壁肿块待查;②胸腺瘤(B2/B3混合型,Masaoka Ⅳ期,肺内);③重症肌无力(眼睑型)。
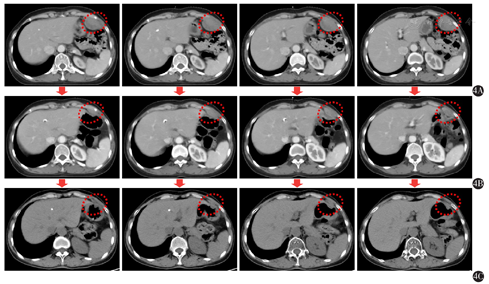

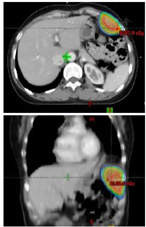
入院后于2019年10月11日行彩超引导下左上腹壁包块穿刺活检术。术后病理示:(左上腹腹壁)肿瘤细胞呈圆形,卵圆形。免疫组化:(左上腹腹壁)肿瘤细胞TDT(+),CD5(+),CKpan(+),Ki-67(+,约30%),p53(+,约10%),CD56(-),CgA(-),Syn(-),CD20(-)。结合HE切片及病史,考虑为胸腺瘤转移(图1B)。患者及家属拒绝手术治疗及化疗,于2019年10月23日起予以左上腹壁转移灶姑息放疗(图2),GTV为影像学所示左侧腹壁转移灶,PGTV为GTV外放0.5 cm。第1阶段:GTV 3.0 Gy/次,共16次;PGTV 2.0 Gy/次,共16次;二次定位提示腹壁转移灶较前明显退缩(图4B),予以缩野加量。第2阶段:PGTV-new:2.0 Gy/次,共10次。

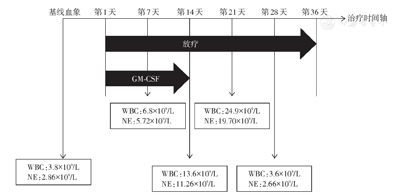
放疗第1天开始予以重组人粒细胞-巨噬细胞集落刺激因子(recombinant human granulocytic-macrophage colony-stimulating factor,rhGM-CSF)(商品名:特尔立,厂家:厦门特宝生物工程股份有限公司),皮下注射200 μg,第1-14天。治疗期间每周监测血常规变化,如图3。放疗期间并无明显发热、皮疹、肌痛、骨痛等不良反应。放疗结束后每3个月复查1次,采用实体瘤治疗疗效评价标准1.1标准评价疗效为部分缓解。末次复查时间2020年9月24日,即放疗后10个月,腹壁转移灶仍稳定且并无新发病灶,部分缓解维持时间为10个月且仍在持续(图4)。

胸腺瘤为最常见的纵隔肿瘤之一,在中国的发病率约为3.93/100万[1],是一种具有良性生物学特征、恶性生物学行为的肿瘤。常发生于40~70岁成人,儿童及青少年少见;常见症状包括胸痛、咳嗽、呼吸困难等,常伴有重症肌无力、红细胞发育不良、低丙种球蛋白白血病等副瘤综合征[3]。
根据WHO2015分型系统分为A、AB、B1、B2、B3和C型,其中A、AB、B1型的预后好于B2、B3型;分期有Masaoka-Koga分期和TNM分期,临床常用Masaoka-Koga分期[4,5]。胸腺瘤的病因至今尚不明确,可能与宿主自身免疫紊乱、基因易感性及遗传有一定关系[2]。胸腺瘤的预后与病理类型、包膜及周围器官侵犯、手术切除程度及远处转移有关,目前认为胸腺瘤因具有潜在恶性,各种组织类型及各期的胸腺瘤均可能发生远处转移,局部浸润或胸内转移常见,经血道及淋巴道转移少见。一旦确诊应尽早手术治疗,根据临床分期和组织学分型,术后辅以放疗或化疗。本例患者系中年女性,2017年12月发现腹壁占位,未予特殊处理,定期复查发现腹壁病灶缓慢进展;因患者拒绝再次外科手术治疗,对于局部晚期和转移性胸腺瘤、不具备手术条件及拒绝手术者,非手术治疗就成了必然选择。目前可选择的非手术治疗方法包括放疗、化疗、靶向治疗和免疫治疗等,但由于发病率少,病情异质性大,国内外尚缺乏统一的临床治疗方法。笔者认为对于该患者而言,局部孤立转移灶且境界清楚,可选择放疗联合免疫治疗,控制局部病灶的同时抑制全身肿瘤进展。
目前国内外研究发现大多数的胸腺瘤/癌呈现PD-L1高表达水平,且随着世界卫生组织分型等级的增高而增加,尤其是在B2/3型胸腺瘤和胸腺癌中处于高表达[6,7],这也为PD-1/PD-L1抑制剂在胸腺瘤中的应用提供了理论依据。但国内外研究发现合并有肌无力的胸腺瘤患者,在应用PD-1抑制剂后出现了高致死率的免疫相关性心肌炎[8,9,10],可能的原因是合并肌无力的胸腺瘤可能大量产生靶向心肌细胞的抗体[11];而PD-1/PD-L1可以保护正常的心肌细胞免受这种抗体的损伤,但应用PD-1抑制剂之后,恢复活性的T细胞不仅杀伤了肿瘤细胞同时还损伤了正常的心肌细胞,从而导致了免疫相关性心肌炎的产生[12]。这也是我们没有为该例患者选用PD-1抑制剂治疗的主要原因。GM-CSF作为一种造血生长因子,可以调节造血祖细胞的增殖分化,并能促进抗原提呈细胞的增殖与分化,增强肿瘤相关抗原的有效处理及表达,通过抗原提呈细胞通路放大机体的抗肿瘤免疫效应。而对病灶的放疗,不仅直接杀伤肿瘤细胞,同时诱导了肿瘤细胞释放新的抗原进入肿瘤微环境内,再通过GM-CSF极大地促进患者体内肿瘤抗原提呈的发生,从而有效增强机体抗肿瘤免疫效应,与放疗达到联合抗肿瘤的作用[13]。
国内外目前尚无胸腺瘤腹壁转移的报道,本文通过1例B2/B3混合型胸腺瘤腹壁转移的病例报道,为胸腺瘤合并肌无力的个体化治疗提供了依据,对今后指导临床对于复发转移性胸腺瘤的治疗提供了新的方向,但因病例有限、随访时间较短,远期疗效及预后仍有待进一步观察和研究。
所有作者均声明不存在利益冲突



























