
直肠癌是一种常见的消化道恶性肿瘤,且术后容易发生转移,转移可分为局部转移及远处转移,但发生在术后5年以上的多次寡转移临床较少见。本文介绍1例直肠癌术后5年的多发寡转移病例,就其临床特点和治疗方法进行治疗,以期为临床提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
直肠癌术后转移较为常见且多为3年内转移,转移灶部位多为肝、肺且为多发转移;术后多次寡转移临床极为罕见,临床有时往往难以决策,导致不恰当治疗。虽然结直肠外科技术飞速发展,目前手术已趋于程序化、标准化,可对80%的早期肿瘤行根治性切除术,并且术后复发率低,有较好的预后表现[1]。但近年来直肠癌患者根治术后5年生存率始终徘徊在60%~70%,其中约50%的患者最终死于局部复发和远处转移[2];并且有些根治术后的患者经过综合、规律治疗后还是会发生转移,临床医生需要意识到这种特殊情况,以进行准确的治疗。现分析1例57岁男性直肠癌患者5年术后多次寡转移的诊断与治疗经过。
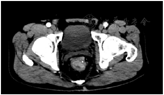
患者男,57岁,主因"里急后重感2月"入院。患者于入院2个月前无明显诱因出现肛门部坠胀不适及排便不尽感,不伴有血便、脓便;经使用润肠药物、痔疮栓剂等治疗无明显缓解,逐渐加重后遂到医院就诊。门诊医师指检于胸膝位4~6点,距肛门约4.0cm处可及质脆菜花样肿物大小约5.0 cm×4.5cm;活动稍差,边界尚清,上界无法触及,指套血染;当时高度考虑诊断为直肠癌,收入院治疗。既往无吸烟、饮酒史,无癌症家族史,无放射物、毒物接触史,无胸闷、呼吸急等症状,无其他潜在疾病。体格检查结果正常。实验室测试结果基本上均正常。直肠肿瘤活检病理报告为直肠高分化腺癌。完善腹部CT检查(图1)诊断临床分期cT3NxM0期。

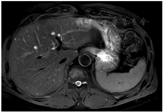
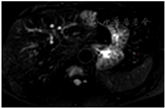
患者于2013年10月18日行开腹直肠癌腹会阴联合切除术、腹腔淋巴结清扫术,术后病理分期T3N0MO。但考虑淋巴结取检数目较少,T分期晚,决定给予术后辅助化疗。于2013年11月2日至2014年3月29日行奥沙利铂+氟尿嘧啶方案药物化疗6次。患者术后每年复查腹部彩超、肿瘤系列检查,2016、2017、2018年腹部彩检查均未见肝脏、腹腔转移征象,癌胚抗原检查分别为2.64、14.55、10.12 ng/ml。患者2018年3月癌胚抗原升高,2个月后复查仍明显高于正常指标。此时考虑不除外转移可能,建议患者完善PET-CT检查。外院PET-CT检查示肝S2段高代谢肿块影,考虑转移癌(术后5年)。进一步完善肝脏MR检查(图2、图3)和肝脏超声造影,结果示肝S2段不均质回声区动脉期呈快速高增强,门脉期开始消退,延迟期消退明显,呈"黑洞征""快进快退"增强模式。诊断为肝脏转移癌?原发肿瘤?考虑患者为孤立病灶;PET-CT未发现其他转移病变,影像学评估肝脏病变可RO切除。


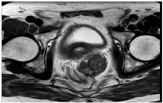
患者遂于2018年6月11日行肝左外叶切除术。术后病理符合直肠癌肝转移。术后患者恢复顺利,经与肿瘤科商议,在2018年7月2日至2018年11月9日予以奥沙利铂+卡培他滨化疗6次。随后定期随访,患者似乎对癌胚抗原指标较敏感,所以重点关注了此项指标。CEA分别为2.33 ng/ml (2018年7月3日)、4.54 ng/ml (2018年10月8日)、15.66 ng/ml (2018年11月12日,肝转移切除术后5个月)。此时患者出现癌胚抗原指标升高,完善胸部、全腹部增强CT未见转移征象,建议患者行PET-CT检查。但患者因经济因素拒绝,遂嘱其3个月后再次复查。患者因个人因素于8个月后来院检查,癌胚抗原为3.35 ng/ml (2019年6月11日,肝转移切除术后1年),胸腹部CT未见转移征象。患者1年后主诉会阴部疼痛、坠胀,完善癌胚抗原为9.9 ng/ml (2020年7月14日,直肠癌术后近7年,肝转移切除术后2年),完善盆腔MR检查(图4、图5)示尾骨前肿块,考虑转移性病灶,侵及左侧精囊腺、前列腺可能性大(2020年7月14日)。

为进一步帮助诊断与治疗,需重点判断肿瘤的良恶性遂行CT引导下穿刺病理检查。CT穿刺结果示转移性腺癌。此时进一步完善全腹部CT等检查仍未见其他转移病变,建议行PET-CT检查,但患者及家属拒绝。因患者会阴部疼痛、坠胀不适剧烈,强烈要求手术,经术前多学科团队讨论,于2020年8月2日行经骶尾部直肠癌复发灶切除+前列腺、精囊腺切除+隧道膀胱、尿道会师术。肿瘤科考虑既往化疗方案有效,无靶向用药指征,免疫治疗患者不考虑,遂予以奥沙利铂+卡培他滨化疗;3个周期后患者出现奥沙利铂过敏,给予口服卡培他滨单药化疗3个周期;术后4个月(2020年12月18日)复查盆腔MR、肿瘤系列癌胚抗原均为阴性;后因新冠肺炎疫情影响,患者复查不规律,于2021年10月份再次出现会阴部坠胀感,复查盆腔MR检查考虑骶前复发,患者要求上级医院就诊。
此患者直肠癌MILES术后5年发生肝脏寡转移,因为可RO切除且未发现其他转移病灶,治疗上选择手术根治切除无可厚非;术后7年肝转移切除术后2年发生骶前局部转移,虽然未完善PET-CT检查,但高分辨率CT考虑全身无其他转移病灶,遂联系泌尿外科行局部根治性切除也是正确的。但患者为何术后7年仍发生局部转移?机制尚不明确,是个例还是有明确转移机制尚不清楚。切除术后1年再次发生骶前转移可能与上次手术残留有关,腹部彩超、CT等检查仍未发现其他转移病灶,患者多次转移均有手术机会,临床极为少见。
文献报道可能影响直肠癌根治术后肝脏及局部转移的危险因素有年龄、性别、癌胚抗原水平、肿瘤位置、手术方式、原发灶大小、肿瘤分化程度、肿瘤浸润深度、淋巴结转移情况、脉管侵犯等[3]。本例患者直肠癌病理为中分化腺癌,恶性度尚可,但为何频频发生远处、局部转移,但又全为可切除性转移?笔者认为一定有其转移机制。结直肠癌的治疗已经进入了基因时代,根据不同基因分型决定不同治疗方案,同时基因检测对预后也有重要指导意义。因此如何寻找到合适的早期诊断预测基因、实验室指标亦是研究的热点。已有研究表明T-框蛋白5可以通过抑制增值和侵袭相关基因而抑制结直肠癌的进展[4]。DNA结合蛋白A沉默后对活体肿瘤细胞的生长有明显的抑制作用[5]。循环肿瘤细胞(circulating turtor cell,CTC)已被用于判断预后和评价治疗,在原发肿瘤切除手术后Ⅱ期结直肠癌患者可以通过检测CTC来判断是否有复发或转移的风险[6]。这些预测基因、CTC在这类患者是否可应用仍值得商榷、探讨。本例患者中肿瘤标记物癌胚抗原预测其复发风险较为敏感,但在完善相关影像学检查后并未发现转移征象,可见其特异性亦有一定受限。笔者考虑其转移特点与肿瘤瘤品可能有密切关系,如果可以更加准确地判断肿瘤的生物学行为、筛选出那些高危的晚期复发病患,寻找到敏感又相对易于检测开展的肿瘤复发预测基因、标记物来早期诊断,并动态调整复查、治疗方案,将对这部分患者大有裨益。笔者将继续关注此患者治疗,进一步研究这类型直肠癌转移方式、复发时间的高危因素,探讨相关预测基因、实验室指标的预测价值,为临床诊治提供参考。如果要明确与直肠癌术后复发时间相关的独立危险因素仍然需要前瞻性的大样本多中心的临床对照研究。随着直肠癌治疗手段的飞速发展,影响直肠癌术后远处及局部复发的各种因素已成为临床关注的热点、关键[7]。临床上应当结合肿瘤危险因素(临床病理类型及分子生物学的特征)分层,筛查出术后易复发或恢复效果不理想的高危人群,制定相对合理化的个体诊疗方案以及随访方案;从而降低术后复发率,提高此类患者的生存率和改善患者生活质量。
所有作者均声明不存在利益冲突



























