
伴有听觉先兆的家族型颞叶外癫痫是一种常染色体显性遗传性疾病,通常是由富含亮氨酸的胶质瘤失活1(LGI1)基因突变所致,而RELN突变所致家族型颞叶外癫痫较少见,且抗癫痫药物治疗效果一般较好。本文报道1例家族型颞叶外癫痫患者,全基因组测序显示RELN和NOTCH3突变,且来源于其母,抗癫痫药物疗效不佳。通过颅内电极植入术明确致痫灶,同时采用手术切除,术后疗效较好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
伴有听觉先兆的家族型颞叶外癫痫是常染色体显性遗传病,多为中青年发病,癫痫发作频率少,抗癫痫药物疗效好,但撤药后易复发,通常是由富含亮氨酸的胶质瘤失活1(leucine-rich glioma inactivated 1,LGI1)基因突变所致[1]。而RELN突变所致家族型颞叶外癫痫较少见,且药物治疗效果一般较好[2]。本文回顾性报道2018年12月广东三九脑科医院癫痫诊疗中心采用手术治疗的1例难治性RELN突变所致颞叶外癫痫患者的临床资料,术后疗效较好。现报道如下。
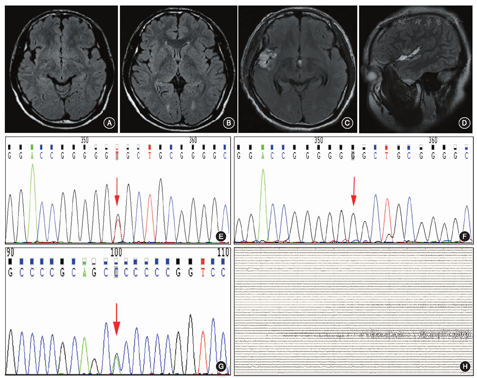
患者男,21岁,主因"发作性幻听伴肢体抽搐6年余"入院。15岁起病,发作表现为双耳鸣(似火车鸣笛低音调)→心悸→意识障碍→咂嘴、吞咽→头眼左偏、口角左歪,左上肢僵硬,持续10 s后缓解,继发强直-阵挛性发作的概率为20%。既往服用卡马西平、左乙拉西坦、丙戊酸、奥卡西平等多种药物,仍控制不佳。其母亲13岁首次出现癫痫发作,数月发作1次,表现为全身强直-阵挛性发作,先兆同患者,25岁分娩,30岁后服用卡马西平,至今无发作。家族其他成员均无癫痫发作史(图1)。近期,1~2个月发作1次。查体:神志清楚、情绪稳定、高级智能活动正常,脑神经(-),四肢肌力、肌张力正常,腱反射存在,病理征(-)。头颅MRI检查显示,右侧颞极、颞叶内侧、岛叶、前环岛沟、颞盖皮质均可见信号增高,增强无强化(图2A,图2B)。头颅正电子发射断层显像术(PET)-CT检查显示,右侧大脑半球的额叶、颞叶、岛叶及顶叶表现为低代谢。视频脑电图显示发作间歇期背景活动无异常,可见癫痫样放电,清醒期主要位于颞叶,睡眠期较泛化,右半球(额、颞叶区)均可见。韦氏量表评分结果:全量表、言语量表、操作量表、记忆量表分别为105分、109分、98分、112分。术前头皮脑电图检查显示,发作起始于右侧半球,考虑致痫区为右侧颞叶,右侧听觉皮质起始的可能性大。全外显子基因检测(迈基诺基因公司)的结果显示,RELN和NOTCH3突变,均来源其母(图2E,图2F,图2G)。术前根据辅助检查结果综合考虑致痫区为颞横回,需在颞叶内侧、颞极、额眶区植入电极进行鉴别,同时在顶下小叶植入电极确定手术切除后界,故以颞横回为中心进行电极植入术,以鉴别致痫网络。颅内电极脑电图证实发作起始为颞横回,致痫网络为:颞横回→岛后小叶→海马→扩散颞盖、顶盖(图2H)。患者在全身麻醉下行颞横回、颞盖及右侧岛后小叶切除术。术后病理学检查结果为局灶性皮质发育不良Ⅱa,基因检测结果显示为RELN杂合突变。术后1年随访,患者无发作,复查头颅MRI显示颞横回、颞盖、右侧岛后小叶已切除(图2C,图2D)。


仅有50%的家族型颞叶外癫痫会呈现LGI1杂合子变异的典型表型。Michelucci等[2]报道RELN基因突变致家族型颞叶外癫痫的7个家系24例患者,其中平均发病年龄为20岁;71%(17/24)的患者伴有幻听,88%(21/24)的患者伴有强直-阵挛发作,80%(19/24)的患者伴有颞叶区间歇期放电或局灶性慢波;24例患者均采用抗癫痫药物治疗,疗效较好。而本文报道的为难治性家族型颞叶外癫痫,故采用手术治疗。
RELN基因编码一种相对分子质量较大的分泌性的糖蛋白(Reelin),Reelin是脑细胞外基质的基本构建骨架,在生后参与调节神经元发育并参与成体中枢突触的功能,对神经元的正确定位起不可或缺的作用。Reelin可以通过影响神经元移行,导致皮质发育畸形[3,4]。Reelin不仅在发育过程中形成皮质层,还在成年期参与维持。Reelin通过磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)-蛋白激酶B(protein kinase B,PKB)信号控制皮质的发育,并通过雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)途径调节树突生长[5,6]。RELN突变可导致PI3K-PKB-mTOR通路病变,进而导致皮质发育畸形[7]。RELN基因的C末端区域与极低密度脂蛋白受体(very low-density lipoprotein receptor, VLDLR)相互作用,若被截断可导致大脑皮质和海马发育异常[5]。这一结论也得到其他研究的的证实[8,9]。
该例患者为家族型颞叶外癫痫,发作期先有双耳鸣,随后出现心悸等植物神经症状,再后出现咂嘴、吞咽等自主运动,后继发左侧强直或强直-阵挛发作。视频脑电图间歇期为右侧颞叶区癫痫样放电,发作期症状学起始为听觉先兆,发作后期症状学有双眼右侧凝视并继发全身强直-阵挛发作,定位考虑为右侧颞叶新皮质(听觉皮质)的可能性大,并推测其致痫网络为:致痫区在颞横回,通过腹侧通路扩散的致痫网络。症状学中有自主运动和植物神经症状,头颅MRI可见右侧颞叶内侧信号增高,PET可见右侧颞叶低代谢,需与右侧边缘系统相鉴别。另外,症状学中该例患者有左上肢重复样运动,PET可见右侧大脑皮质额眶区明显低代谢,考虑为癫痫发作网络扩散所致,同时也需要鉴别。因头颅MRI可见右侧颞极、颞叶内侧、岛叶、前环岛沟、颞盖信号均有所增高,且PET可见右侧半球大范围低代谢。因此,考虑仅单纯切除右侧颞横回,可能不能完全切除致痫区,故给予颅内电极植入以明确确切的致痫区。本例患者的母亲有癫痫史,且有相同的幻听先兆,但药物治疗效果好,与文献中报道较一致[2]。但患者因药物疗效差、且有家族史,建议行手术治疗。故先完善基因检查,确定其为因RELN和NOTCH3突变所致的颞叶外癫痫。电极植入后证实致痫灶起源于颞横回,岛后小叶为早期扩散区,故手术时一并切除,术后疗效较好。
综上所述,在严谨的术前评估条件下,部分类型的基因突变(如mTOR通路相关基因)致癫痫的患者,可能存在手术适应证,即使有家族史、基因明确变异的难治性癫痫依然有手术的机会。当诊断为药物难治性癫痫时,手术可能会为患者提供一线帮助。
所有作者均声明不存在利益冲突



























