
发生在小脑半球的胶质母细胞瘤少见,影像学表现不典型,易被误诊为脑膜瘤;目前首选手术治疗,且术后辅以放、化疗,其总体生存率与小脑幕上胶质母细胞瘤相似。本文报道丽水市中心医院神经外科2020年2月收治的1例左侧小脑半球不典型胶质母细胞瘤患者,术前诊断后颅窝占位,脑膜瘤的可能大,行"左侧小脑半球肿瘤切除术+颅骨成形术"治疗,术后病理学检查结果显示为胶质母细胞瘤;术后辅以放、化疗;术后1年随访时,患者生存状态较好,且肿瘤未复发。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胶质母细胞瘤(glioblastoma,GBM)起源于神经胶质细胞,属于世界卫生组织(WHO) Ⅳ级的高级别胶质瘤,是成人最常见的恶性原发性中枢神经系统肿瘤[1],具有高度侵袭性、极易复发且预后差[2]。GBM好发于额叶、颞叶及大脑深部脑白质,但是发生在脑室内和小脑较为罕见[3]。丽水市中心医院神经外科2020年2月收治1例左侧小脑半球不典型GBM患者,在全身麻醉下行"左侧小脑半球肿瘤切除术+颅骨成形术",术后生存状态良好。现报道如下。
患者 男,60岁,因"头晕伴行走不稳10 d"入院,无头痛、视物旋转、意识障碍、恶心呕吐、四肢抽搐、发热等不适,体格检查和实验室检查均未见明显异常。头颅CT增强扫描显示左侧小脑半球存在占位性病变,大小为3.5 cm×2.8 cm(图1A);头颅MRI也显示左侧小脑半球存在占位性病变,在T1加权成像(T1WI)上呈等低信号(图1B),T2加权成像(T2WI)上呈等稍高信号,周围可见片状水肿高信号影(图1C),增强扫描显示病变明显渐进性强化,边缘可见增粗的血管影,小脑蚓部及第四脑室略受压(图1D,E)。术前诊断为后颅窝占位,脑膜瘤可能大。手术操作:取正中长约8 cm直切口,切开枕颈部肌肉,显露枕下颅骨。钻2个骨孔,用铣刀铣开颅骨,骨窗大小约为5 cm×4 cm。悬吊硬脑膜止血,涂骨腊止血。硬脑膜张力稍高。在显微镜下操作,切开硬脑膜,即见淡黄色肿瘤,分块切除。术中可见肿瘤质软、边界不清且血供丰富。术中切除的部分肿瘤组织标本行快速冰冻病理学检查,结果显示肿瘤细胞呈多形性,易见核分裂,还可见坏死组织,考虑为脑胶质瘤。因此,术中扩大切除范围,切除肿瘤周围边缘的正常小脑组织。最后采用人工硬脑膜修补缺损的硬膜,骨瓣回纳,颅骨锁钉固定,皮瓣下放置3 mm引流管。术后3 d,患者意识清楚,精神状态好,对答正确,定向力正常,双侧瞳孔等大、等圆,直径为2.5 mm,对光反应灵敏,偶有头晕,但无其他明显的不适症状;Karnofsky功能状态评分(Karnofsky performance scale,KPS)为80分。术后行病理学检查,HE染色可见肿瘤细胞排列密集,多形性,异型明显,核分裂易见,并可见病理性核分裂象,内皮细胞增生,可见较多不成熟的血管增生,另可见坏死组织;免疫组织化学染色结果显示,胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、S-100、波形蛋白(Vimentin)、CD34均呈阳性表达,p53呈少数阳性表达,而AE1/3、上皮细胞抗原(epithelial membrane antigen,EMA)均呈阴性表达;Ki-67增殖指数为40%;分子病理学检查结果显示,突变型异柠檬酸脱氢酶1(isocitrate dehydro-genase 1,IDH1)表达阴性,O6-甲基鸟嘌呤-DNA-甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)启动子甲基化,且1p/19q未缺失;最后诊断为胶质母细胞瘤,为WHO Ⅳ级(图1F~I)。术后患者辅以放疗,同步应用替莫唑胺(75 mg/m2)进行化疗。术后1年复查头颅MRI,显示术区存在局限性积液,但未见强化征象(图1J~L)。
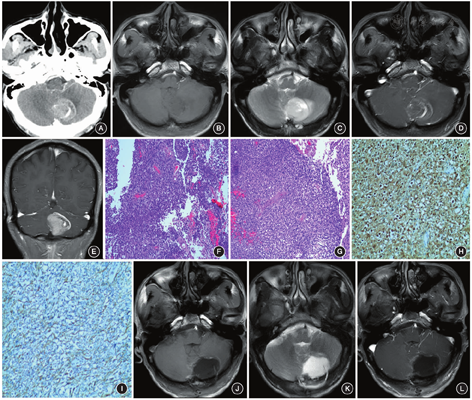

2021年,第5版《WHO中枢神经系统肿瘤新版分类》中将弥漫性胶质瘤分为成人型和儿童型。其中成人型弥漫性星形胶质细胞瘤具有微血管增生、坏死和(或)特定的分子病理学特征,如端粒酶反转录酶(telomerase reverse transcriptase,TERT)启动子突变、表皮生长因子受体(epithelial growth factor receptor,EGFR)基因扩增和(或)7号染色体扩增或10号染色体缺失等。IDH1突变的GBM也被称为IDH1突变型星形细胞瘤,属于WHO Ⅳ级[1]。GBM可发生于任何年龄段,但常见于成人,发病高峰年龄段为45~75岁,男性较女性多发。发生于小脑半球的GBM少见,占颅内GBM的0.3%~1.2%[4],发生年龄与小脑幕上GBM相似,目前国内仅有个案报道。
GBM在影像学上呈膨胀性、浸润性生长,常累及多个脑叶,并侵犯大脑深部结构;当发生于小脑幕上时,可跨越胼胝体并侵袭大脑对侧。GBM的侵袭性较强,常伴有坏死、出血,增强扫描时常呈蜂房样或花环样强化,部分可见壁结节,水肿和占位效应较显著[5]。文献报道,发生在小脑半球的GBM可表现为:(1)不规则的环状强化,与小脑幕上GBM相似;(2)均匀的片状或结节状强化,无坏死,类似恶性淋巴瘤和转移癌;(3)在T2WI上呈平行线性条纹的高信号影(即"虎纹"外观)[6]。本例患者发生在左侧小脑半球,增强扫描呈明显的渐进性强化,局部存在少许囊性坏死,边缘可见增粗的血管影,与小脑幕上GBM明显不同,属于部位罕见且影像学上不典型的GBM,易被误诊为脑膜瘤。脑膜瘤起源于蛛网膜颗粒细胞,发生于硬脑膜的内表面,多数肿瘤的宽基底部位与硬脑膜相连,增强扫描呈现显著强化,周围可见"脑膜尾征"。
GBM无论发生在小脑幕上还是小脑,首选治疗方法均为手术切除,手术原则为尽可能完全切除肿瘤。但由于GBM呈浸润性生长,常与正常脑组织无明显边界,单纯手术治疗后易复发。文献报道,对于年龄≥65岁、术后KPS评分>60分及MGMT启动子甲基化的GBM患者,常规放疗联合替莫唑胺同步及序贯化疗可明显改善其生存预后[7]。因此,GBM患者术前机体功能状态良好,手术后联合放疗和以替莫唑胺为主的化疗能够获得较好的生存预后[8,9,10]。根据文献报道,小脑GBM患者的总体生存率与小脑幕上GBM的老年患者相似;但接受最大程度切除并辅以放、化疗的小脑GBM患者,其生存率有所提高[11]。因此,应鼓励小脑GBM患者积极配合治疗,以获得更长的生存时间。本例左侧小脑半球GBM患者行肿瘤切除术后,KPS评分为80分,分子病理结果显示MGMT启动子甲基化,术后辅以放疗,同步化疗;术后1年随访时,患者状态良好,且未见肿瘤复发。
综上所述,发生在小脑半球的GBM较为少见,影像学表现不典型,增强扫描时病变呈明显渐进性强化,边缘可见明显增粗血管影,与小脑幕上GBM的花环样强化表现完全不同,在临床上易被误诊为脑膜瘤;治疗原则以尽可能完全切除肿瘤为主,术后辅以放、化疗,可取得较好的生存获益。
所有作者均声明不存在利益冲突



























