
分析不同蛋白质饮食对慢性肾脏病(CKD)患者肾功能的影响。
通过问卷调查和收集临床资料相结合的方法,对2009年1月—2012年7月在北京友谊医院肾内科CKD门诊就诊的159例2~4期CKD患者资料进行回顾性分析。利用门诊登记随访系统每个月对患者进行临床随访,记录患者的门诊随访资料,包括原发病、血压、体质指数(BMI)、生化指标、蛋白质能量营养不良(PEM)评估、饮食回顾等,计算饮食中每日蛋白质摄入量(DPI)评估明确营养状态,应用简化的MDRD公式计算估算肾小球滤过率(eGFR)。根据不同的DPI将CKD患者分为极低蛋白饮食(VLPD)组:DPI≤0.6 g·kg-1·d-1;低蛋白饮食(LPD)组:DPI >0.6~<0.8 g·kg-1·d-1;正常蛋白饮食(NPD)组:DPI≥0.8 g·kg-1·d-1。
(1)159例患者中,4例(2.50%)进展到尿毒症期行肾脏替代治疗,2例(1.25%)出现肾功能迅速下降住院,9例(5.66%)因心脑血管疾病住院,2年肾存活率97.5%。(2)研究结束时共发生PEM 9例,其中血浆白蛋白<32 g/L共2例,BMI<20 kg/m2共7例,CKD各期相比发生PEM差异均无统计学意义(均P>0.05)。(3)Pearson相关分析显示不同DPI与ΔeGFR无显著相关性,且不同DPI对ΔeGFR影响差异无统计学意义,各组间比较均P>0.05。
在一定范围内,不同蛋白质摄入量对CKD患者肾脏预后可能无明显影响。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性肾脏病(CKD)是全球范围内的公共健康问题,是继心血管疾病、糖尿病之后又一个备受关注的常见慢性疾病,是危害人民健康的重大疾病,具有患病率高、心血管疾病合并率高和病死率高的"三高"以及知晓率低、治疗率低和有效控制率低的"三低"特点。CKD严重威胁人民的健康和生活质量,防治CKD已成为保证人民身体健康的迫切需求。
在CKD的治疗措施中,除针对基本病因,干预发病机制,积极预防、治疗并发症,以及施行替代治疗外,营养治疗也是CKD患者一体化治疗中重要的组成部分。早在130多年以前,限蛋白饮食就是处理CKD患者的一个重要治疗手段。以往认为低蛋白饮食(low protein dit,LPD)可以降低CKD患者机体不能排泄的废物的过多积聚,而高蛋白饮食甚至普通正常蛋白饮食均可导致肾小球高灌注、高滤过和高压力,使肾小球超微结构改变,包括基膜滤过屏障大小及电荷选择性受损,最终引起肾小球硬化,加速CKD的进展。但LPD往往不能保证CKD患者的营养需要和正氮平衡,会加重CKD患者的营养不良和体内氨基酸代谢的紊乱,导致肾功能的进一步恶化。因此,研究低蛋白饮食是否能够延缓肾功能不全的进展,是否会出现营养不良,是否适合中国人的饮食需要就显得尤其重要。
2009年1月—2012年7月在北京友谊医院肾内科CKD门诊长期随访的159例CKD的患者。入选标准:年龄18~80岁,符合CKD诊断的2~4期CKD患者。CKD诊断标准参见K/DOQI指南;血尿和(或)蛋白尿判定为尿检异常;根据MDRD公式计算估算肾小球滤过率(eGFR)值,判断肾功能分期。排除标准:影像学证实的肾动脉狭窄、先天性肾脏畸形(孤立肾、马蹄肾等)、单肾缺如或无功能、急性梗阻性肾病、泌尿系统肿瘤;免疫性疾病活动期;恶性高血压急性期;急性肾功能不全或已进入肾脏替代治疗;严重感染;孕妇或准备近期怀孕的妇女。终点事件:死亡、肾脏替代治疗(RRT),严重营养不良;次要终点:血清肌酐(SCr)翻倍。
记录患者首次入CKD随访门诊时的资料,包括:(1)原发病;(2)高血压病程;(3)体质指数(BMI);(4)主观综合性营养评估(SGA);(5)生化指标;(6)蛋白质能量营养不良(PEM)评估;(7)饮食回顾计算每日蛋白质摄入量(DPI)。利用门诊登记随访系统对所有患者进行随访,每个月对患者进行临床随访,指导用药,记录并发症。3个月评估1次营养状况,检测体重、BMI、血清白蛋白、SGA,记录24 h饮食以计算DPI。
采用简化的MDRD公式计算eGFR,以eGFR变化(ΔeGFR):结束时eGFR-入组时eGFR来比较不同DPI组肾功能的变化[1],eGFR变化率:ΔeGFR/入组时eGFR来比较不同CKD分期中不同DPI组肾功能的变化[2]。根据患者多次的DPI值求得平均DPI,并根据平均DPI将患者分为极低蛋白饮食(VLPD)组:DPI≤0.6 g·kg-1·d-1,低蛋白饮食(LPD)组:DPI >0.6~<0.8 g·kg -1·d-1,高蛋白饮食(NPD)组:DPI≥0.8 g·kg-1·d-1。
CKD门诊根据K/DOQI指南和国内专家共识,对CKD患者进行"一体化"治疗,包括:低盐、低脂(高血脂患者)、低量优质蛋白、低嘌呤(高血尿酸患者)、低糖(糖尿病患者)等饮食治疗;原发病的治疗;蛋白尿的控制;糖尿病患者强化血糖控制;高血压患者血管紧张素转换酶抑制剂(ARB)联合钙离子拮抗剂(CCB)强效降压,血压<130/80 mmHg(1 mmHg=0.133 kPa)为达标;高脂血症患者应用他汀类药物,肾性贫血应用促红细胞生成素(EPO)及铁剂、钙磷代谢调节及活性维生素D的应用等。
所有正态分布计量资料用 ±s表示,非正态分布计量资料用M(Q1,Q3)表示,计数资料用例(%)表示。采用SPSS 16.0统计软件进行分析,对计量资料用单因素方差分析,相关性采用Pearson相关分析,率的比较采用行×列表χ2分析。
±s表示,非正态分布计量资料用M(Q1,Q3)表示,计数资料用例(%)表示。采用SPSS 16.0统计软件进行分析,对计量资料用单因素方差分析,相关性采用Pearson相关分析,率的比较采用行×列表χ2分析。
本研究入组统计159例患者,其中男105例(66.0%),女54例(34.0%),平均年龄64(32~79)岁,病程11.0~122.0(平均33.5)个月,随访时间16.0~26.0(平均20.4)个月。原发病高血压肾损害72例,慢性肾小球肾炎50例,糖尿病肾病24例,药物性肾损害8例,马兜铃酸肾病1例,间质性肾炎3例,不明原因肾功能不全1例。
159例患者中,4例(2.50%)进展到尿毒症期行肾脏替代治疗,2例(1.25%)出现肾功能迅速下降住院,9例(5.66%)因心脑血管疾病住院。2年肾存活率97.5%。
以基线eGFR将患者分为CKD2期、CKD3期、CKD4期3组,DPI分别为0.66±0.22、0.69±0.20、0.62±0.20,3组间比较差异无统计学意义(P=0.28)。
单因素方差分析显示不同DPI组对eGFR影响差异无统计学意义,各组间比较P>0.05,VLPD和LPD组eGFR有下降趋势,而NPD组eGFR无明显变化(图1)。
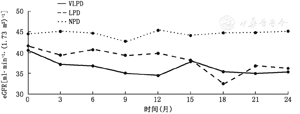

注:DPI:每日蛋白质摄入量;eGFR:估算肾小球滤过率:VLPD:极低蛋白饮食组;LPD:低蛋白饮食组;NPD:正常蛋白饮食组,下表同
结果显示不同CKD分期中DPI水平与ΔeGFR均无显著相关性(均P>0.05,表1)。
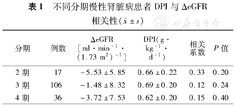
不同分期慢性肾脏病患者DPI与ΔeGFR相关性( ±s)
±s)
不同分期慢性肾脏病患者DPI与ΔeGFR相关性( ±s)
±s)
| 分期 | 例数 | ΔeGFR[ml·min-1·(1.73 m2)-1] | DPI(g·kg-1·d-1) | 相关系数 | P值 |
|---|---|---|---|---|---|
| 2期 | 17 | -5.53±5.85 | 0.66±0.22 | 0.33 | 0.20 |
| 3期 | 106 | -1.48±8.32 | 0.69±0.20 | 0.12 | 0.24 |
| 4期 | 36 | -3.72±7.53 | 0.62±0.20 | 0.15 | 0.40 |
不同CKD分期患者的蛋白饮食所致的eGFR变化率差异无统计学意义(表2)。
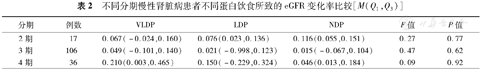
不同分期慢性肾脏病患者不同蛋白饮食所致的eGFR变化率比较[M(Q1,Q3)]
不同分期慢性肾脏病患者不同蛋白饮食所致的eGFR变化率比较[M(Q1,Q3)]
| 分期 | 例数 | VLDP | LDP | NDP | F值 | P值 |
|---|---|---|---|---|---|---|
| 2期 | 17 | 0.067(-0.024,0.160) | 0.076(0.023,0.136) | 0.116(0.055,0.151) | 0.27 | 0.77 |
| 3期 | 106 | 0.049(-0.101,0.140) | 0.021(-0.998,0.123) | 0.015(-0.067,0.104) | 0.47 | 0.62 |
| 4期 | 36 | 0.210(0.003,0.465) | 0.150(-0.229,0.324) | 0.046(0.013,0.184) | 0.09 | 0.92 |
以研究结束时eGFR分为CKD2期、CKD3期、CKD4期、CKD5期4组,共发生PEM 9例,其中血浆白蛋白<32 g/L共2例,BMI <20 kg/m2共7例,各期PEM发生率:CKD2期0(0/16),CKD3期4.3%(4/93),CKD4期9.1%(3/33),CKD5期11.8%(2/17),各期相比PEM发生率差异无统计学意义(P=0.362)。
与CKD骨病、高血压、贫血等并发症治疗手段、达标率日益增高相比,CKD患者的营养不良发生率呈持续增长趋势[3]。CKD患者的营养不良与传统概念中的营养不良不同,通常指肌肉消耗,体重减轻,血浆蛋白下降,自我感觉异常疲劳的一种状态[4]。据统计,CKD营养不良的发病率很高,在西方发达国家达18% ~75%[5],在我国发病率为20%~50%[6]。营养不良对CKD患者的心脏、肺脏、造血系统、内分泌系统和代谢等多方面都会造成危害,已经成为CKD患者高住院率和高病死率的主要原因[7]。
导致CKD营养不良的因素较多,包括饮食、蛋白质代谢异常、代谢性酸中毒、胰岛素抵抗、微炎症状态等因素。以往几十年普遍认为,低蛋白饮食治疗是治疗慢性肾脏病、特别是慢性肾衰竭的一个重要环节。其目的在于在降低CKD患者机体不能排泄废物过多蓄积,改善尿毒症的有关症状和延缓肾功能进展。2006年K/DOQI指南提出当GFR<20 ml/min而未进入透析的患者,DPI应为0.6 g·kg-1·d-1,而对于不能接受这种饮食或此饮食不能达到足够的能量摄入者,可给予0.75 g·kg-1·d-1的蛋白。然而,由于各种原因,低蛋白饮食治疗在临床应用中仍受到限制。
首先,低蛋白饮食治疗对于肾功能减退的延缓作用仍存在争议,目前关于低蛋白饮食对CKD患者肾功能影响的规模最大的临床实验,美国国立卫生研究院(NIH)进行的MDRD(1989—1993年)研究,其短期(2~3年)研究发现,对于中度肾病患者(GFR 25~55 ml/min),正常蛋白饮食(1.3 g·kg-1·d-1)组与低蛋白饮食组(0.58 g·kg-1·d-1)总的平均GFR下降率没有区别,但是,亚组分析显示低蛋白饮食能延缓GFR下降最快的CKD患者的GFR下降速度,并能减少尿蛋白的排出[8]。而且极低蛋白饮食(0.28 g·kg-1·d-1)不仅不能延缓肾功能衰竭的进展(87.3%比90.7%),还增加患者病死率及营养不良的发生率(38.9%比23.3%)[9]。
其次,CKD患者发生营养不良及营养不良导致的不良后果受到越来越多的关注,这也使得CKD的饮食治疗受到限制。营养不良在CKD患者中很常见,低蛋白饮食常常会导致CKD患者的PEM,PEM多见于婴幼儿、肿瘤、外科手术后的禁食患者,它主要是因为热量和(或)蛋白质不足而致的慢性营养缺乏症。在CKD患者,尤其是CKD 4~5期和透析治疗患者,营养不良的发生率呈现升高趋势,董捷等[10]对多我国中心腹膜透析患者的研究指出,47.8%的腹膜透析患者出现营养不良,其中重度营养不良的发生率为13.3%。新近提出的由CKD引起的PEM的诊断标准(即下列任何1项即可定义为PEM:体重1个月下降> 5%;3个月下降>7.5%;BMI<20 kg/m2,伴有血浆白蛋白< 32 g/L和C反应蛋白<5 mg/L)[11]。PEM能增加透析患者及透析前CKD患者总病死率和心血管病死率,是CKD患者并发症和死亡率最强的预测指标[12,13]。因此,在实施饮食治疗过程中应严密监测患者的营养状态,并保证热量,避免发生PEM。
本研究对CKD患者的回顾性分析与MDRD试验结果相仿,不同的DPI与eGFR的变化无相关性,且各组eGFR的变化差异无统计学意义,但是LPD组ΔeGFR变化最小。虽然LPD组的ΔeGFR最小,但是不同DPI对CKD患者肾脏预后无明显影响。根据CKD的不同分期进行进一步分层分析,结果显示各CKD分期中不同DPI与ΔeGFR无相关性。本研究显示,虽然CKD各期发生PEM差异无统计学意义,但是按照各期发生PEM的比例,CKD2~5期合并PEM在各期的发生率却有增加的趋势,分别为0、4.3%、9.1%和11.8%,即CKD2、3期出现PEM的比例较低,多数PEM出现在CKD 4~5期,原因可能为CKD4~5期的患者因肾功能下降食欲差、饮食中蛋白质摄入少、医生宣教需要低蛋白饮食。
因此,制定合理的蛋白饮食谱的主要目的在于降低CKD患者机体不能排泄的废物的过多积聚的同时,维持相对良好的营养状态,并尽可能改善毒素聚集所导致的有关症状。而本研究却发现低蛋白饮食不仅不能明显改善肾脏的预后,还可以导致PEM发生率增加。由于本研究样本量相对小,且为单中心研究,因此,只能认为在一定范围内,不同蛋白质摄入对进展期CKD患者肾脏预后可能无明显影响,还需要有多中心、大样本的随机对照试验研究来进一步佐证。



























