
探讨超声(US)、CT、MRI随访在肝硬化结节恶变筛查及诊断中的价值,旨在提高肝硬化背景下早期肝癌的诊断准确率。
回顾性分析浙江丽水市中心医院2010年1月—2013年5月96例经病理或临床治疗证实的肝硬化结节恶变患者的US、CT、MRI随访资料。
随访过程中,96例患者均行US、CT、MRI检查,共145个病灶,超声检出62个(42.6%),仅能提示占位;CT增强扫描检出90个(62.1%),典型结节恶变呈"快进快出"强化模式、假包膜、病灶进行性增大或短期数目增多;MRI及其随访过程中发现恶变结节138个(95.2%),表现为T1WI信号降低、T2WI信号增高、T2WI出现"结节套结节"征象、DWI信号增高、脂肪变性、强化方式改变、假包膜、进行性增大或短期病灶数目增多。
MRI检出肝硬化结节恶变较超声、CT有明显优势。US检查为肝硬化患者常规随访手段,发现病灶患者应行增强CT和(或)MRI检查定性诊断,肝硬化结节未明确恶变者应MRI随访以期早期诊断。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝细胞肝癌(HCC)是肝脏最常见的原发性恶性肿瘤[1],是世界第6位常见癌症,致死率居癌症第3位。慢性肝病患者每年3%~5%发展为HCC[2]。80%的HCC病例来自东亚、撒哈拉以南的非洲,而欧洲和北美发病率较低[3]。肝硬化患者,由于肝功能紊乱、肿瘤定位困难及肿瘤种植,不建议行穿刺活检[4],仅超声(US)、CT、MRI等非侵入性检查作为肝硬化结节恶变的最佳随访、诊断手段。本研究就多种影像学检查随访在肝硬化结节恶变筛查、诊断中的价值进行比较研究。
收集浙江丽水市中心医院2010年1月—2013年5月间96例经病理或临床治疗后确诊肝硬化结节恶变患者影像学检查资料。男61例、女35例。年龄42~72岁,平均年龄51岁。96例患者均有不同程度肝硬化。70例肝区疼痛、食欲减退、乏力,10例持续性低热,19例患者无明显临床症状,随访过程中发现肝硬化结节恶变。肝功能异常60例,甲胎蛋白(AFP)均不同程度升高。
(1)超声检查:设备为美国Philips IU22 G4。嘱患者检查前禁食10~12 h,常规取仰卧位,进行肝脏常规检查。用二维超声常规显示肝脏的不同切面。(2)CT检查:美国Philips 64排螺旋CT,对比剂为碘佛醇(320 mgI/ml) 80 ml,注射流率为3.0 ml/s。延迟时间:动脉期25 s,门静脉期60 s,延迟期180~300 s。扫描范围:膈顶到肝脏下缘。层厚5 mm,层距5 mm,扫描条件为120 kV、280 mAs。(3)磁共振检查:德国西门子(Siemens) 1.5T磁共振成像系统进行扫描,采用体部表面相控阵线圈。所有患者均作常规轴位T1WI、T2WI、T2脂肪抑制、冠状位T2WI和扩散加权成像(DWI)。定位参数均直接复制T2WI参数,保证图像的一致性。增强扫描采用GD-DTPA,增强扫描于肘前静脉高压注射对比剂钆喷酸葡胺(Gd-DTPA) 0.1 mmol/kg,常规动脉期、门静脉期、平衡期成像。
肝硬化结节分类沿用1995年国际肝病工作组分类:再生结节、低度不典型增生结节、高度不典型增生结节、不典型增生结节伴微灶性肝细胞癌、肝细胞癌或小肝癌(< 2 cm)。肝癌分类及诊断依据卫生部原发性肝癌诊疗规范(2011年版)。阳性标准:US、CT、MRI检查由两名副主任或主任医师阅片,在超声、增强CT及MRI T1WI、T2WI、DWI、动态增强图像上分别就病灶形态、大小、边界及强化模式等做出诊断,产生分歧时商议达成一致。
采用SPSS 17.0软件对资料进行统计分析。单因素方差分析+LSD组间多重比较,P<0.05为差异有统计学意义。
96例患者,145个恶变肝硬化结节,病灶呈圆形、类圆形为主,长径0.5~2.8 cm,平均长径1.5 cm。其中单发病例71例,多发病例25例。(1)超声检查:超声检出62个(62/145),阳性率42.8%。病灶内及周围树状广泛分布的血管彩色血流丰富,流速分布不均。52例出现门脉高压,门脉主干直径1.4~2.1 cm,脾静脉内径>0.8 cm。38例出现腹水。(2)CT检查:CT检出90个恶变结节,阳性率62.1%。增强扫描动脉期明显强化72个(4例出现结节中结节强化),门脉期、延迟期强化减退;部分乏血供病灶无明显动脉期强化,门脉期强化16个,延迟期仍为高密度2个。(3)MRI检查:MRI典型表现为T1WI呈高信号,T2WI呈低信号,增强扫描与周围肝实质强化方式相仿(图1)。阳性个数138个,阳性率95.2%。138个恶变结节中,5个直径<2 cm的病灶在T1WI和T2WI上为等信号,动脉期较均匀强化。T1WI呈高信号26个,等信号48个,低信号64个;T2WI病灶呈高信号为主,为101个,等信号24个,低信号13个;动态增强扫描呈典型"快进快出" 104个,"快进慢出" 23个。DWI高信号102例,T2WI、DWI同时呈高信号78例。MRI对肝硬化结节癌变内部成分的显示明显优于US、CT(图2)。3种监测方法方差分析F=57.694,P=0.000,组间存在显著性差异。MRI与CT、US比较差异有统计学意义(P=0.00)。
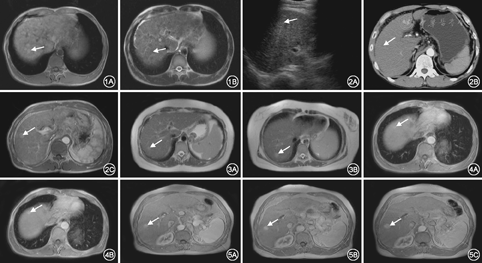

美国肝病研究协会(AALSD)、欧洲肝病研究学会(EASL)、日本肝病协会皆推荐B超作为肝癌的筛查手段[5,6,7],AALSD推荐每6个月行1次超声检查,发现<1 cm的病灶(包括癌前退变结节)应缩短随访周期为3个月。超声能检出肝内<1 cm占位性病变,但要对小肝癌作出定性诊断仍有困难[6],在肝硬化背景下敏感性仅有35%[7],本组研究阳性率42.6%。
本组病例CT平扫检出恶变结节仅71个,而CT增强检出90个,能提高检出率以及鉴别能力,因此,对疑有HCC的患者应行增强扫描,这与Cherblanc等[8]的研究结论一致。蒋奕等[9]研究认为,CT与MRI对肝炎肝硬化背景下SHCC的定性诊断价值相似,但对<2 cm的SHCC,MRI的鉴别能力优于CT。本组病例中,MRI在肝硬化背景下检出恶变结节145个中138个,准确率95.2%,较超声、CT有明显优势。根据AASLD指南新标准指出>1 cm的HCC只要增强CT或MRI呈典型"快进快出"即可确诊[6],而2009年亚洲肿瘤学峰会达成共识,增强CT、MRI典型强化的任何大小结节,不需要穿刺都足以诊断HCC[10]。Lee等[11]认为动态增强CT及MRI成像有取代穿刺活检的潜力。
弥散加权成像能够应用于肾功能不全和肾源性系统纤维化患者[12],Parikh等[13]研究53例患者211个肝脏局灶性病变(FLL)DWI及T2WI表现,认为DWI对FLLs的检出优于T2WI。Heo等[14]研究发现,肝癌的病理组织分化和ADC值负相关。Lee和Choi[15]认为,DWI与增强MRI联合能够明显提高肝硬化患者肝癌病灶的检出,常规MRI加做DWI恶性肿瘤发现率可提高40%[16]。本组病例,102个恶变结节DWI呈高信号,18个病灶显示不满意。
目前北美一些医学中心CT、MRI已经应用于肝癌高危患者随访,而不仅仅是超声阳性发现后对病灶进行定性诊断[17],AASLD建议对肝硬化病人定期MRI复查[18]。本研究发现以下征象高度提示肝硬化结节癌变:(1)T1WI信号降低;(2)T2WI信号持续增高;(3)T2WI表现为"结节中结节";(4)病灶出现脂肪变性;(5)动脉期病灶明显强化或病灶内结节状强化;(6)DWI呈高信号及DWI信号增高;(7)病灶出现延迟强化假包膜;(8)病灶短期随访进行性增大,尤其直径>3 cm,高度提示结节恶变;(9)病灶数进行性增加。此时,应缩短随访周期,磁共振3个月以内为宜,并及时行DSA检查或穿刺活检以期确诊。
总之,肝硬化结节复杂多变,典型的肝硬化结节癌变,US、CT及MRI常规技术联合DWI常可做出准确诊断,及时治疗。超声作为肝硬化结节恶变的常规筛查手段,每6个月1次,高度危险患者,每3个月1次。由于超声对病灶定性能力较差,对操作者依赖性大,发现病灶应行增强CT和(或)MRI检查,对病灶进行定性诊断。另外,本组研究中,部分患者3个月结节发生恶变,6或12个月时病变已错过最佳治疗时机,因此,建议结节性肝硬化患者每6个月行1次增强MRI联合DWI检查,若3个月随访1次,能够更早诊断、治疗,明显改善患者预后。



























