
寻找适合于中国肝细胞癌患者最佳的分期标准。
回顾性分析1999年1月至2010年12月中国医学科学院肿瘤医院外科治疗的908例肝细胞癌患者的临床资料,比较TNM分期第七版、BCLC分期、Tokyo分期、JIS分期、CUPI分期、CLIP分期以及Okuda分期对肝细胞癌术后生存情况的判断力。采用Kaplan–Meier法进行生存分析,采用Cox比例风险模型进行多因素分析。应用赤池宏治信息准则(AIC,Akaike Information Criterion)来判断各分期系统对预后总的评估能力。
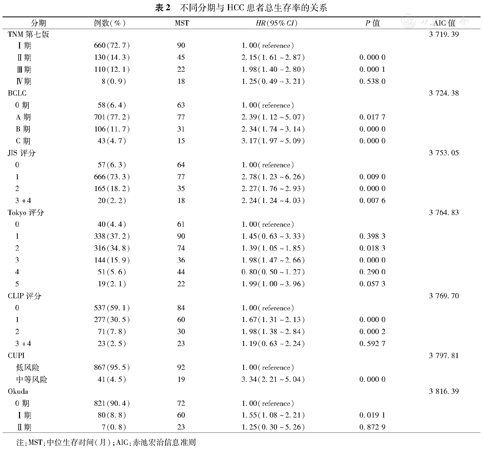
Kaplan–Meier生存曲线及Log–rank检验结果显示,BCLC与JIS分期系统中各期之间差异有统计学意义(P<0.05);TNM第七版中Ⅰ、Ⅱ、Ⅲ期间差异有统计学意义,但Ⅲ、Ⅳ期间差异无统计学意义(P=0.538);Tokyo评分0分与1分组(P=0.398),3分与4分组(P=0.290)之间差异无统计学意义;本研究CUPI分期只包含低危组和中危组,两分期间差异有统计学意义(P=1.03×10–8);CLIP分期中2分组与3,4组之间差异无统计学意义(P=0.805及P=0.073);OkudaⅠ、Ⅱ期间差异无统计学意义(P=0.872)。采用SAS软件计算各自的AIC值,结果显示TNM第七版具有最小的AIC值(3 719.39),其次为BCLC分期(3 724.38)。
TNM第七版分期对于肝细胞癌的生存情况具有较好的预测作用,是一种较适用于国人的肝细胞癌分期方法。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝细胞癌(HCC)为全球第六大常见恶性肿瘤,每年约有75万HCC新发患者,居恶性肿瘤死亡率第3位[1,2]。我国HCC的死亡率居恶性肿瘤死亡率的第2位,占全世界HCC死亡人数的50%以上[3]。全世界HCC病因有所不同,日本及欧美等发达国家以丙型肝炎肝硬化及酒精性肝硬化为主,而中国主要由乙型肝炎肝硬化所致。由于全球HCC的病因和地域性差异,导致全世界HCC发病机制及预后不尽相同,因此全球尚无统一的HCC的分期标准[4,5]。目前最常用的分期主要包括以下7种:TNM分期第七版[6],巴塞罗那评分(Barcelona Clinic Liver Cancer staging system,BCLC)[7],日本JIS分期[8],日本Tokyo分期[9],香港中文大学预后指数(Chinese University Prognostic Index grade,CUPI)[10],意大利肝癌协作组评分(Cancer of the Liver Italian Program,CLIP评分)[11]以及日本Okuda分期[12]。以上7种分期中,BCLC及CLIP分期在西方国家广为接受,对于亚太地区而言,TNM分期及JIS分期则被认为是较合适的分期方法。2002年,香港中文大学通过研究乙型肝炎病毒(HBV)感染为主的中国HCC患者的临床资料,创建出CUPI分期,意在制定一种适合于中国人的分期标准,但此分期系统受到计算方法冗繁等多种因素制约,临床应用受到限制。本研究通过回顾性分析中国医学科学院肿瘤医院连续908例HCC患者的临床资料,试图寻找适合于HBV感染为主的中国HCC患者最佳分期标准。
选取1999年1月至2010年12月间在我院住院的HCC手术患者,共计908例。其中男785例(86.5%),女123例(13.5%),平均年龄55.0岁,肿瘤平均直径4.0 cm,Child–Pugh分级:A级885例(97.5%),B级23例(2.5%)。肿瘤单发755例(83.1%),肿瘤多发153例(16.9%)。临床特点为脉管癌栓87例,大血管侵犯24例,区域淋巴结转移8例,肿瘤破裂/肝外侵犯33例。血清白蛋白38.8~44.7 g/L,总胆红素:14.00(10.50~18.64) μmol/L,甲胎蛋白(AFP)24.11(4.47~451.73) μg/L。189例有酗酒史,719例无酗酒史。患者中位生存期28个月。术后标本均经病理证实为HCC。
本组908例患者均接受了外科手术治疗,术中采用肝门阻断方式比例16.1%(146/908),平均时间17.0 min。手术方式包括根治性治疗方法(病理证实切缘阴性或术后3个月内影像学未见肿瘤复发):根治性肝切除术853例(93.9%),经腹射频消融术11例(1.2%);姑息性治疗方法(病理证实切原阳性或术后3个月内影像学提示肿瘤复发):姑息性肝切除术24例(2.6%),无水乙醇注射20例(2.2%)。431(47.5%)例患者术后采用介入治疗、全身化疗、射频消融、靶向药物治疗等辅助治疗方法;剩余477(52.5%)未进行系统辅助治疗。
采用SPSS 13.0以及SAS 9.0统计软件分析。计数资料采用χ2检验;计量资料采用t检验。应用SPSS软件进行生存分析,绘制Kaplan–Meier生存曲线,并进行Log–rank检验,再采用Cox回归分析进行单因素和多因素分析。均以P<0.05为差异有统计学意义。采用SAS软件计算各分期系统赤池宏治信息准则(AIC),入选标准0.1,排除标准0.05。AIC数值越小,表示其所对应分期的预后判断力越好。
按照以下标准评估各分期方法的区分度:(1)同质性:同一期别的患者预后差别较小;(2)判别力:相比同期别之内的患者,不同期别患者之间,预后差别要大得多;(3)梯度单一性:某一分期系统分出的预后较好的患者,其生存时间总是大于同一分期方法所分的预后较差者。以上区分度的判断应用Log–rank检验计算。一个优秀的分期除了应该具备较好的区分度之外,更重要的是应该具有良好的预后判断能力。本研究通过AIC结果来判断各分期系统对预后总的评估能力。统计学处理由中国医学科学院肿瘤研究所病因学教研室完成。
患者共计908例。随访通过以下方式进行:我院随访组信件随访、我院患者随访的病历资料以及电话随访。末次随访时间2011年12月,失访105例,随访到的手术患者共计908例,随访率89.6%,随访时间2~144个月。
本组908例HCC患者术后1、3、5年生存率为92.1%、70.2%、53.7%,术后1、3、5年无复发生存率为73.7%、52.9%、40.4%。单因素生存分析显示:Child–Pugh分级较高者、肿瘤多发、伴有临床症状、脉管瘤栓、大血管瘤栓、淋巴结转移、肿瘤侵犯除胆囊外的临近器官或穿透肝被膜、AFP≥400 μg/L、ALP≥2倍正常值上限、肿瘤≥5 cm以及术中输血影响肝细胞癌术后总生存率(P<0.05)。COX多因素生存分析显示:Child–Pugh分级较高者、肿瘤多发、脉管瘤栓、大血管瘤栓、淋巴结转移、肿瘤侵犯除胆囊外的临近器官或穿透肝被膜、AFP≥400 μg/L、碱性磷酸酶(ALP)≥2倍正常值上限以及术中输血是影响预后的独立因素(P<0.05)(表1)。
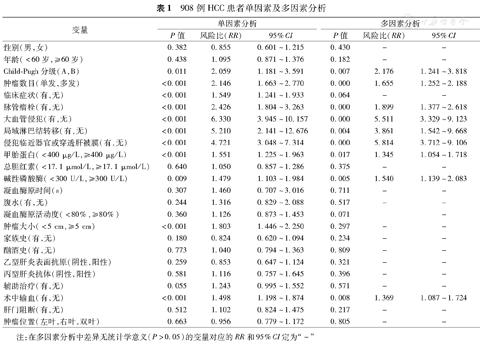
908例HCC患者单因素及多因素分析
908例HCC患者单因素及多因素分析
| 变量 | 单因素分析 | 多因素分析 | ||||
|---|---|---|---|---|---|---|
| P值 | 风险比(RR) | 95%CI | P值 | 风险比(RR) | 95%CI | |
| 性别(男,女) | 0.382 | 0.855 | 0.601~1.215 | 0.430 | – | – |
| 年龄(<60岁,≥60岁) | 0.438 | 1.095 | 0.871~1.376 | 0.182 | – | – |
| Child–Pugh分级(A,B) | 0.011 | 2.059 | 1.181~3.591 | 0.007 | 2.176 | 1.241~3.818 |
| 肿瘤数目(单发,多发) | <0.001 | 2.146 | 1.663~2.770 | 0.000 | 1.655 | 1.252~2.188 |
| 临床症状(有,无) | <0.001 | 1.549 | 1.241~1.933 | 0.064 | – | – |
| 脉管瘤栓(有,无) | <0.001 | 2.426 | 1.804~3.263 | 0.000 | 1.899 | 1.377~2.618 |
| 大血管侵犯(有,无) | <0.001 | 6.330 | 3.945~10.157 | 0.000 | 5.511 | 3.329~9.123 |
| 局域淋巴结转移(有,无) | <0.001 | 5.210 | 2.141~12.676 | 0.004 | 3.861 | 1.542~9.668 |
| 侵犯临近器官或穿透肝被膜(有,无) | <0.001 | 4.721 | 3.048~7.314 | 0.000 | 5.814 | 3.712~9.106 |
| 甲胎蛋白(<400 μg/L,≥400 μg/L) | <0.001 | 1.551 | 1.225~1.963 | 0.017 | 1.345 | 1.054~1.718 |
| 总胆红素(<17.1 μmol/L,≥17.1 μmol/L) | 0.640 | 1.050 | 0.857~1.286 | 0.375 | – | – |
| 碱性磷酸酶(<300 U/L,≥300 U/L) | 0.009 | 1.479 | 1.103~1.984 | 0.005 | 1.540 | 1.139~2.083 |
| 凝血酶原时间(s) | 0.307 | 1.460 | 0.707~3.016 | 0.711 | – | – |
| 腹水(有,无) | 0.244 | 1.316 | 0.829~2.088 | 0.517 | – | – |
| 凝血酶原活动度(<80%,≥80%) | 0.360 | 1.126 | 0.873~1.453 | 0.071 | – | |
| 肿瘤大小(<5 cm,≥5 cm) | <0.001 | 1.803 | 1.446~2.250 | 0.297 | – | – |
| 家族史(有,无) | 0.180 | 0.824 | 0.620~1.094 | 0.234 | – | – |
| 酗酒史(有,无) | 0.773 | 1.040 | 0.794~1.363 | 0.809 | – | – |
| 乙型肝炎表面抗原(阴性,阳性) | 0.259 | 0.853 | 0.647~1.124 | 0.321 | – | – |
| 丙型肝炎抗体(阴性,阳性) | 0.581 | 1.116 | 0.757~1.645 | 0.396 | – | – |
| 辅助治疗(有,无) | 0.055 | 1.243 | 0.995~1.552 | 0.571 | – | – |
| 术中输血(有,无) | <0.001 | 1.498 | 1.198~1.874 | 0.008 | 1.369 | 1.087~1.724 |
| 肝门阻断(有,无) | 0.512 | 1.102 | 0.824~1.475 | 0.217 | – | – |
| 肿瘤位置(左叶,右叶,双叶) | 0.663 | 0.956 | 0.779~1.172 | 0.805 | – | – |
注:在多因素分析中差异无统计学意义(P>0.05)的变量对应的RR和95%CI定为"–"
BCLC与JIS分期系统中各期之间差异有统计学意义(P<0.05);TNM第七版中Ⅰ、Ⅱ、Ⅲ期间差异有统计学意义,但Ⅲ、Ⅳ期间差异无统计学意义(P=0.538);Tokyo评分0分与1分组(P=0.398),3分与4分组(P=0.290)之间差异无统计学意义;本研究CUPI分期只包含低危组和中危组,两分期间差异有统计学意义(P<0.01);CLIP分期中2分组与3、4分组之间差异无统计学意义(P=0.805及P=0.073);OkudaⅠ、Ⅱ期间差异无统计学意义(P=0.872)。以上结果提示BCLC和JIS分期具有相对较好的区分度。
对COX回归单因素分析显示有统计学意义的分期系统,采用SAS软件计算各自的AIC值(表2),结果显示TNM第七版具有最小的AIC值(3 719.39),其次为BCLC分期(3 724.38)。提示在预后评估力方面,TNM第七版具有优势,BCLC次之。
不同分期与HCC患者总生存率的关系
不同分期与HCC患者总生存率的关系
| 分期 | 例数(%) | MST | HR(95%CI) | P值 | AIC值 | |
|---|---|---|---|---|---|---|
| TNM第七版 | 3 719.39 | |||||
| Ⅰ期 | 660(72.7) | 90 | 1.00(reference) | |||
| Ⅱ期 | 130(14.3) | 45 | 2.15(1.61~2.87) | 0.000 0 | ||
| Ⅲ期 | 110(12.1) | 22 | 1.98(1.40~2.80) | 0.000 1 | ||
| Ⅳ期 | 8(0.9) | 18 | 1.25(0.49~3.21) | 0.538 0 | ||
| BCLC | 3 724.38 | |||||
| 0期 | 58(6.4) | 63 | 1.00(reference) | |||
| A期 | 701(77.2) | 77 | 2.39(1.12~5.07) | 0.017 7 | ||
| B期 | 106(11.7) | 31 | 2.34(1.74~3.14) | 0.000 0 | ||
| C期 | 43(4.7) | 15 | 3.17(1.97~5.09) | 0.000 0 | ||
| JIS评分 | 3 753.05 | |||||
| 0 | 57(6.3) | 64 | 1.00(reference) | |||
| 1 | 666(73.3) | 77 | 2.78(1.23~6.26) | 0.009 0 | ||
| 2 | 165(18.2) | 35 | 2.27(1.76~2.93) | 0.000 0 | ||
| 3+4 | 20(2.2) | 18 | 2.24(1.24~4.03) | 0.007 6 | ||
| Tokyo评分 | 3 764.83 | |||||
| 0 | 40(4.4) | 61 | 1.00(reference) | |||
| 1 | 338(37.2) | 90 | 1.45(0.63~3.33) | 0.398 3 | ||
| 2 | 316(34.8) | 74 | 1.39(1.05~1.85) | 0.018 3 | ||
| 3 | 144(15.9) | 36 | 1.98(1.47~2.66) | 0.000 0 | ||
| 4 | 51(5.6) | 44 | 0.80(0.50~1.27) | 0.290 0 | ||
| 5 | 19(2.1) | 22 | 1.99(1.00~3.96) | 0.057 3 | ||
| CLIP评分 | 3 769.70 | |||||
| 0 | 537(59.1) | 84 | 1.00(reference) | |||
| 1 | 277(30.5) | 60 | 1.67(1.31~2.13) | 0.000 0 | ||
| 2 | 71(7.8) | 30 | 1.98(1.38~2.84) | 0.000 2 | ||
| 3+4 | 23(2.5) | 23 | 1.19(0.63~2.24) | 0.592 7 | ||
| CUPI | 3 797.81 | |||||
| 低风险 | 867(95.5) | 92 | 1.00(reference) | |||
| 中等风险 | 41(4.5) | 19 | 3.34(2.21~5.04) | 0.000 0 | ||
| Okuda | 3 816.39 | |||||
| 0期 | 821(90.4) | 72 | 1.00(reference) | |||
| Ⅰ期 | 80(8.8) | 60 | 1.55(1.08~2.21) | 0.019 1 | ||
| Ⅱ期 | 7(0.8) | 23 | 1.25(0.30~5.26) | 0.872 9 | ||
注:MST:中位生存时间(月);AIC:赤池宏治信息准则
肿瘤的分期系统对于治疗方案的选择以及肿瘤预后的判断具有重要意义[13]。除HCC等少数肿瘤外,目前绝大多数实体性肿瘤均有全球普遍公认的分期方法[14]。由于全世界HCC具有明显的区域分布性以及病因的异质性,导致肿瘤发生机制及预后不尽相同[15]。因此,目前全球尚无统一的HCC分期方法。与发达国家不同,我国HCC患者主要以HBV所致为主,因此寻找适合于国人的HCC分期系统对于临床诊治意义重大。本研究试图寻找适合于中国HCC患者最佳的分期标准。
TNM分期又称美国癌症联合会分期系统(AJCC),2009年更新至第七版。TNM分期在亚太地区被认为是一种较好的分期系统[16],但其最大缺点在于不包括肝脏功能的评价,而目前普遍认为肝脏功能是影响肝癌预后的重要因素[4],为什么本研究结论支持TNM分期具有最佳的预后判断力?通过对本组资料进一步分析后发现:本研究入组病例全部为可手术患者,Child–Pugh分级中绝大部分为A级(97.5%,885例),因此肝脏背景对于肝癌预后的影响在本研究中可以忽略。需要指出的是,虽然本研究提示TNM第七版具有最佳的预后判断力,但其对于晚期患者的区分度较差(Ⅲ、Ⅳ期间P=0.538),其原因可能在于:(1)由于本研究中晚期患者比例较低导致研究结果偏倚。(2)TNM第七版分期对于HBV相关的晚期肝癌患者的区分度确实具有局限性。因此在以后的研究中尚需扩大样本量来明确TNM第七版对于晚期肝癌的区分度。
另外,BCLC分期不仅包含肿瘤情况、肝功能评估(Child–Pugh分级)以及体力评分(ECOG评分),还推荐各分期的治疗方式,因此在欧美国家被认为是一种较好的分期方法[17]。但对于亚太地区而言,由于各研究中心结果不一,因此BCLC对于HCC分期的价值有待进一步证实。本研究证实:BCLC分期系统内各分期具有良好的区分度(P<0.05),并且对于预后总的判断力紧次于TNM第七版,提示BCLC分期也是一种较好的分期方法。JIS分期系统和Tokyo分期系统在日本被认为是一种较好的分期方法,本研究表明这两种分期系统对于我院资料的预后判断力以及内部各分期的区分度尚不令人满意。对于CUPI分期而言,国内外文献报道该分期存在以下缺点:(1)由于此分期设计时入组病例主要为晚期患者(可手术患者仅占10.4%),因此CUPI对于早期患者预后的判断存在缺陷[18]。(2)CUPI分期中包含的TNM第五版明显弱于现在的TNM第七版。(3)CUPI分期仅包含低位组、中危组以及高危组3组,本研究中部分BCLC或TNM分期为晚期的患者在CUPI中仅为中期,表明CUPI对于中晚期患者的区分度具有局限性。有报道表明CLIP分期对于晚期肝癌评估具有一定优势[17]。然而CLIP分期具有以下缺点:(1)该分期中对于肿瘤大小的定义过于粗略(以是否大于肝脏总体积的50%划分)。(2)许多中晚期肿瘤被划分为CLIP分期中的早期(0~2分),而晚期患者(4~6分)所占比重较少,从而影响其对晚期肿瘤的预后的判断力[19]。Okuda分期是由日本学者创立的第一个肝癌分期系统,随着各种新的分期的不断创立,Okuda分期在临床中的价值逐渐被其他分期所取代。
总之,综合比较以上各种分期,TNM第七版具有最佳的预后判断能力,是一种较适用于乙型肝炎病毒感染为主的国人的肝细胞癌分期方法。



























