
探讨地黄、紫草、丹皮3种不同中草药所含药效成分对HaCaT细胞增殖的影响。
采用10 μg/L角质形成细胞生长因子诱导HaCaT细胞过度增殖模型。运用CCK–8法及流式细胞仪分别检测梓醇、左旋紫草素、丹皮酚对模型细胞的增殖和细胞周期的变化。
左旋紫草素(≥10–6mol/L)和丹皮酚(≥1.88×10–4mol/L)均可抑制细胞模型的增殖,梓醇(≥10–6mol/L)可促进细胞模型的增殖。与HaCaT细胞生长因子模型组比较,左旋紫草素(≥10–6mol/L)和丹皮酚(≥1.88×10–4mol/L)可抑制HaCaT细胞进入S期及G2M期,梓醇(≥10–6mol/L)可促使HaCaT细胞进入S期,但G2M期差异无统计学意义。
左旋紫草素、丹皮酚能够抑制HaCaT细胞的增殖,梓醇可促进HaCaT细胞的增殖。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
银屑病是一种常见的慢性复发性炎症性皮肤病,临床以红色斑丘疹、斑块,表面覆以银白色鳞屑为特征。目前认为,银屑病是由T细胞介导的遗传性免疫病[1],以角质形成细胞过度增殖[2]及异常分化,炎症细胞浸润,真皮血管增生等为病理基础。角质形成细胞的细胞功能的改变与银屑病的发生发展有着密切的关系[3]。
HaCat细胞是正常突变的永生化人角质形成细胞株,许多生物学特性与原代人表皮角质形成细胞(KC)形同,Finch等[4]学者也都采用HaCat细胞株作为银屑病研究模型。本研究采用角质形成细胞生长因子(KGF)诱导角质形成细胞株(HaCaT细胞)过度增殖模型模拟银屑病角质形成细胞表皮过度增殖状态,分别观察不同浓度梓醇、左旋紫草素、丹皮酚(其中梓醇、左旋紫草素、丹皮酚分别是从地黄、紫草、牡丹皮的提取的主要活性成分之一)对HaCaT细胞增殖、细胞生长曲线及细胞周期的影响。从调节角质形成细胞增殖角度以期探索生地、紫草、牡丹皮治疗银屑病可能的作用机制。
梓醇(购自中国药品生物制品检定所,编号110808);左旋紫草素(购自中国药品生物制品检定所,编号769);丹皮酚(购自中国药品生物制品检定所,编号110708)。梓醇4 mg加入5%胎牛血清(FBS)(GIBICO,美国)的DMEM培养基(Hyclone,美国)11 ml,工作液浓度10–3 mol/L,丹皮酚10 mg加入100 μl甲醇溶解,再加入5%FBS的DMEM培养基40 ml,工作液浓度1.51×10–3 mol/L,左旋紫草素3 mg加入100 μl无水乙醇溶解,再加入5%FBS的DMEM培养基10.3 ml,工作液浓度10–3 mol/L(以上工作液浓度均根据等效计量及预实验确定最佳浓度)。加药时梓醇终浓度为10–3mol/L、10–4mol/L、10–5mol/L、10–6mol/L、10–7mol/L;丹皮酚终浓度为9.41×10–5 mol/L、1.88×10–4mol/L、3.76×10–4 mol/L、7.53×10–4 mol/L、1.51×10–3mol/L;左旋紫草素终浓度为10–3mol/L、10–4mol/L、10–5mol/L、10–6mol/L、10–7mol/L,共计15组。
HaCaT细胞购自中国医学科学院北京协和医学院细胞中心。HaCaT细胞用含10%FBS的DMEM培养基于37 ℃、5%CO2培养箱中培养,2~3 d更换培养基1次,当细胞80%融合状态时传代。选择对数生长期的HaCaT细胞进行实验。
将HaCaT细胞以3×103/孔的密度接种到96孔板中,分为药物干预组15组、KGF(Perotech,美国)对照组及无药对照组,每组15个复孔。用含10%FBS的DMEM培养基在培养箱中常规培养培养24 h后各加入5%FBS的DMEM培养基100 μl。药物干预组加入KGF(10 μg/L)后1 h加入对应浓度的药物,KGF对照组加入KGF(10 μg/L),无药对照组不加试剂。每24 h各组分别取3孔细胞,倒置显微镜下观察细胞形态后,吸弃培养基,用PBS缓冲液洗涤细胞1次,每孔加入含有10% CCK–8检测液的DMED培养基各100 μl,将96孔板置于37 ℃、5%CO2培养箱内孵育4 h后在震荡器上震荡混匀10 s,酶标仪(353,Thermo,美国)检测450 nm下的吸光度(A)值。
将HaCaT细胞以3×105/孔的密度接种到6孔板中,分组方法同上,每组3个复孔。37 ℃、5%CO2培养箱内培养24 h后弃培养基,PBS去除残留于细胞表面的血清成分后加入0.2%FBS的DMEM培养基,置于培养箱内常规培养18 h后按照上述方法干预细胞,继续培养24 h后弃培养基,用PBS缓冲液洗涤细胞1次。0.25%胰蛋白酶(HyClone,美国)消化8 min、2 000 r/min,离心5 min,PBS重悬细胞,转移至1.5 ml EP管中,调整细胞密度至约1×106 /管,离心后4 ℃ 70%乙醇1 ml重悬细胞,4 ℃冰箱中固定过夜;离心后PBS重悬细胞洗去乙醇,重复2次,细胞重悬于100 μl RNaseA(GIBCO,美国),37 ℃水浴30 min后加入400 μl碘化丙啶(BD,美国)避光染色30 min。流式细胞仪(EPICS–XL,Beckman Coulter,美国)检测各组的细胞周期百分数。
统计学处理应用SPSS 17.0软件,数据以 ±s表示,采用t检验分别检验3种中药单体与模型对照组的各组数据,模型对照组与无药对照组的各组数据。P<0.05为差异有统计学意义。
±s表示,采用t检验分别检验3种中药单体与模型对照组的各组数据,模型对照组与无药对照组的各组数据。P<0.05为差异有统计学意义。
细胞加药培养24 h后的形态见图1。加药24 h后,KGF对照组与无药对照组相比,A值及促增殖率明显增高(P<0.01)。与模型对照组相比,浓度高于或等于10–6mol/L的左旋紫草素组和浓度高于或等于1.88×10–4mol/L的丹皮酚组A值低于模型对照组(P<0.05),并且对细胞产生抑制作用。细胞生长抑制率呈浓度依赖性,浓度越大,抑制性越强;加入左旋紫草素和丹皮酚培养1 d后起,左旋紫草素和丹皮酚对细胞模型显示出明显的抑制作用,随着作用时间延长,生长抑制率降低。浓度高于或等于10–6mol/L的梓醇组A值高于模型对照组(P<0.05),梓醇促增殖率呈浓度依赖性,浓度越大,其促增殖作用越强,但浓度为10–3mol/L时,其促增殖作用反而减弱,加入梓醇培养1 d后起,梓醇对细胞模型显示出明显的促进作用,随着作用时间延长,促增殖率降低(表1、图2)。


A:无药对照组;B:KGF对照组(10 μg/L);C:梓醇干预组(10–4mol/L);D:左旋紫草素干预组(10–3mol/L),E:丹皮酚干预组(1.51×10–3mol/L)
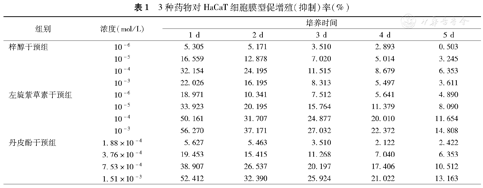
3种药物对HaCaT细胞膜型促增殖(抑制)率(%)
3种药物对HaCaT细胞膜型促增殖(抑制)率(%)
| 组别 | 浓度(mol/L) | 培养时间 | ||||
|---|---|---|---|---|---|---|
| 1 d | 2 d | 3 d | 4 d | 5 d | ||
| 梓醇干预组 | 10–6 | 5.305 | 5.171 | 3.510 | 2.893 | 0.503 |
| 10–5 | 16.559 | 12.878 | 7.020 | 5.014 | 3.245 | |
| 10–4 | 32.154 | 24.195 | 11.515 | 8.679 | 6.353 | |
| 10–3 | 22.026 | 16.195 | 8.313 | 5.497 | 3.611 | |
| 左旋紫草素干预组 | 10–6 | 18.971 | 10.341 | 7.512 | 5.641 | 4.890 |
| 10–5 | 33.923 | 20.195 | 15.764 | 11.379 | 8.090 | |
| 10–4 | 50.161 | 31.707 | 24.877 | 20.010 | 11.654 | |
| 10–3 | 56.270 | 37.171 | 27.032 | 22.372 | 14.808 | |
| 丹皮酚干预组 | 1.88×10–4 | 5.627 | 5.463 | 3.510 | 2.122 | 2.422 |
| 3.76×10–4 | 19.453 | 15.415 | 11.268 | 7.040 | 6.353 | |
| 7.53×10–4 | 38.907 | 26.537 | 20.197 | 17.406 | 10.512 | |
| 1.51×10–3 | 52.412 | 32.390 | 25.924 | 21.022 | 13.163 | |
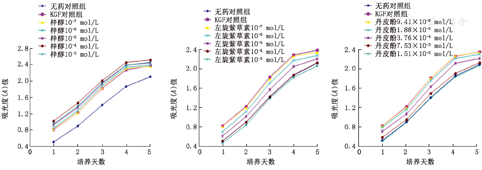

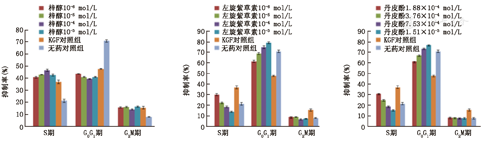
与无药对照组相比,KGF对照组进入S和G2/M期的HaCaT细胞增多,G0/G1期细胞减少(P<0.01)。与KGF对照组相比,浓度高于或等于10–6mol/L的左旋紫草素组和浓度高于或等于1.88×10–4 mol/L的丹皮酚组进入S期的HaCaT细胞减少(P<0.01);浓度高于或等于10–7mol/L的左旋紫草素组和浓度高于或等于9.41×10–5mol/L的丹皮酚组G0/G1期的细胞增多(P<0.01),G2/M期的细胞减少(P<0.01);抑制作用呈浓度依赖性,浓度越大,抑制作用越强。浓度高于或等于10–6mol/L的梓醇组进入S期的细胞增加(P<0.05),G0/G1期减少(P<0.01),呈浓度依赖性,最佳浓度是10–4mol/L;G2/M期差异无统计学意义(P>0.05)。各组均未见凋亡峰(表2、图3,图4)。
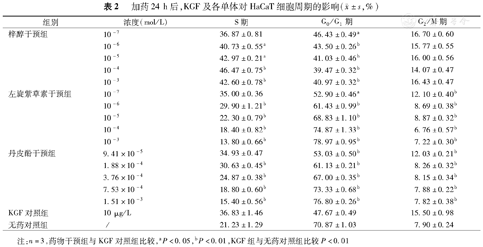
加药24 h后,KGF及各单体对HaCaT细胞周期的影响( ±s,%)
±s,%)
加药24 h后,KGF及各单体对HaCaT细胞周期的影响( ±s,%)
±s,%)
| 组别 | 浓度(mol/L) | S期 | G0/G1期 | G2/M期 |
|---|---|---|---|---|
| 梓醇干预组 | 10–7 | 36.87±0.81 | 46.43±0.49a | 16.70±0.60 |
| 10–6 | 40.73±0.55a | 43.50±0.26b | 15.77±0.55 | |
| 10–5 | 42.97±0.21a | 41.03±0.46b | 16.00±0.56 | |
| 10–4 | 46.47±0.75b | 39.47±0.32b | 14.07±0.47 | |
| 10–3 | 42.60±0.78b | 40.97±0.32b | 16.43±0.47 | |
| 左旋紫草素干预组 | 10–7 | 35.00±0.36 | 52.90±0.46a | 12.10±0.40b |
| 10–6 | 29.90±1.21b | 61.43±0.99b | 8.69±0.38b | |
| 10–5 | 22.30±0.79b | 68.83±1.10b | 8.87±0.32b | |
| 10–4 | 18.40±0.82b | 74.87±1.33b | 6.76±0.57b | |
| 10–3 | 13.80±0.66b | 78.97±0.95b | 7.22±0.30b | |
| 丹皮酚干预组 | 9.41×10–5 | 34.93±0.47 | 53.03±0.50b | 12.03±0.21b |
| 1.88×10–4 | 30.63±0.45b | 61.13±0.21b | 8.26±0.32b | |
| 3.76×10–4 | 24.87±0.38b | 67.00±0.35b | 8.15±0.34b | |
| 7.53×10–4 | 18.80±0.60b | 73.33±0.68b | 7.88±0.22b | |
| 1.51×10–3 | 15.40±0.56b | 76.80±0.26b | 7.82±0.38b | |
| KGF对照组 | 10 μg/L | 36.83±1.46 | 47.67±0.49 | 15.50±0.98 |
| 无药对照组 | ∕ | 21.23±1.29 | 70.87±1.03 | 7.90±0.24 |
注:n=3,药物干预组与KGF对照组比较,aP<0.05,bP<0.01,KGF组与无药对照组比较P<0.01

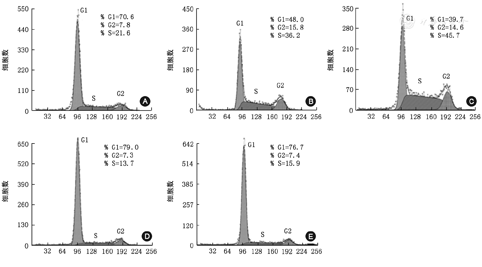

A:无药对照组;B:KGF对照组(10 μg/L);C:梓醇干预组(10–4mol/L);D:左旋紫草素干预组(10–3mol/L);E:丹皮酚干预组(1.51×10–3mol/L)
现代中医认为血热是银屑病的主要原因,中医理论研究表明:"血分郁热"是银屑病的关键病机之一,符合临床实际[5,6]。血热型银屑病相当于银屑病的初期(急性期)是临床表现最典型也最多见的类型[7],主要表现为:皮疹颜色鲜红,脱屑很多,新疹不断出现,瘙痒重,口干喜饮,大便干,小便黄。舌红,苔黄,脉数。经过前期文献检索对寻常型银屑病血热证的中药治疗复方用药规律总结,发现清热凉血药应用最为广泛,运用药物频次最多的三味药分别是:生地、紫草、牡丹皮[8]。临床研究表明,生地、紫草、丹皮对银屑病有很好的治疗作用,但其具体作用机制尚不明确,需要深入研究[9,10]。梓醇、左旋紫草素、丹皮酚分别为地黄、紫草、牡丹皮提取物的主要活性成分之一,可作为替代物用来研究其治疗机制。
调节角质形成细胞的增殖、分化已成为治疗银屑病的重要途径。很多药物或者物理疗法可以通过抑制角质形成细胞的增殖、诱导其凋亡来达到治疗银屑病的目的[11]。KGF是促进角质形成细胞增殖作用强而特异的细胞因子之一,较EGF、TNF–α等促进KC增殖的作用强2~10倍[12]。本实验采用HaCaT细胞体外培养,以KGF为增殖诱导剂(根据预实验,我们选取10 μg/L KGF为KGF诱导HaCaT细胞增殖最佳浓度),模拟银屑病KC细胞过度增殖的病理状态,研究中药单体对银屑病表皮增殖改变的量效关系,从体外实验层面进一步印证了KGF可能是引起银屑病表皮过度增殖的重要致病因子。
通过以上研究中左旋紫草素、丹皮酚对HaCat细胞的增殖有抑制作用,临床中可尝试加对大紫草、丹皮的使用剂量,并进一步验证其对治疗银屑病的作用疗效。梓醇是地黄的有效成分之一,其虽对HaCat细胞的增殖有一定促进作用,但不能排除地黄其他途径对HaCat细胞的影响及效用机制。尽管紫草、丹皮或者是其有效活性的单体左旋紫草素、丹皮酚可以通过抑制角质形成细胞的增殖而成为治疗银屑病的潜在机制,并在临床取得良好效果。但是由于体内外实验的差异,其作用机制和作用靶点的差异还有待于进一步研究。



























