
探讨结直肠癌肝转移术后复发的影响因素及不同复发状态对生存的影响。
回顾性分析北京大学肿瘤医院肝胆外一科结直肠癌肝转移手术切除病例术后复发/转移的影响因素及复发状态对于预后的影响。
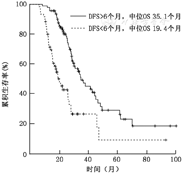
自2000年1月至2013年4月结直肠癌肝转移手术切除术后出现复发转移患者152例。全组中位总生存期(OS) 28.9个月,5年生存率22.1%;全组中位无病生存期(DFS)7.6个月;早期复发/转移组(术后6个月内,n=60)中位生存时间19.4个月,非早期复发组(n=92)中位生存35.1个月(P=0.000);不同复发/转移的器官累及状态对于生存差异无统计学意义,复发转移后手术切除能够改善预后;多因素分析显示,原发病灶的淋巴结转移及肝转移灶的数目是影响复发/转移的独立危险因素;术前新辅助治疗有效(CR+PR)是影响复发的独立保护性因素。
原发病灶的淋巴结转移、肝转移个数,新辅助治疗的疗效是影响结直肠癌肝转移术后复发的主要因素。肝转移复发后的再切除能够改善患者预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌肝转移(CRLM)患者通过以手术为主的综合治疗能够获得长期生存甚至治愈。然而,80%~85%的CRLM手术切除后会出现复发,疾病的复发是影响其预后的主要原因[1]。本研究即探讨影响CRLM术后复发的临床、病理等因素及不同复发时间、状态对于CRLM患者预后的影响。
北京肿瘤医院肝胆胰外一科自2000年1月至2013年4月共收治CRLM手术切除病例241例,其中原发灶及肝转移均R0切除后出现复发和(或)转移的病例152例。本研究即回顾性分析此152例前瞻性留存的临床、手术、病理及随访资料。
除入院常规检查外,肝转移病灶常规行增强MRI和超声造影检查,以诊断及评估肝转移病灶的可切除性。胸部CT及盆腔CT/MRI(部分患者行PET/CT)除外肝外转移。全组患者检测外周血癌胚抗原(CEA)、CA19–9等肿瘤标志物。
根据患者术前评估结果,不可切除CRLM进行转化治疗;可切除CRLM根据患者临床危险评分(CRS)[2],CRS评分较高者推荐患者进行新辅助化疗。化疗选择以奥沙利铂或伊力替康为主的方案,联合或不联合靶向治疗(西妥昔单抗/贝伐珠单抗)。对于新辅助治疗(转化治疗)患者,每2个月复查影像学及肿瘤标志物,根据实体瘤疗效评价标准(RECIST)进行疗效评估。转化治疗后瘤体缩小,残肝足够即可考虑手术切除,新辅助化疗患者得到明确疗效即考虑手术切除,转化/新辅助治疗均不以最大疗效作为手术时机。
充分游离肝脏,观察并触摸肝脏表面,术中超声探查肝实质,逐一核对术前评估所发现的转移灶位置、大小、与血管关系,并记录新发现病灶,根据探查情况确定切除方案。肝转移灶切除一般保证至少5 mm手术切缘。对于位置深在,直径<3 cm,予以联合射频消融治疗达到R0效果,以保留尽量多的正常肝实质。对于化疗后消失的病灶,应尽量予切除,条件不允许(残肝不足/定位困难)则需术后严密随访,发现复发及时采取补救措施(切除/射频消融)。
除不能耐受或证实无效的患者,术后均行辅助化疗,方案选择术前证实有效或以奥沙利铂为基础的化疗方案。
全组患者通过电话及就诊记录随访,无失访。术后每3个月进行影像学(增强腹部CT/MRI/超声)及外周血肿瘤标志物检查。
统计分析使用SPSS软件(Version 19),应用χ2检验(分类变量)和t检验(连续变量)进行不同影响因素组间差异的分析;应用Kaplan–Meier法以及Log–rank进行影响疾病复发的单因素分析;与复发相关的单因素全部代入Cox比例风险回归模型进行多因素分析,得到影响复发的独立因素;显著性差异定义为P<0.05。总生存期(OS)的计算由治疗开始至患者死亡或末次随访,无病生存期(DFS)的计算由手术R0切除开始至患者出现明确证据的复发或转移。基于Couinaud肝脏分段法,规则切除3个肝段及以上为大范围肝切除;切除少于3个肝段的定义为小范围肝切除。可切除肝转移定义为肝转移R0切除后,残余肝体积(肝功能)能够代偿的肝转移,合并肝外转移须肝外转移亦可R0切除。同时性肝转移定义为原发灶诊断同时或之后6个月内发现的肝转移。早期复发定义为肝转移切除后6个月内出现复发/转移。
全组152例CRLM患者男83例,女69例;年龄30~80岁,中位59岁。术后中位随访时间22.0个月(6.0~100.0个月);复发后中位随访时间12.2个月(1.0 ~90.0个月)。全组病例均由手术切除后病理证实或经增强影像学(CT/MRI/超声造影)证实有疾病的复发和(或)转移。全组中位OS 28.9个月(6.4~100.0个月),中位DFS 7.6个月(1~46.5个月)。5年生存率22.1%,生存超5年者11例。
原发及肝转移病灶的特征参见表1,表2。肝转移数目1~12个,中位2个;最大肝转移病灶直径0.9~16.0 cm,中位3.5 cm;合并或可疑肝外转移12例,其中同期切除腹膜转移4例,肺内<1 cm结节不能确认为转移8例。42.1%的患者术前行新辅助治疗或转化治疗(64例,联合靶向治疗19例),化疗持续2~12周期,中位4周期;新辅助治疗根据RECIST标准进行疗效评估,完全缓解(CR)1例,部分缓解(PR)15例,稳定(SD)14例,进展(PD)6例,28例资料不全无法评估。
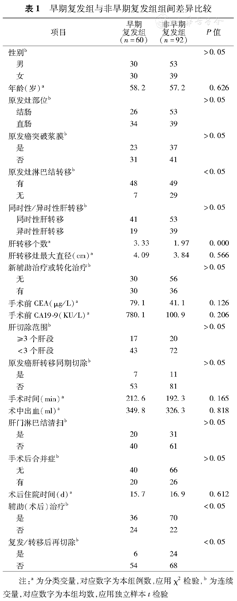
早期复发组与非早期复发组组间差异比较
早期复发组与非早期复发组组间差异比较
| 项目 | 早期复发组(n=60) | 非早期复发组(n=92) | P值 | |
|---|---|---|---|---|
| 性别b | >0.05 | |||
| 男 | 30 | 53 | ||
| 女 | 30 | 39 | ||
| 年龄(岁)a | 58.2 | 57.2 | 0.626 | |
| 原发灶部位b | >0.05 | |||
| 结肠 | 26 | 53 | ||
| 直肠 | 34 | 39 | ||
| 原发癌突破浆膜b | >0.05 | |||
| 是 | 23 | 37 | ||
| 否 | 31 | 41 | ||
| 原发灶淋巴结转移b | <0.05 | |||
| 有 | 48 | 49 | ||
| 无 | 7 | 29 | ||
| 同时性/异时性肝转移b | >0.05 | |||
| 同时性肝转移 | 41 | 53 | ||
| 异时性肝转移 | 19 | 39 | ||
| 肝转移个数a | 3.33 | 1.97 | 0.000 | |
| 肝转移灶最大直径(cm)a | 4.09 | 3.84 | 0.566 | |
| 新辅助治疗或转化治疗b | >0.05 | |||
| 无 | 30 | 56 | ||
| 有 | 30 | 36 | ||
| 手术前CEA(μg/L)a | 79.1 | 41.1 | 0.126 | |
| 手术前CA19–9(KU/L)a | 780.1 | 100.9 | 0.206 | |
| 肝切除范围b | >0.05 | |||
| ≥3个肝段 | 17 | 20 | ||
| <3个肝段 | 43 | 72 | ||
| 原发癌肝转移同期切除b | >0.05 | |||
| 是 | 7 | 11 | ||
| 否 | 53 | 81 | ||
| 手术时间(min)a | 212.6 | 192.3 | 0.165 | |
| 术中出血(ml)a | 349.8 | 326.3 | 0.818 | |
| 肝门淋巴结清扫b | >0.05 | |||
| 是 | 20 | 31 | ||
| 否 | 40 | 61 | ||
| 手术后合并症b | >0.05 | |||
| 无 | 40 | 66 | ||
| 有 | 20 | 26 | ||
| 术后住院时间(d)a | 15.7 | 16.9 | 0.612 | |
| 辅助(术后)治疗b | <0.05 | |||
| 是 | 36 | 70 | ||
| 否 | 24 | 22 | ||
| 复发/转移后再切除b | <0.05 | |||
| 是 | 6 | 24 | ||
| 否 | 54 | 68 | ||
注:a为分类变量,对应数字为本组例数,应用χ2检验,b为连续变量,对应数字为本组均数,应用独立样本t检验
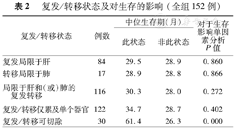
复发/转移状态及对生存的影响(全组152例)
复发/转移状态及对生存的影响(全组152例)
| 复发/转移状态 | 例数 | 中位生存期(月) | 对于生存影响单因素分析P值 | |
|---|---|---|---|---|
| 此状态 | 非此状态 | |||
| 复发局限于肝 | 84 | 29.5 | 28.9 | 0.860 |
| 转移局限于肺 | 17 | 28.9 | 28.8 | 0.866 |
| 局限于肝和(或)肺的复发转移 | 116 | 30.3 | 28.0 | 0.272 |
| 复发/转移仅累及单个器官 | 122 | 34.7 | 28.7 | 0.402 |
| 复发/转移可切除 | 30 | 61.4 | 26.3 | 0.000 |
全组152例中行大范围肝切除的37例(24.3%),小范围肝切除115例,分期肝切除(门静脉栓塞或门静脉结扎)3例;原发灶和肝转移同期切除18例;手术切除联合术中射频消融2例。手术耗时32~600 min,中位190 min;手术出血10~6 500 ml,中位200 ml;24例患者(15.8%)手术输血。术后住院5~88 d,中位11.5 d;无围手术期死亡;根据术后并发症Clavien分级[3],1~2级并发症26例,3级并发症21例(13.8%)。152例肝转移共切除381个病理证实为转移病灶,148例R0切除,2例联合射频消融后达到R0,2例肿瘤延伸至切缘(R1切除)。106例(69.7%)患者术后行辅助治疗。
早期出现复发/转移(术后6个月内)共60例,早期复发组中位生存时间19.4个月,相比非早期复发组35.1个月(P=0.000)差异有统计学意义(图1)。30例(19.7%)患者复发转移后行再次手术切除。表1显示出早期复发组较非早期复发组在所列临床、手术、病理等因素方面的差异,结果显示两组在原发病灶淋巴结转移,肝转移灶的个数、术后行辅助治疗以及复发转移后再切除4个方面差异有统计学意义。根据复发的不同状态进行分组,不同组间对于生存影响差异无统计学意义;有统计学意义的只有复发/转移手术切除的患者(表2)。

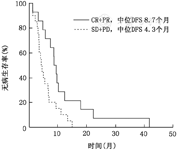
将临床、病理因素对复发的影响进行单因素分析,结果显示原发灶的淋巴结转移,肝转移个数,肝转移分布,原发灶确诊后肝转移出现时间,新辅助治疗疗效,肝切除手术肝门阻断时间,术前CEA水平,术前CA199水平等8项对于无病生存期(即疾病转移/复发)的影响差异有统计学意义(P<0.05)。进而,将上述8项代入Cox模型多因素回归分析,原发灶淋巴结转移、肝转移个数多是影响复发的独立危险因素,术前新辅助治疗有效(CR+PR)(图2)是影响复发的独立保护性因素(表3)。

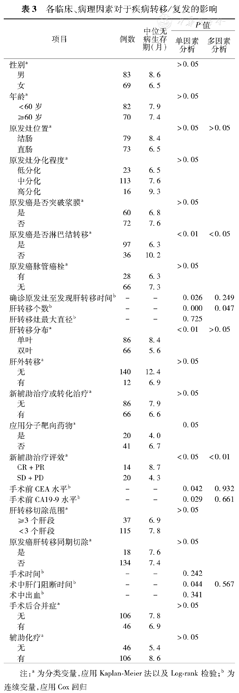
各临床、病理因素对于疾病转移/复发的影响
各临床、病理因素对于疾病转移/复发的影响
| 项目 | 例数 | 中位无病生存期(月) | P值 | ||
|---|---|---|---|---|---|
| 单因素分析 | 多因素分析 | ||||
| 性别a | >0.05 | ||||
| 男 | 83 | 8.6 | |||
| 女 | 69 | 6.5 | |||
| 年龄a | >0.05 | ||||
| <60岁 | 82 | 7.9 | |||
| ≥60岁 | 70 | 7.4 | |||
| 原发灶位置a | >0.05 | >0.05 | |||
| 结肠 | 79 | 8.4 | |||
| 直肠 | 73 | 6.5 | |||
| 原发灶分化程度a | >0.05 | ||||
| 低分化 | 23 | 6.5 | |||
| 中分化 | 113 | 7.6 | |||
| 高分化 | 16 | 9.3 | |||
| 原发癌是否突破浆膜a | >0.05 | ||||
| 是 | 60 | 6.8 | |||
| 否 | 72 | 7.6 | |||
| 原发癌是否淋巴结转移a | <0.01 | <0.05 | |||
| 是 | 97 | 6.3 | |||
| 否 | 36 | 10.2 | |||
| 原发癌脉管癌栓a | >0.05 | ||||
| 有 | 28 | 6.3 | |||
| 无 | 66 | 7.3 | |||
| 确诊原发灶至发现肝转移时间b | – | – | 0.026 | 0.249 | |
| 肝转移个数b | – | – | 0.000 | 0.047 | |
| 肝转移灶最大直径b | – | – | 0.725 | ||
| 肝转移分布a | <0.01 | >0.05 | |||
| 单叶 | 86 | 8.4 | |||
| 双叶 | 66 | 5.6 | |||
| 肝外转移a | >0.05 | ||||
| 无 | 140 | 12.4 | |||
| 有 | 12 | 6.9 | |||
| 新辅助治疗或转化治疗a | >0.05 | ||||
| 无 | 86 | 7.9 | |||
| 有 | 66 | 6.6 | |||
| 应用分子靶向药物a | 0.05 | ||||
| 是 | 20 | 4.0 | |||
| 否 | 41 | 6.7 | |||
| 新辅助治疗评效a | <0.05 | <0.01 | |||
| CR+PR | 14 | 8.7 | |||
| SD+PD | 20 | 4.3 | |||
| 手术前CEA水平b | – | – | 0.042 | 0.932 | |
| 手术前CA19–9水平b | – | – | 0.029 | 0.661 | |
| 肝转移切除范围a | >0.05 | ||||
| ≥3个肝段 | 37 | 6.9 | |||
| <3个肝段 | 115 | 7.8 | |||
| 原发癌肝转移同期切除a | >0.05 | ||||
| 是 | 18 | 7.6 | |||
| 否 | 134 | 7.4 | |||
| 手术时间b | – | – | 0.242 | ||
| 术中肝门阻断时间b | – | – | 0.044 | 0.567 | |
| 术中出血b | – | – | 0.341 | ||
| 手术后合并症a | >0.05 | ||||
| 无 | 106 | 7.8 | |||
| 有 | 46 | 6.9 | |||
| 辅助化疗a | >0.05 | ||||
| 无 | 46 | 5.4 | |||
| 有 | 106 | 8.6 | |||
注:a为分类变量,应用Kaplan–Meier法以及Log–rank检验;b为连续变量,应用Cox回归
CRLM手术切除后复发/转移是影响生存的最直接原因。复发/转移时间的早晚也是影响预后的重要因素,本研究早期复发组中位生存时间19.4个月明显短于非早期复发组35.1个月,类似的结果也在其他中心的研究中发现[4]。表1结果中原发灶淋巴结转移,肝转移个数两组间差异明显,此两项是肿瘤固有的特征(提示肿瘤的生物学行为),非人力所能改变,既往很多研究发现此两项是影响预后(总生存)的危险因素[5]。可见原发灶淋巴结转移及肝转移个数较多的患者因容易出现早期复发和(或)转移,从而生存期较短,预后较差。
另外手术后行辅助化疗和复发后的再切除在两组间的差异同样有统计学意义,此两项均为人为干预的因素,即两组之间的生存差异是由于非早期复发组术后辅助化疗及复发后切除比例高所致。因此,结肠癌肝转移切除后辅助化疗,控制乃至消灭体内微转移及亚临床病灶,有利于延长DFS,进而改善OS。
本组病例CRLM切除后复发/转移的不同状态对生存的影响的单因素分析结果显示差异无统计学意义。而来自于纽约Sloan–Kettering癌症医院回顾性分析了6年间637例CRLM手术切除病例[4],393例术后复发,结果发现复发/转移仅局限于肺的患者早期复发的比例较低,预后优于复发局限于肝或累及单个器官者,复发累及多个脏器者预后最差,各组间生存差异具有统计学意义。本研究并未发现组间生存差异可能与如下因素有关:(1)部分病例后续随访及治疗未在我中心进行,造成复发和(或)转移未能及时发现,延误再次根治性治疗的时机,本组复发转移的再切除率仅为19.7%低于Sloan–Kettering报道的30%。(2)Sloan–Kettering报道的复发/转移单独累及肝或肺的比例各约30%,而本组病例仅累及肝为54.9%,仅累及肺为11.1%,造成肝内复发比例较高的原因可能是Sloan–Kettering肝转移切除后更多进行肝动脉灌注化疗联合全身化疗,而本组病例以仅全身化疗为主,但目前肝动脉灌注化疗对于CRLM的作用尚无可靠地循证医学证据[6]。(3)本研究病例数较少,统计学上未观察到差别。两个研究共同之处是复发/转移的再切除能够延长OS。因此,手术后规律复查尽早发现肿瘤的复发/转移,对于能够再次切除的病灶进行再切除,是延长OS的重要手段;再次切除的手术安全性及疗效在之前我中心的论著中已有阐述[7]。而过早的复发/转移可能归因于手术前的评估不全或者肿瘤的生物学行为不佳,前者应该通过更详细术前评估加以避免,如高质量的MRI、多种增强影像学联合评估等;而后者常表现为多器官受累,往往病情进展迅速,预后差。
本研究的另一个影响复发的独立因素是新辅助治疗的疗效,虽然资料齐全可评估仅35例,依然得出阳性结果。新辅助治疗有效(CR+PR)组中位无病生存期8.7个月,长于SD+PD组的4.3个月逾1倍。有效的新辅助治疗(转化治疗)可以在术前消灭亚临床的微转移病灶,减少复发,改善预后。Adam等[8]回顾性分析131例多发CRLM,按新辅助治疗疗效(PR、SD、PD)分为3组,结果显示无论在DFS还是OS方面,PR组、SD组均优于PD组,提示新辅助治疗疗效有助于CRLM手术切除预后的判断。因此,新辅助治疗后疾病进展,即使手术切除,短期复发/转移的机会很高,预后差。此外,新辅助治疗能够筛选有效地治疗方案,供术后辅助治疗应用,以减少复发转移,改善预后。
原发病灶的淋巴结转移、肝转移个数是CRLM手术切除后复发的独立危险因素,有效的新辅助治疗(转化治疗)是独立的保护性因素。CRLM手术切除后早期复发/转移提示预后不良;复发/转移累及器官的状态对生存没有显著影响,但复发/转移后的再切除能够显著延长生存。



























