
了解进展期低位直肠癌新辅助治疗后肿瘤距肛缘距离、手术方式对生存预后的影响。
回顾性分析北京协和医院2005至2012年收治的接受新辅助治疗的中低位直肠癌患者135例,其中男79例,女56例;平均年龄(58±12)岁;肿瘤距肛缘平均(5.2±2.1)cm。分析性别、年龄、肿瘤距肛缘距离、手术方式、T分期降期情况、治疗后淋巴结状况等因素对3年无病生存(DFS)率的影响。
本组患者总体3年DFS率为85.2%(115/135)。135例患者中95例行括约肌保留完整的术式,其中前切除术79例、经前会阴超低位直肠前切除术(APPEAR)12例、Hartmann术3例和结肠肛管吻合术(Parks术)1例;40例患者部分或完全切除括约肌,其中经腹会阴联合切除术(APR)39例、内括约肌切除术(ISR)1例。保留括约肌与切除括约肌患者的DFS差异无统计学意义[85.3%(81/95)比85.0%(34/40),χ2=0.000, P=0.985]。肿瘤距肛缘距离2~3、4~5、6~7 cm者DFS分别为81.5%(22/27)、82.5%(47/57)、95.1%(39/41),虽有升高趋势,但前者与后二者比较差异无统计学意义(χ2=3.111、3.522,P=0.078、0.061);6~7 cm的保留括约肌手术组的3年DFS率与2~3 cm的括约肌切除手术组差异无统计学意义[95.0%(38/40)比81.0%(17/21),χ2=2.864,P=0.091],但明显高于4~5 cm的保留括约肌手术组[79.5%(31/39),χ2=4.227,P=0.039]。多因素生存分析提示,仅治疗后淋巴结状况是生存预后的独立影响因素(Wald=4.454,P=0.035)。
新辅助治疗后的术后淋巴结和侧切缘状况仍然是影响生存预后的主要因素;同时也存在肿瘤位置越低,生存预后越差的趋势。对于距离肛缘4~5 cm的直肠癌,虽然能够保留肛门,但没有从生存期中获益。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
自从直肠癌腹会阴联合切除术(APR术)问世百余年以来,观念的改进和技术的革新使得这一传统的手术方式更为精细,病死率和并发症发生率不断下降。但是,自全直肠系膜切除(TME)概念在中低位直肠癌手术中广泛应用以来,外科医生在行APR手术时习惯将直肠系膜游离至自然结束的直肠裂孔处,会阴手术沿外括约肌外侧在直肠裂孔处与腹部术野汇合,如此的手术操作对于临近肛提肌水平的进展期低位直肠癌,很容易出现肿瘤破裂、术后病理发现环周切缘阳性等,这些情况与术后肿瘤复发转移密切相关,因此出现APR手术疗效逊于直肠癌前切除术疗效的现象[1]。直肠癌新辅助治疗能使肿瘤体积缩小,使肿瘤降期。本研究对直肠癌新辅助治疗后APR手术和前切除术之间是否也存在疗效差异进行回顾性分析,现总结如下。
2005至2012年在北京协和医院接受新辅助治疗并外科手术的中低位直肠癌患者,入组标准:病理证实的中低位直肠腺癌,肿瘤下缘距离肛缘10 cm以内;经直肠腔内超声或直肠磁共振成像(MRI)进行分期评估,T3~4或N+并完成新辅助治疗的患者。排除标准:同时性多原发恶性肿瘤;治疗后采用局部切除手术,无法进行完整的TN分期评估者;在术前的评估检查中发现远处脏器转移者。按照筛选标准,共135例中低位直肠癌患者入选,其中男79例、女56例;平均年龄(58±12)岁;肿瘤距肛缘平均(5.2±2.1)cm。
术前肿瘤分期:根据直肠腔内超声和(或)直肠MRI结果,当两种检查存在差别时,以MRI结果为准。术后肿瘤分期:石蜡包埋的组织病理切片(1)原发病灶:充分取材,每隔2~3 mm切片,切片范围覆盖原发病灶(肿瘤或者瘢痕);(2)淋巴结:取全部淋巴结制片;(3)侧切缘:于肉眼判断距病变最近的肠周软组织手术切缘处取材制片,切缘距离肿瘤<1 mm均判断为切缘阳性。病理完全缓解(pCR):手术切除组织标本(包括肠壁和系膜)中未发现肿瘤残余。术前超声或术后病理肿瘤分期分别标记为uTNM和ypTNM,其标准采用TNM分期第7版[2]。新辅助治疗前肿瘤分期(uTNM)主要依赖于直肠腔内超声和直肠MRI,与手术后肿瘤分期(ypTNM)进行比较,以此判定肿瘤分期变化情况;T分期和TNM分期依其期别数目,N分期根据淋巴结阴性或阳性,分为降期、无变化、进展和无法确定等情况。
根据术前直肠指检或纤维结肠镜,两者存在差异时以直肠指检为准。根据肛缘距离分为2~3、4~5、6~7和≥8 cm组。
放疗方案:总剂量50 Gy,分次剂量2 Gy,盆腔照射,共5周内分25次完成。化疗方案:采用同步放化疗,氟尿嘧啶基础之上联合奥沙利铂的方案(FOLFOX 2~3个周期,或XELOX 2个周期)。术后辅助化疗延续术前方案,尽量完成6个月的治疗。放疗结束后4~8周接受外科手术。
外科手术方式:所有病例由同一专业组4位医生按照TME原则实施根治性手术,区域淋巴结清扫至第3站(肠系膜下动脉根部),直肠及系膜的游离均尽量接近盆底的直肠裂孔处。根据是否保留括约肌或肠道重建情况分为前切除术、结肠肛管吻合术(Parks术)、内括约肌切除术(ISR术)、Hartmann术、经前会阴超低位直肠前切除术(APPEAR术)[3]和APR术。根据肛门内外括约肌是否完整保留,将前切除术、Parks术、APPEAR术、Hartmann术归为括约肌保留组,将ISR术和APR术归为括约肌切除组。
术后2年内每3个月复查胸部X线片、腹部B超、血癌胚抗原(CEA)和CA19-9,每年复查1次结肠镜,并用胸腹盆平扫及增强CT替代X线片和B超。术后2年后每6个月复查1次直至术后5年。复查项目中如有异常,进一步行全身骨扫描、MRI、肝脏造影超声、正电子发射断层扫描(PET)-CT等检查以明确复发、转移的定性和定位诊断。术后随访截至2013年6月,平均随访时间为37.1个月(12.0~87.0个月)。
研究的观察终点是局部复发和远处转移,分析肿瘤距肛缘距离以及手术方式等项目与3年无病生存(DFS)率的关系。符合正态分布的计量资料用 ±s表示,计数资料用例(%)表示。采用Kaplan-Meier生存曲线分析DFS的分布情况,Log-rank检验比较亚组之间生存率。年龄、性别、肿瘤距肛缘距离、手术方式、新辅助降期、术后淋巴结状况等多因素生存分析采用Cox回归分析。统计软件采用SPSS 17.0。P<0.05为差异有统计学意义。
±s表示,计数资料用例(%)表示。采用Kaplan-Meier生存曲线分析DFS的分布情况,Log-rank检验比较亚组之间生存率。年龄、性别、肿瘤距肛缘距离、手术方式、新辅助降期、术后淋巴结状况等多因素生存分析采用Cox回归分析。统计软件采用SPSS 17.0。P<0.05为差异有统计学意义。
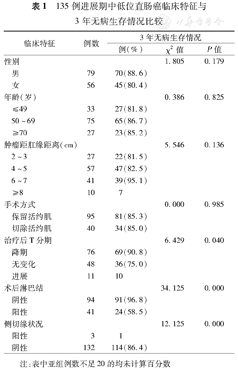
患者具体临床病理特征见表1。135例患者中括约肌保留组95例(70.4%),其中接受前切除术79例、APPEAR手术12例、Hartmann手术3例、Parks术1例;括约肌切除组40例(29.6%),其中APR术39例、ISR术1例。
135例进展期中低位直肠癌临床特征与3年无病生存情况比较
135例进展期中低位直肠癌临床特征与3年无病生存情况比较
| 临床特征 | 例数 | 3年无病生存情况 | |||
|---|---|---|---|---|---|
| 例(%) | χ2值 | P值 | |||
| 性别 | 1.805 | 0.179 | |||
| 男 | 79 | 70(88.6) | |||
| 女 | 56 | 45(80.4) | |||
| 年龄(岁) | 0.386 | 0.825 | |||
| ≤49 | 33 | 27(81.8) | |||
| 50~69 | 75 | 65(86.7) | |||
| ≥70 | 27 | 23(85.2) | |||
| 肿瘤距肛缘距离(cm) | 5.546 | 0.136 | |||
| 2~3 | 27 | 22(81.5) | |||
| 4~5 | 57 | 47(82.5) | |||
| 6~7 | 41 | 39(95.1) | |||
| ≥8 | 10 | 7 | |||
| 手术方式 | 0.000 | 0.985 | |||
| 保留括约肌 | 95 | 81(85.3) | |||
| 切除括约肌 | 40 | 34(85.0) | |||
| 治疗后T分期 | 6.429 | 0.040 | |||
| 降期 | 76 | 69(90.8) | |||
| 无变化 | 48 | 36(75.0) | |||
| 进展 | 11 | 10 | |||
| 术后淋巴结 | 34.125 | 0.000 | |||
| 阴性 | 94 | 91(96.8) | |||
| 阳性 | 41 | 24(58.5) | |||
| 侧切缘状况 | 12.125 | 0.000 | |||
| 阳性 | 3 | 1 | |||
| 阴性 | 132 | 114(86.4) | |||
注:表中亚组例数不足20的均未计算百分数
本组患者的整体3年DFS率为85.2%(115/135)。性别、年龄、肿瘤距肛缘距离、手术方式之间3年DFS差异均无统计学意义(均P>0.05)(表1)。将肿瘤距肛缘距离亚组之间进行比较,2~3 cm组与4~5 cm组、6~7 cm组之间的3年DFS存在升高的趋势,但差异无统计学意义(χ2=3.111、3.522,P=0.078、0.061)。新辅助治疗后T分期降期、术后淋巴结阴性、术后病理侧切缘阴性患者的3年DFS率明显高(均P<0.05)(表1)。本组3例(2.2%)患者的术后病理显示侧切缘阳性,术前肿瘤距肛缘距离分别为3、5和6 cm,分别接受APR、前切除术和APPEAR手术,术后分期分别为T4bN1a、T3N2b和T4bN0;前2例因肿瘤死亡,后1例至随访时DFS 21个月。
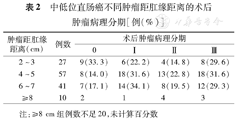
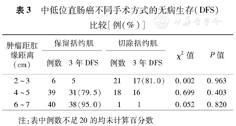
不同肿瘤距肛缘距离患者术后肿瘤病理情况见表2,手术方式见表3。在肿瘤距肛缘距离相同范围内的保留括约肌手术与括约肌切除手术组间3年DFS差异无统计学意义(均P>0.05)(表3);在所有亚组分析中,4~5 cm保留括约肌手术组的DFS最低,为79.5%,由于有些组的患者例数不足20例,未进行每组间的统计分析,6~7 cm的保留括约肌手术组的3年DFS率与2~3 cm的括约肌切除手术组差异无统计学意义(χ2=2.864,P=0.091);但明显高于4~5 cm的保留括约肌手术组(χ2=4.227,P=0.039)。≥8 cm组10例患者均行保留括约肌手术,3年后DFS 7例。
中低位直肠癌不同肿瘤距肛缘距离的术后肿瘤病理分期[例(%)]
中低位直肠癌不同肿瘤距肛缘距离的术后肿瘤病理分期[例(%)]
| 肿瘤距肛缘距离(cm) | 例数 | 后肿瘤病理分期 | |||
|---|---|---|---|---|---|
| 0 | Ⅰ | Ⅱ | Ⅲ | ||
| 2~3 | 27 | 9(33.3) | 6(22.2) | 4(14.8) | 8(29.6) |
| 4~5 | 57 | 8(14.0) | 18(31.6) | 13(22.8) | 18(31.6) |
| 6~7 | 41 | 7(17.1) | 14(34.1) | 8(19.5) | 12(29.3) |
| ≥8 | 10 | 2 | 1 | 4 | 3 |
注:≥8 cm组例数不足20,未计算百分数
中低位直肠癌不同手术方式的无病生存(DFS)比较[例(%)]
中低位直肠癌不同手术方式的无病生存(DFS)比较[例(%)]
| 肿瘤距肛缘距离(cm) | 保留括约肌 | 切除括约肌 | χ2值 | P值 | ||
|---|---|---|---|---|---|---|
| 例数 | 3年DFS | 例数 | 3年DFS | |||
| 2~3 | 6 | 5 | 21 | 17(81.0) | 0.002 | 0.963 |
| 4~5 | 39 | 31(79.5) | 18 | 16 | 0.699 | 0.403 |
| 6~7 | 40 | 38(95.0) | 1 | 1 | 0.052 | 0.820 |
注:表中例数不足20的均未计算百分数
将患者性别、年龄、肿瘤距肛缘距离、是否保留括约肌手术、T分期降期状况、术后淋巴结状况、侧切缘状况等因素进行Cox回归分析,发现仅术后淋巴结状况与患者的3年DFS存在明显相关(Wald=4.454,P=0.035)。
随着全系膜切除[1]、2 cm远切缘[4]等理念的广泛采纳,对于中低位直肠癌的外科手术,无论是前切除术还是APR手术,习惯按照TME的原则游离直肠直至盆底的直肠裂孔处。但是,以此原则实施APR手术似乎已经背离了Miles最初的描述[5]。近10余年来,在重新评价Miles手术时发现患者的远期存活低于前切除手术的患者,究其原因为手术切除范围不足,以致术中肿瘤或肠管破裂、环周切缘阳性等情况[6],最终影响肿瘤学疗效。所以,勿将末段直肠系膜从盆底肌剥离的柱状切除或经肛提肌外的腹会阴联合切除(extralevator abdominoperineal excision, ELAPE)得到越来越多的关注[7],也引起了对于低位直肠癌切除范围的争议[8,9]。
面对这些现象和争议,应该注意这些回顾性研究的缺陷,接受APR手术的肿瘤以末段直肠为主,而接受前切除手术者往往位于中低位直肠。其中的中段直肠肿瘤由于直肠系膜的包绕,环周切缘阳性率低于末段直肠,所以将前切除手术与APR手术笼统地比较其环周切缘有失公允。
理论上,末段直肠癌手术方式的选择和疗效取决于肿瘤的位置和浸润深度。首先,位于临近齿线的肿瘤,如果行保留括约肌手术,势必按照TME原则继续盆底附近直肠的游离。同样,对于APR手术,如果同样按照TME原则游离至盆底,也面临着环周切缘可能阳性的结局。所以,当肿瘤临近齿线时,只要游离至盆底直肠裂孔水平的操作,均会增加肿瘤破裂、环周切缘阳性的可能性。其次,对于侵犯深度T1~2期肿瘤,只要完整切除病变肠段,难以出现环周切缘阳性的情况[10]。在关于以上争论的文献中,很少有研究对肿瘤位置进行仔细分析。因为肿瘤位置是决定手术方式的关键因素之一,对系膜包绕的中段直肠癌实施前切除术,其效果应该优于末段直肠癌的APR手术。
新辅助治疗提高了低位直肠癌术后局部控制率,但对于末段直肠癌的疗效如何,目前还没有循证医学的证据,之前一些比较APR手术和前切除术疗效的临床研究也未纳入新辅助治疗的病例[5]。对于新辅助治疗之后的患者,由于肿瘤在治疗前后出现体积缩小、降期等情况,治疗后的APR手术或前切除术是否存在疗效差距,目前报道不多且存在不同意见[11,12]。本组所有患者均经新辅助治疗,生存分析的结果发现是否保留括约肌的手术方式未对患者的生存预后产生差异。但是对于距离肛缘4~5 cm的直肠癌患者,超低位的保肛手术虽然保留了肛门,却未能让患者从生存期中获益。
根据分析结果认为,术后淋巴结状况和侧切缘状况仍然是影响生存预后的主要因素。对于浸透肠壁全层或累及肛提肌的末段直肠癌,如果按照TME原则将末段直肠系膜从肛提肌表面剥离,将可能出现环周切缘阳性而致术后复发。新辅助治疗的出现,一方面降低了肿瘤的分期,另一方面提升了T0期和T1期患者的比例。所以,新辅助治疗手段可能弱化了ELAPE手术对末段直肠癌的治疗作用,但对于需行腹会阴联合切除的T3~4期末段直肠癌,还是应该按照经肛提肌外切除的原则实施。影像学分期为直肠外科手术解剖和切除范围提供了更为准确的评估信息,多学科团队模式的介入,必将使得直肠癌综合治疗进一步合理化、科学化。虽然本研究临床结果分析发现新辅助治疗后不同手术方式对不同距离的肿瘤可能存在疗效的差距,但是还需进一步大样本量或者随机对照研究的证实。



























