
对住院患者不同部位分离纹带棒状杆菌的分子流行病学特征及耐药性进行分析,为临床进一步认识纹带棒状杆菌临床意义提供新的实验数据和思路。
收集内蒙古医科大学附属医院2013年11月至2014年3月间45例住院患者不同部位分离纹带棒状杆菌45株,采用微量肉汤稀释法进行体外药敏试验;采用盐水棉拭子法对纹带棒状杆菌阳性患者周边环境进行采样、分离纹带棒状杆菌,并对分离的纹带棒状杆菌进行体外药敏试验;进一步采用脉冲场凝胶电泳(PFGE)方法对45株纹带棒状杆菌进行分子分型。
45株纹带棒状杆菌主要分离自神经外科病房(21株)、呼吸内科病房(8株)和重症监护病房(8株),其中39株分离自下呼吸道标本。2013年12月、2014年1月和2014年2月3个月内纹带棒状杆菌呈聚集分布。药敏试验结果显示,青霉素、红霉素、四环素、环丙沙星、克林霉素5种抗菌药物的最小抑菌浓度(MIC90)值≥64 μg/ml;庆大霉素、万古霉素和利福平的MIC90值均为0.5 μg/ml;仅1株分离株对除克林霉素之外的所有抗菌药物全部敏感。PFGE分型结果显示,41株纹带棒状杆菌共分为7个不同基因型,其中以0002型和0006型为优势型,分别占63%(26/41)和22%(9/41)。同一病房同期住院患者分离株高度同源。环境采样结果显示,纹带棒状杆菌分离阳性率达40%(8/20)。
住院患者分离纹带棒状杆菌呈多重耐药特征,不同患者分离株高度同源。特定病房如神经外科、重症监护病房、呼吸内科等科室应重新评估其临床分离意义及与临床治疗之间的相关性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
纹带棒状杆菌属于棒状杆菌属成员之一,为无芽孢革兰阳性杆菌,广泛分布于自然环境中。近年来,纹带棒状杆菌由于其多重耐药特征引起了国内外医务工作者的重视。在现有报道中,纹带棒状杆菌大多分离自住院患者下呼吸道标本[1,2]中,少量分离自血流标本、脑脊液或关节腔积液[1,3,4]。纹带棒状杆菌被认为具有潜在的医院内传播能力,特别对于长期住院患者,并可引起医院内暴发流行[1]。本研究旨在对内蒙古医科大学附属医院不同病房住院患者不同部位分离的45株纹带棒状杆菌进行初步分析,为临床进一步认识并重视该菌种提供实验数据和思路。
收集2013年11月至2014年3月间内蒙古医科大学附属医院住院患者的45株纹带棒状杆菌,21株分离自神经外科病房,8株分离自重症监护病房(ICU), 8株分离自呼吸内科病房,2株分离自神经内科病房,2株分离自普通外科病房,1株分离自泌尿内科病房,1株分离自口腔科病房,1株分离自急诊科,1株分离自冠心病监护病房(CCU),均分离自不同患者。其中,39株分离自下呼吸道标本(37株为下呼吸道吸出物,2株为合格痰液标本),2株分离自脓液标本,2株分离自尿液标本(尿液培养菌落计数>105 CFU/ml),2株分离自脑脊液标本(连续3次送检均为阳性)。
细菌鉴定采用VITEK 2全自动微生物鉴定系统(法国生物梅里埃公司)进行鉴定,鉴定卡为厌氧菌-棒状杆菌鉴定卡(ANC卡);氧化发酵试验用氧化发酵管(O-F管)购自天津金章有限公司(批号:140428);协同溶血试验(CAMP试验)选用ATCC25923金黄色葡萄球菌,血琼脂平板购自天津金章有限公司;脉冲场凝胶电泳系统购自美国Bio-Rad公司;药敏试验板由天津金章有限公司定做,肉汤添加2.5%~5.0%溶解的马血;依据文献[5]选择实验用抗生素,具体名称及批号如下:青霉素(50912514)、庆大霉素(20120801)、红霉素(120604)、万古霉素(20120417)、四环素(120604)、利福平(451107)、环丙沙星(121102)、克林霉素(111124)。
分离的纹带棒状杆菌接种羊血琼脂平板进行传代培养。采用微量肉汤稀释法测定所有菌株的最小抑菌浓度(MIC)。8种抗菌药物按梯度分布在96孔板中,药物浓度设置如下:青霉素、庆大霉素、红霉素、万古霉素、四环素、利福平、环丙沙星均设置8个梯度浓度,最高浓度为64 μg/ml,最低浓度为0.5 μg/ml;克林霉素设置7个梯度浓度,最高浓度为64 μg/ml,最低浓度为0.5 μg/ml;另外设置1个空白生长对照孔,该孔不含任何抗菌药物。药敏平板置35 ℃ 孵箱中培养24~48 h, 观察结果,以抑制细菌生长的最低抗生素浓度确定为MIC值,分别统计MIC50和MIC90。质控菌株为肺炎链球菌ATCC49619。
菌株常规接种羊血琼脂平板(天津金章有限公司),培养24~48 h后用棉棒从培养皿上刮取适量细菌,悬浊于CSB中,用麦式比浊仪测其光密度值,调整至3.5~4.5之间。取250 μl菌悬液于相应的1.5 ml eppendorf管中。加入2 μl溶葡萄球菌素(1 mg/ml),用移液枪充分吹打。
制备10 ml的1% SKG,取250 μl预热(53~56 ℃)的SKG,与250 μl菌悬液混合,立即加入模具,在室温下静置10~15 min。凝固的胶块中加入4 ml蛋白酶K/CLB细胞裂解液混合液中。将管子放在54 ℃水浴摇床中孵育2 h,之后每管中加入15 ml预热的TE液,在54 ℃的水浴摇床中重复洗3次,加入5 ml TE,放在4 ℃冰箱保存备用。标准菌株处理方法相同。
切取胶块,标准菌株胶块及试验菌株胶块分别置于含XbaⅠ内切酶缓冲液及SwaⅠ限制性内切酶缓冲液中,分别在水浴中孵育10~15 min及3~4 h。之后将试验胶块及标准菌株H9812胶块加到梳子齿上,将梳子放入胶槽,缓慢倒入融化的1% Seakem Gold胶中,凝固后开始电泳。
起始转换时间4 s,最终转换时间40 s,电泳时间19 h。电泳完毕,用0.1 μg /ml EB液染色30 min,纯水脱色20 min。用凝胶成像仪成像。每块胶上的DNA片段均用分子质量标准及ATCC33591菌株进行标准化,便于比对。
胶块间图像比较采用BioNumerics ( Version 5) 软件进行处理。采用1.5%的条带差异容许度。聚类分析采用组间非加权的几何平均数 (UPGMA)方法,DNA相关性采用Dice系数进行计算。相似性系数90%以上认为菌株间亲缘关系较近,归为一类。
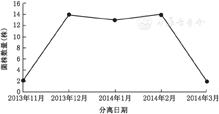
在45例纹带棒状杆菌分离患者中,男28例,女17例,平均年龄57岁(15~87岁),45例患者平均住院时间为9.5 d(6~38 d)。在分离出纹带棒状杆菌的同时或前1周内,这些患者使用或正在使用1种或多种抗菌药物,抗菌药物使用频次最高的为β内酰胺类抗生素,其次为喹诺酮类抗菌药物。2013年11月1日至2014年3月18日间纹带棒状杆菌月份分布呈现明显的聚集特征,见图1。

纹带棒杆菌为革兰阳性棒状杆菌,氧化发酵试验为氧化型100%(45/45);CAMP试验结果不定,本研究中45株菌的CAMP阳性率为98%(44/45); VITEK-2鉴定率为94%,Bionumber为7323120600001,与其他棒状杆菌无重码。
体外药敏试验发现,45株纹带棒状杆菌对青霉素、红霉素、四环素、环丙沙星、克林霉素5种抗菌药物的MIC90值均为64 μg/ml或>64 μg/ml;对庆大霉素、万古霉素和利福平的MIC90值均为0.5 μg/ml。具体结果见表1。
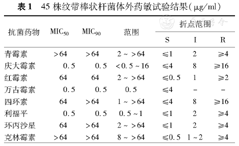
| 抗菌药物 | MIC50 | MIC90 | 范围 | 折点范围 | ||
|---|---|---|---|---|---|---|
| S | I | R | ||||
| 青霉素 | >64 | >64 | 2~>64 | ≤1 | 2 | ≥4 |
| 庆大霉素 | 0.5 | 0.5 | <0.5~16 | ≤4 | 8 | ≥16 |
| 红霉素 | 64 | 64 | 2~>64 | ≤0.5 | 1 | ≥2 |
| 万古霉素 | 0.5 | 0.5 | 0.5 | ≤4 | – | – |
| 四环素 | 64 | >64 | 1~>64 | ≤4 | 8 | ≥16 |
| 利福平 | 0.5 | 0.5 | 0.5~1 | ≤1 | 2 | ≥4 |
| 环丙沙星 | 64 | >64 | 2~>64 | ≤1 | 2 | ≥4 |
| 克林霉素 | >64 | >64 | 8~>64 | ≤0.5 | 1~2 | ≥4 |
注:S:敏感;I:中介;R:耐药; "–"示无判断依据
41株纹带棒状杆菌进行PFGE分型并做聚类分析,主要分离自神经外科病房、呼吸内科和ICU中,共分7个基因型。其中,神经外科病房20株,17株为0002型,1株为0003型,1株为0005型,1株为0006型;17株分别在2013年12月、2014年1月和2月有聚集分布情况,菌株检出时间重叠或先后出现。呼吸内科病房分离的8株菌中,分别有4株和3株归属于0006型和0002型,另外1株归属于0001型。ICU分离的8株菌中,各有3株菌归属于0002型和0006型,其他2株菌分布在其他2个基因型中。另外7株菌分离自其他几个病房,具体结果见图2。
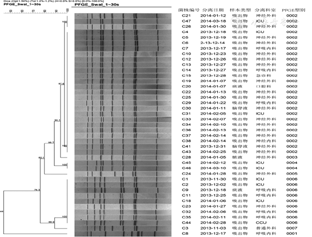

结合体外药敏试验和PFGE分型结果,每种基因型菌株具有一定的耐药谱特征。41株菌共检出7种耐药谱表型,其中以0002型(除外C13和C14)为优势耐药谱型,与0001型、0003型、0004型、0006型(除外C9和C18)和0007型耐药谱相同。0002型中,C13和C14株与优势耐药谱特征(C4)的差异分别为青霉素敏感和庆大霉素耐药。0006型中,C9与C1株的主要区别为青霉素、红霉素、四环素和环丙沙星敏感;C18株与C1株的主要区别是庆大霉素为耐药。具体结果见表2。
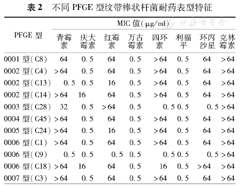
| PFGE型 | MIC值(μg/ml) | |||||||
|---|---|---|---|---|---|---|---|---|
| 青霉素 | 庆大霉素 | 红霉素 | 万古霉素 | 四环素 | 利福平 | 环丙沙星 | 克林霉素 | |
| 0001型(C8) | 64 | 0.5 | 64 | 0.5 | >64 | 0.5 | 64 | >64 |
| 0002型(C4) | >64 | 0.5 | 64 | 0.5 | >64 | 0.5 | 64 | >64 |
| 0002型(C13) | 0.5 | 0.5 | 16 | 0.5 | >64 | 0.5 | 64 | >64 |
| 0002型(C14) | >64 | 16 | 64 | 0.5 | >64 | 0.5 | 64 | >64 |
| 0003型(C28) | 32 | 0.5 | >64 | 0.5 | 0.5 | 0.5 | 0.5 | >64 |
| 0004型(C45) | >64 | 0.5 | 64 | 0.5 | >64 | 0.5 | 64 | >64 |
| 0005型(C24) | >64 | 0.5 | 16 | 0.5 | >64 | 0.5 | 64 | >64 |
| 0006型(C1) | >64 | 0.5 | 64 | 0.5 | >64 | 0.5 | 64 | >64 |
| 0006型(C9) | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | >64 |
| 0006型(C18) | >64 | 16 | 64 | 0.5 | 16 | 0.5 | >64 | >64 |
| 0007型(C3) | >64 | 0.5 | 64 | 0.5 | >64 | 0.5 | 64 | >64 |
20份环境标本检测结果显示,纹带棒状杆菌分离率达40%(8/20)。每份阳性环境标本随机选择2个疑似棒状杆菌菌落进行进一步鉴定及体外药敏试验,结果显示:16株环境标本分离到的纹带棒状杆菌,其中14株(88%)与相应患者分离株耐药表型相同。
纹带棒状杆菌作为棒状杆菌属成员之一,已被国内外一些学者报道具有潜在的医院内传播及感染能力[1,6,7]。但由于棒状杆菌生长缓慢等特征,临床标本中存在的纹带棒状杆菌常被漏检或忽视。但不断有研究报道显示,棒状杆菌特别是纹带棒状杆菌不仅具有很强的医院内传播能力,同时常表现为多重耐药[1,2,8]。在现有的报道中,纹带棒状杆菌多分离自住院患者呼吸道标本、少量可分离自其他无菌部位,如关节腔、脑脊液等部位[3,4]。认识并重视纹带棒状杆菌在医院环境中的生存或传播特征,有助于对其进行更好防控和治疗,降低其耐药性的发展。
本研究结果显示,2013年12月、2014年1月、2014年2月呈现明显的聚集分布趋势,分别为14例、13例和14例患者出现,且集中在神经外科病房、呼吸内科病房和重症监护病房。依据PFGE分型及聚类分析结果,同期或先后在同一病房入住患者存在纹带棒状杆菌交叉传播的可能。在现有的报道中,2种重要的医院内获得病原菌耐甲氧西林金黄色葡萄球菌(MRSA)和多重耐药鲍曼不动杆菌已被证实可通过带菌患者大量释放细菌到周边环境进而引起医院内传播[9,10,11],但对纹带棒状杆菌医院内传播的机制尚不明确。本研究对2例阳性患者周边环境采样发现,环境标本纹带棒状杆菌阳性率达40%(8/20),且分离株体外耐药表型与相应患者临床标本分离株相同。这一结果提示,由于纹带棒状杆菌在环境中的较强存活能力及带菌患者较强的体外排菌能力,医务人员护理活动可能造成纹带棒状杆菌医院内传播。但鉴于本研究采样例数有限,这一结论的确认还需进一步的大样本研究。
体外药敏试验结果显示,90%以上菌株对青霉素、环丙沙星、红霉素、克林霉素的MIC90值≥64 μg/ml。按照美国临床和实验室标准协会(CLSI) M45-P[5]解释标准,纹带棒状杆菌对这些药物均为耐药,与之前的一些报道一致[2,12],提示45株受试菌株多为多重耐药菌株。仅1株菌株对除克林霉素之外的所有药物均敏感。此外,45株菌对万古霉素、庆大霉素和利福平的MIC90值均为0.5 μg/ml,按照CLSI M45-P解释标准,纹带棒状杆菌对这3种抗菌药物均敏感。在研究过程中,有6例患者在下呼吸道标本检出纹带棒状杆菌后使用了万古霉素或利奈唑胺,在用药后1周再次送检同一部位标本中未检出纹带棒状杆菌,且患者感染症状均有明显改善。这6例患者中,3例患者标本为纹带棒状杆菌纯培养物,另外3例患者同时检出金黄色葡萄球菌和鲍曼不动杆菌。因此,尚不能明确纹带棒状感染或定植以及纹带棒状杆菌感染与万古霉素/利奈唑胺治疗之间的明确相关性。
此外,我们对PFGE分型结果与其体外药敏试验结果进行分析后发现,同一基因型菌株表现出相同或相近的耐药谱特征,如0002型和0006型菌株,仅有2株菌与相应基因型优势耐药谱存在单个或多个抗生素MIC值的差异。但不同基因型菌株并未表现出差异显著的耐药谱特征,如0001型(C8)、0002型(C4)、0004型(C45)、0006型(C1)和0007型(C3)的耐药谱特征相同或相近。这一结果可能与多种因素相关。一方面,耐药性特征只是造成不同菌株间遗传背景差异的一个方面,其他原因导致的基因序列变化并不能由耐药性的差异来解释;另一方面,本研究仅选用了8种常见的、且有折点判断标准的抗生素进行了体外药敏试验,其他抗生素耐药性变化导致酶切位点的改变可能未体现出来。因此,纹带棒状杆菌PFGE分型结果与其体外药敏试验结果之间的相关性尚需大样本研究结果来进一步阐明。
总之,本研究结果显示临床分离的纹带棒状杆菌多为多重耐药株,且主要分离自下呼吸道标本。不同病房部分分离株以及同一病房同期住院患者分离株呈现相同或相近的耐药表型和基因型,提示纹带棒状杆菌存在交叉传播的可能。特定病房如神经外科、呼吸内科及ICU等应对纹带棒状杆菌给予重新认识,并分析其检出与临床用药或其他治疗措施实施之间的相关性。



























