
探讨肝细胞癌(HCC)患者术前血清甲胎蛋白表达水平与外科治疗后的预后关系。
回顾性分析779例外科治疗HCC患者的临床资料,采用Kaplan-Meier法进行生存分析,应用Cox比例风险模型进行多因素回归分析。
应用ROC曲线获得中国医学科学院肿瘤医院HCC患者血清甲胎蛋白(AFP)的临界值为18.98 μg/L,此时AFP灵敏度为54.6%,特异度为82.0%。AFP阴性组(AFP<20 μg/L)术后1、3、5年生存率分别为94.4%,77.3%和58.9%;AFP阳性组(AFP≥20 μg/L)术后1、3、5年生存率分别为90.6%,64.5%和49.6%(P=0.005)。Kaplan-Meier单因素分析显示:无临床症状、无腹水、小肝癌(直径≤5 cm)、肿瘤单发、血清AFP低水平表达、血清碱性磷酸酶(ALP)低水平表达、病理分化程度好、病理无脉管瘤栓、无/轻度肝硬化、Child-Pugh A级、无围手术期输血、无腹腔淋巴结转移、无大血管侵犯以及无肿瘤破裂或肝外侵犯是肝癌患者术后较好的预后因素。Cox多因素分析显示:有无临床症状、年龄、肿瘤数目、血清AFP表达水平、血清ALP表达水平、Child-Pugh分级、病理脉管瘤栓、有无腹腔淋巴结转移、有无大血管侵犯、有无肿瘤破裂或肝外侵犯以及术中输血是影响HCC患者长期生存的独立影响因素。分别以阈值1、2、3、5年为界,将总病例分为生存时间大于阈值组及小于阈值组,秩和检验结果表明:血清AFP低表达(18.3~23.9 μg/L)具有较好的预后,血清AFP>59.3 μg/L患者预后较差,AFP的高表达与患者的不良预后相关,并且血清AFP越高表达患者预后越差(P=0.001)。
AFP高表达预示着肿瘤生物学行为较差、肿瘤负荷较大、肝脏背景较差、手术难度和风险及输血比例增加。血清AFP阴性表达患者具有较好的预后,血清AFP表达浓度越高预示患者预后越差。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝细胞癌(HCC)为全球第五大常见恶性肿瘤,每年约有80万新发病例,我国发病人数占全世界肝癌人数的50%以上[1,2]。由于HCC病因具有地域性差异,因此全球各地区HCC预后不尽相同。自从1963年Abelev等[3]首次在肝细胞癌中发现甲胎蛋白(AFP)以来,AFP被公认为是HCC最好的肿瘤标志物,广泛用于HCC的临床诊断及疗效评价。文献报道血清AFP阳性表达常见于以乙型肝炎病毒(HBV)为主要病因的中国肝癌患者[4,5]。由于不同病因、不同人种等多种因素影响,AFP表达水平与HCC预后的关系目前尚无定论。本研究通过对中国医学科学肿瘤医院收治的779例HCC患者的临床和随访资料进行分析,深入探讨血清AFP表达水平与我国肝癌患者预后的关系。
(1)HCC组:选取中国医学科学院肿瘤医院1999年6月至2010年3月行手术治疗的HCC患者共885例,术后均经病理诊断证实为HCC。围手术期死亡13例,失访93例,其余779例患者纳入本研究,其中男673例,中位年龄55岁;女106例,中位年龄57岁。组织学分级Ⅰ~Ⅱ级147例,Ⅱ~Ⅲ级632例。平均肿瘤直径4.0 cm,肿瘤多发或伴有卫星灶者132例,有病理脉管瘤栓者81例。Child-Pugh分级为A级759例,B级20例。按照第7版TNM分期标准,Ⅰ期567例,Ⅱ期113例,Ⅲ~Ⅳ期99例。(2)良性对照组:选取非肿瘤患者共计111例,其中健康对照患者49例,单纯肝炎患者20例,单纯肝硬化患者42例。男74例,女37例,中位年龄49岁。
885例患者中,779例获得随访,随访率88%。随访时间2~144个月,中位随访时间为33个月。
通过计算ROC曲线寻找适合本组HCC患者的AFP血清临界值。以此临界值为界,将HCC患者分为AFP阴性组及AFP阳性组进行数据统计对比。
采用SPSS 13.0软件进行统计分析。计量资料采用 ±s表示,两组间比较采用t检验;计数资料组间比较采用χ2检验。应用K-S法检验样本的分布特征;应用ROC曲线分析确定相关变量的分级临界值。总生存率、无复发生存率的计算采用Kaplan-Meier法。预后影响因素的单因素分析采用Log rank检验,多因素分析采用Cox比例风险模型。均为双侧检验,检验水准α=0.05。P<0.05为差异有统计学意义
±s表示,两组间比较采用t检验;计数资料组间比较采用χ2检验。应用K-S法检验样本的分布特征;应用ROC曲线分析确定相关变量的分级临界值。总生存率、无复发生存率的计算采用Kaplan-Meier法。预后影响因素的单因素分析采用Log rank检验,多因素分析采用Cox比例风险模型。均为双侧检验,检验水准α=0.05。P<0.05为差异有统计学意义
通过统计HCC组与良性对照组中血清AFP表达水平,应用ROC曲线获得我院HCC患者血清AFP的临界值为18.98 μg/L,此时AFP灵敏度为54.6%,特异度为82.0%。
通过计算ROC曲线,我们得到我院HCC患者的AFP血清临界值为18.98 μg/L,因此我们以整数20 μg/L为界,将HCC患者分为AFP阴性组(362例)及AFP阳性组(417例)进行统计对比(表1)。
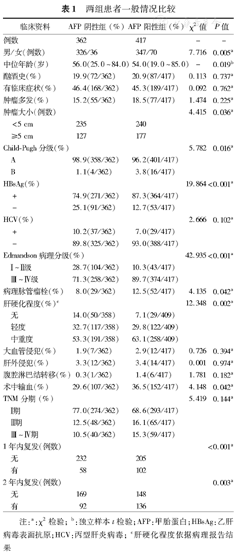
两组患者一般情况比较
两组患者一般情况比较
| 临床资料 | AFP阴性组 (%) | AFP阳性组 (%) | χ2值 | P值 | |
|---|---|---|---|---|---|
| 例数 | 362 | 417 | - | - | |
| 男/女(例数) | 326/36 | 347/70 | 7.716 | 0.005a | |
| 中位年龄(岁) | 56.0(25.0~84.0) | 54.0(19.0~85.0) | - | 0.019b | |
| 酗酒史(%) | 19.9(72/362) | 20.9(87/417) | 0.113 | 0.737a | |
| 有临床症状(%) | 46.4(168/362) | 45.3(189/417) | 0.092 | 0.762a | |
| 肿瘤多发(%) | 15.2(55/362) | 18.5(77/417) | 1.474 | 0.225a | |
| 肿瘤大小(例数) | 4.415 | 0.036a | |||
| <5 cm | 235 | 240 | |||
| ≥5 cm | 127 | 177 | |||
| Child-Pugh分级(%) | 5.782 | 0.016a | |||
| A | 98.9(358/362) | 96.2(401/417) | |||
| B | 1.1(4/362) | 3.8(16/417) | |||
| HBsAg(%) | 19.864 | <0.001a | |||
| + | 74.9(271/362) | 87.3(364/417) | |||
| - | 25.1(91/362) | 12.7(53/417) | |||
| HCV(%) | 2.666 | 0.102a | |||
| + | 10.2(37/362) | 7.0(29/417) | |||
| - | 89.8(325/362) | 93.0(388/417) | |||
| Edmandson病理分级(%) | 42.935 | <0.001a | |||
| Ⅰ~Ⅱ级 | 28.7(104/362) | 10.3(43/417) | |||
| Ⅲ~Ⅳ级 | 71.3(258/362) | 89.7(374/417) | |||
| 病理脉管瘤栓(%) | 8.0(29/362) | 12.5(52/417) | 4.135 | 0.042a | |
| 肝硬化程度(%)c | 12.348 | 0.002a | |||
| 无 | 14.0(50/358) | 7.1(29/409) | |||
| 轻度 | 32.7(117/358) | 29.8(122/409) | |||
| 中重度 | 53.3(191/358) | 63.1(258/409) | |||
| 大血管侵犯(%) | 1.9(7/362) | 2.9(12/417) | 0.726 | 0.394a | |
| 肝外侵犯(%) | 3.3(12/362) | 3.4(14/417) | 0.001 | 0.974a | |
| 腹腔淋巴结转移(%) | 0.3(1/362) | 1.4(6/417) | 1.781 | 0.182a | |
| 术中输血(%) | 29.6(107/362) | 36.5(152/417) | 4.148 | 0.042a | |
| TNM分期 (%) | 5.419 | 0.144a | |||
| Ⅰ期 | 77.0(274/362) | 68.6(293/417) | |||
| Ⅱ期 | 12.5(48/362) | 16.1(65/417) | |||
| Ⅲ~Ⅳ期 | 10.5(40/362) | 15.3(59/417) | |||
| 1年内复发(例数) | <0.001a | ||||
| 无 | 232 | 205 | |||
| 有 | 58 | 102 | |||
| 2年内复发(例数) | 0.003a | ||||
| 无 | 169 | 148 | |||
| 有 | 92 | 136 | |||
注:a:χ2检验;b:独立样本t检验;AFP:甲胎蛋白;HBsAg:乙肝病毒表面抗原;HCV:丙型肝炎病毒;c肝硬化程度依据病理报告结果
在男女比例、中位年龄、Child-Pugh分级、血清乙肝病毒表面抗原(HbsAg)表达、Edmandson病理分级、病理脉管瘤栓、肝硬化程度以及围手术期输血方面,两组资料差异有统计学意义(P<0.05)。
到随访截止,本组779例患者中死亡303例,中位无复发生存时间40个月,中位生存时间70个月。AFP阴性组术后1、3、5年生存率分别为94.4%,77.3%和58.9%;AFP阳性组术后1、3、5年生存率分别为90.6%,64.5%和49.6%(P=0.008)。
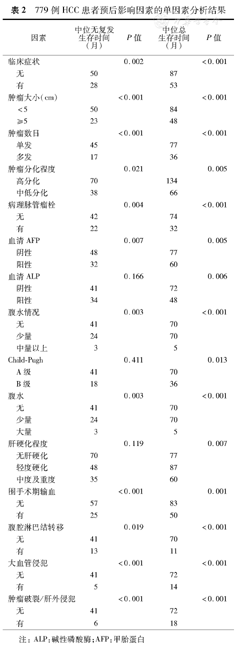
779例HCC患者预后影响因素的单因素分析结果
779例HCC患者预后影响因素的单因素分析结果
| 因素 | 中位无复发生存时间(月) | P值 | 中位总生存时间(月) | P值 | |
|---|---|---|---|---|---|
| 临床症状 | 0.002 | <0.001 | |||
| 无 | 50 | 87 | |||
| 有 | 28 | 53 | |||
| 肿瘤大小(cm) | <0.001 | <0.001 | |||
| <5 | 50 | 84 | |||
| ≥5 | 23 | 48 | |||
| 肿瘤数目 | <0.001 | <0.001 | |||
| 单发 | 45 | 77 | |||
| 多发 | 17 | 36 | |||
| 肿瘤分化程度 | 0.021 | 0.005 | |||
| 高分化 | 70 | 134 | |||
| 中低分化 | 38 | 66 | |||
| 病理脉管瘤栓 | 0.004 | <0.001 | |||
| 无 | 42 | 74 | |||
| 有 | 22 | 32 | |||
| 血清AFP | 0.007 | 0.005 | |||
| 阴性 | 48 | 77 | |||
| 阳性 | 32 | 60 | |||
| 血清ALP | 0.166 | 0.006 | |||
| 阴性 | 41 | 72 | |||
| 阳性 | 34 | 48 | |||
| 腹水情况 | 0.003 | <0.001 | |||
| 无 | 41 | 70 | |||
| 少量 | 24 | 70 | |||
| 中量以上 | 3 | 5 | |||
| Child-Pugh | 0.411 | 0.013 | |||
| A级 | 41 | 70 | |||
| B级 | 18 | 36 | |||
| 腹水 | 0.003 | <0.001 | |||
| 无 | 41 | 70 | |||
| 少量 | 24 | 70 | |||
| 大量 | 3 | 5 | |||
| 肝硬化程度 | 0.119 | 0.007 | |||
| 无肝硬化 | 70 | 77 | |||
| 轻度硬化 | 48 | 87 | |||
| 中度及重度 | 35 | 60 | |||
| 围手术期输血 | <0.001 | 0.001 | |||
| 无 | 57 | 83 | |||
| 有 | 25 | 50 | |||
| 腹腔淋巴结转移 | 0.019 | <0.001 | |||
| 无 | 41 | 70 | |||
| 有 | 13 | 11 | |||
| 大血管侵犯 | <0.001 | <0.001 | |||
| 无 | 41 | 72 | |||
| 有 | 5 | 14 | |||
| 肿瘤破裂/肝外侵犯 | <0.001 | <0.001 | |||
| 无 | 41 | 72 | |||
| 有 | 6 | 18 | |||
注:ALP:碱性磷酸酶;AFP:甲胎蛋白
无临床症状、无腹水、小肝癌(直径≤5 cm)、肿瘤单发、血清AFP低水平表达、血清碱性磷酸酶(ALP)低水平表达、病理分化程度好、病理无脉管瘤栓、无/轻度肝硬化、Child-Pugh A级、无腹腔淋巴结转移、无围手术期输血、无大血管侵犯以及无肿瘤破裂或肝外侵犯是肝癌患者术后较好的预后因素。Cox多因素分析显示(表3):有无临床症状、年龄、肿瘤数目、血清AFP表达水平、血清ALP表达水平、Child-Pugh分级、病理脉管瘤栓、有无腹腔淋巴结转移、有无大血管侵犯、有无肿瘤破裂或肝外侵犯以及术中输血与否是影响HCC患者长期生存的独立影响因素。
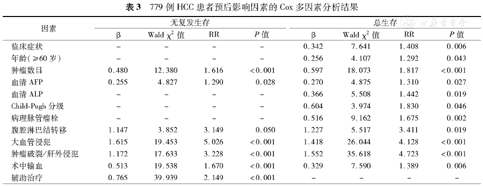
779例HCC患者预后影响因素的Cox多因素分析结果
779例HCC患者预后影响因素的Cox多因素分析结果
| 因素 | 无复发生存 | 总生存 | ||||||
|---|---|---|---|---|---|---|---|---|
| β | Wald χ2值 | RR | P值 | β | Wald χ2值 | RR | P值 | |
| 临床症状 | - | - | - | - | 0.342 | 7.641 | 1.408 | 0.006 |
| 年龄(≥60岁) | - | - | - | - | 0.256 | 4.107 | 1.292 | 0.043 |
| 肿瘤数目 | 0.480 | 12.380 | 1.616 | <0.001 | 0.597 | 18.073 | 1.817 | <0.001 |
| 血清AFP | 0.255 | 4.827 | 1.290 | 0.028 | 0.270 | 4.875 | 1.310 | 0.027 |
| 血清ALP | - | - | - | - | 0.366 | 5.508 | 1.442 | 0.019 |
| Child-Pugh分级 | - | - | - | - | 0.604 | 3.974 | 1.830 | 0.046 |
| 病理脉管瘤栓 | - | - | - | - | 0.516 | 9.162 | 1.675 | 0.002 |
| 腹腔淋巴结转移 | 1.147 | 3.852 | 3.149 | 0.050 | 1.227 | 5.517 | 3.411 | 0.019 |
| 大血管侵犯 | 1.615 | 19.453 | 5.026 | <0.001 | 1.418 | 26.044 | 4.128 | <0.001 |
| 肿瘤破裂/肝外侵犯 | 1.172 | 17.633 | 3.228 | <0.001 | 1.552 | 35.618 | 4.723 | <0.001 |
| 术中输血 | 0.513 | 19.538 | 1.670 | <0.001 | 0.329 | 7.590 | 1.389 | 0.006 |
| 辅助治疗 | 0.765 | 39.939 | 2.149 | <0.001 | - | - | - | - |
分别以阈值1、2、3、5年为界,将总病例分为生存时间大于阈值组及小于阈值组(表4),秩和检验结果表明:血清AFP低表达(18.3~23.9 μg/L)具有较好的预后,血清AFP>59.3 μg/L患者预后较差,AFP高表达与患者的不良预后相关。
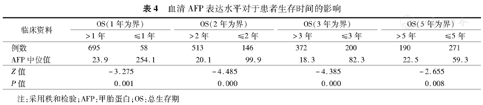
血清AFP表达水平对于患者生存时间的影响
血清AFP表达水平对于患者生存时间的影响
| 临床资料 | OS(1年为界) | OS(2年为界) | OS(3年为界) | OS(5年为界) | ||||
|---|---|---|---|---|---|---|---|---|
| >1年 | ≤1年 | >2年 | ≤2年 | >3年 | ≤3年 | >5年 | ≤5年 | |
| 例数 | 695 | 58 | 513 | 146 | 372 | 200 | 190 | 271 |
| AFP中位值 | 23.9 | 254.1 | 20.1 | 99.9 | 18.3 | 82.3 | 22.5 | 59.3 |
| Z值 | -3.275 | -4.485 | -4.385 | -2.655 | ||||
| P值 | 0.001 | 0.000 | 0.000 | 0.008 | ||||
注:采用秩和检验;AFP:甲胎蛋白;OS:总生存期
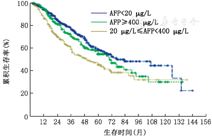
根据以上结果,将血清AFP表达水平分为以下3组:<20 μg/L组(AFP阴性表达)、20~400 μg/L组以及>400 μg/L组,用于研究血清AFP表达水平与预后关系。Kaplan-Meier单因素分析显示,血清AFP越高表达患者预后越差(P=0.001,图1)。

AFP被公认为是肝细胞癌目前最好的肿瘤标志物,在70%~80%的HCC患者中阳性表达[6]。我院资料结果显示:AFP阳性患者肿瘤较大(P=0.036),且具有较高的病理脉管瘤栓和低分化比例(P<0.05),提示AFP阳性患者具有较大的肿瘤负荷及较差的生物学行为。另外,本研究显示AFP阳性患者中重度肝硬化比例及Child-Pugh B级比例较高,提示AFP阳性组具有较差的肝脏背景[7]。关于AFP与血清病毒指标的关系目前尚无定论,有研究报道AFP与血清病毒表达无关[8,9],亦有报道证实AFP阴性肝癌患者同时伴有乙型肝炎病毒感染的比例显著低于AFP阳性患者[5,10]。本研究支持后者观点,结果显示AFP阳性组血清HBsAg阳性患者明显高于对照组(P<0.001),从而证实AFP阳性表达常见于以乙型肝炎为主要病因的肝癌患者[4,5]。这可能是由于,HBV病毒感染细胞中的乙型肝炎病毒X蛋白( HBx)与抑癌基因p53结合,降低了p53对AFP表达的抑制,从而导致AFP过度表达[11]。
AFP与HCC预后的关系目前尚无定论[12],可能与全球HCC发病的病因及人种等多种复杂因素影响相关。目前认为血清AFP阳性表达常见于以乙型肝炎为主要病因的中国肝癌患者[4,5],而我国发病人数占全世界肝癌人数的50%以上[1]。因此,研究AFP表达水平与乙型肝炎病因为主的肝癌预后之间的关系具有重要临床意义。
我院资料Kaplan-Meier单因素分析结果显示:AFP阴性组术后1、3、5年生存率分别为94.4%,77.3%和58.9%;AFP阳性组术后1、3、5年生存率分别为90.6%,64.5%和49.6%,提示AFP阴性组预后明显好于AFP阳性组(P=0.005);AFP阳性患者短期复发(1年内)的比例明显高于AFP阴性患者(P<0.001)。Cox多因素分析结果显示血清AFP表达水平是影响HCC预后的独立因素(P=0.027)。另外,我们发现血清AFP水平越高患者预后越差(P=0.001)。
结合文献复习及本研究结果,血清AFP高表达导致不良预后的原因可能有以下几点:第一,基础研究表明,AFP高表达将增加脉管瘤栓及肿瘤远处转移的风险[13]。我们的结果证实AFP阳性患者病理脉管瘤栓比例和肿瘤低分化比例(P<0.05)较AFP阴性患者明显增高,提示AFP阳性患者具有较差的生物学行为。第二,本研究结果表明:相比于AFP阴性患者,AFP阳性患者肿瘤相对较大(P=0.036),且患者术中输血比例也明显增高(P=0.042),较大的肿瘤使手术难度及风险增加,因此导致输血比例提高。而围手术期输血由于降低机体免疫机能可导致不良预后的理念已被广泛认可。第三,我们发现AFP阳性组内中重度肝硬化及Child-Pugh B级患者比例明显高于AFP阴性患者,提示AFP阳性患者具有较差的肝脏背景。而肝硬化程度是HCC预后的重要影响因素,肝硬化越重患者预后越差。同时,较差的肝脏背景同样意味着手术难度及风险增高、出血量增加。第四,基础实验证实AFP本身在促进肿瘤生长中起重要作用。有研究发现AFP可促进胚胎细胞及人类肿瘤细胞生长[14],当应用AFP抗体作用于甲胎蛋白后,肿瘤细胞生长受到抑制[15]。另有资料显示AFP不仅抑制肿瘤细胞凋亡,还可通过细胞调控机制促进肿瘤增殖及转移[6]。
总之,AFP高表达预示着肿瘤生物学行为较差、肿瘤负荷较大、肝脏背景较差、手术难度和风险及输血比例增加。血清AFP阴性表达患者具有较好的预后,血清AFP表达浓度越高预示患者预后越差。



























