
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
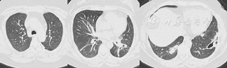
患者女,39岁,因右耳流脓2个月,发热、脓痰、皮下脓肿1个月于2013年5月入北京协和医院。2个月前右耳流脓、耳后胀痛、听力下降。1个月前发热,最高体温40 ℃,伴咳嗽,黄脓痰,偶痰中带血;出现皮下多发脓肿,累双侧乳房、右颌下、右腋下、右上臂、左腹壁等部位,破溃后流出红黄色脓液,恶臭。就诊于当地医院,检查示血常规:白细胞15.8×109/L,中性粒细胞80.9%,血红蛋白109 g/L,血小板537×109/L;红细胞沉降率(ESR) 75 mm/1 h;C反应蛋白(CRP)341 mg/L;胸部CT示双肺多发脓肿;头颅CT:双侧上颌窦、筛窦炎;结核抗体、脓液及痰培养阴性;右乳脓肿活检:乳腺脓肿伴肉芽肿形成;予哌拉西林/他唑巴坦等抗感染疗效不佳,为进一步诊治入北京协和医院。病来精神、饮食、睡眠差,体重下降10 kg。既往体健,曾饲养家禽。月经婚育、家族史无殊。体格检查:体温40 ℃,心率128次/min,血压130/80 mmHg(1 mmHg =0.133 kPa),血氧饱和度自然状态下92%,多发皮下脓肿破溃(图1),脓液流出,鼻梁背侧压痛明显,双肺呼吸音粗,心、腹部无特殊,双下肢无凹陷性水肿。实验室检查:血常规:白细胞11.73×109/L,血红蛋白96 g/L,血小板453×109/L;肝肾功:丙氨酸转氨酶462 U/L,白蛋白21 g/L,乳酸脱氢酶275 U/L;尿红细胞47.7/μl,尿红细胞畸形率90%,24 h尿蛋白1.0 g;降钙素元1.60 pg/L;G试验0.156 1 pg/L;皮损处脓液、鼻窦组织、痰、耳、鼻拭子培养,痰涂片及染色可见肺炎克雷伯杆菌、鲍曼不动杆菌、凝固酶阴性葡萄球菌、溶血孪生球菌及白念珠菌等多种细菌、真菌;结核抗体、血隐球菌抗原、GM试验、病毒血清学检查及血培养阴性。ESR 115 mm/1 h,超敏CRP 266.08 mg/L;抗中性粒细胞胞质抗体(ANCA):胞质型1∶20;蛋白酶3(PR3)-ANCA >0.2 RU/L;抗核抗体、抗可提取抗原抗体:阴性。胸部高分辨率CT(图2):右肺上叶结节、双肺多发团块软组织密度影,双肺门及纵隔多发淋巴结;鼻窦CT:鼻窦内广泛软组织影伴骨质破坏;颞骨薄层CT:双侧鼓室内弥漫密度增高影,右侧乳突骨质破坏,后颅窝面骨板不连续;内听道增强MRI:坏死性炎性病变可能。PET/CT:头面部多处代谢不均匀增高,双肺多发代谢异常增高的空洞及结节,皮下多发代谢增高灶,炎性病变可能性大,符合韦格纳肉芽肿。乳腺、皮肤及鼻中隔肿物活体组织检查均提示炎性肉芽肿,局部伴坏死脓肿形成及淋巴细胞浸润,可见局灶血管壁纤维增生。
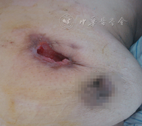



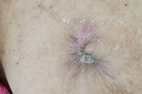
诊断肉芽肿性多血管炎(GPA),继发皮肤感染。予甲泼尼龙48 mg/d口服及复方环磷酰胺(CTX) 100 mg/d口服,后改为CTX隔日0.2 g静脉滴注治疗原发病,予哌拉西林/他唑巴坦+复方甲氧苄啶抗感染,皮下脓肿破溃处定期以抗生素软膏、外用重组牛碱性成纤维细胞生长因子(融合蛋白)及红汞纱条换药。经上述治疗,仍有发热,将抗生素调整为万古霉素、头孢他啶、氟康唑、磺胺,加用人丙种球蛋白10 g/d静脉滴注,共5 d,体温仍无好转,最高体温39.4 ℃,头痛加重,出现右侧额纹消失,鼻唇沟变浅,口角左偏,伸舌左偏,悬雍垂左偏,头颅MRI提示双侧硬脑膜增厚并明显强化(图3),多发颅神经受累(Ⅶ、Ⅷ、Ⅸ、Ⅹ),行腰穿及脑脊液检查未见异常,诊断肉芽肿性多血管炎(GPA)、肥厚性硬脑膜炎(HCP)、颅神经受累,予甲泼尼龙1 g/d静脉滴注冲击治疗3 d,后序贯为40 mg/d静脉滴注;加强CTX使用,改为每周1 g,分3~4次静脉滴注,同时加用来氟米特20 mg/d口服;每周鞘内注射地塞米松10 mg,共3次,头痛明显缓解,体温降至正常。复查胸部高分辨CT见肺内空洞、占位较前缩小,停用抗生素。经治疗,体温正常,皮损大部分愈合,尿蛋白降至正常,肺部病变较前好转,ESR降至44 mm/1 h,超敏CRP降至9.59 mg/L,PR3-ANCA降至0.094 RU/L,静脉激素改为泼尼松50 mg/d口服,静脉CTX改为复方CTX 150 mg/d口服出院。出院后随诊至今,泼尼松逐渐减量,目前已减至泼尼松10 mg/d口服,半年后复查胸部CT(图4),多数结节、占位病变吸收或缩小,皮肤溃疡愈合(图5)。


GPA是一种少见的、原因不明的系统性血管炎。组织学特点为中小血管的坏死性血管炎及肉芽肿性炎症,临床典型表现为上、下呼吸道和肾脏三联征:以上呼吸道表现最常见,多为鼻窦炎、浆液性中耳炎等,可有骨质受累及感觉神经性耳聋;肺部受累常表现为咳嗽、咳痰、咳血,肺部影像学可见肺部多发浸润及结节影;全身型GPA可有肾脏受累,最常表现为急进性肾小球肾炎。患者上呼吸道表现为化脓性中耳炎、鼻窦炎,影像学有骨室、鼻窦多发软组织密度影伴骨质破坏;肺部表现为多发团块、空洞,抗生素疗效差;肾脏方面出现蛋白尿、血尿,24 h尿蛋白1.0 g,具备典型的三联征。加之患者发热等全身非特异性炎症表现突出,实验室检查提示ESR、超敏CRP明显升高,同时特异性抗体[1]––PR3-ANCA高滴度阳性,PET/CT提示肉芽肿性多血管炎表现,病理学支持坏死性血管炎和炎性肉芽肿特点。因此,患者GPA诊断明确。
GPA 40%~50%有皮肤表现,可为溃疡、可触性紫癜、皮下结节等,但很少为主要临床表现。该患病程中皮肤表现突出,病初即出现多发皮下脓肿,破溃后不易愈合,创面逐渐增大变深,皮肤病理提示肉芽肿形成伴坏死及炎细胞浸润,支持原发病所致,但之后又合并多重病原感染。病房在加强原发病治疗的基础上,给予积极的抗感染治疗,并定期予伤口换药,皮损逐渐愈合。可见除典型三联征外,GPA患者可以皮损为主要表现,且皮损多与病变活动性平行[2];在皮损的处理方面,虽糖皮质激素的使用有使伤口愈合不佳的嫌疑,但由血管炎导致的皮肤破溃的好转,必须以积极激素、免疫抑制剂治疗将原发病充分控制稳定为基础。如合并感染,可给予全身或局部抗生素治疗。另外,与外科、护理合作,严格、定期的精心换药,也是皮损愈合的重要保障。
本例起病急,临床表现复杂,发热、肺部脓肿、皮肤脓肿容易误诊为感染。
诊断后原发病积极治疗过程中,发热、皮肤脓肿控制欠佳,且新发神经系统受累少见。
皮肤、耳鼻喉、肾脏、肺脏、神经系统等多系统受累,全身发热等炎症表现突出,抗核抗体阴性,抗感染治疗无效,需考虑系统性血管炎尤其是ANCA相关性血管炎可能,及时有效的ANCA检查对诊断意义重大。
肥厚性硬脑膜炎在GPA中发生率不高,多见于反复中耳炎、鼻窦炎控制部件的患者,多提示病情活动,值得积极治疗,在全身用药基础上联合鞘内注射疗效显著。
对血管炎导致的皮肤深大破溃,如合并感染,既要积极抗感染,也要坚持激素和免疫抑制剂治疗原发病,同时规范换药,促进伤口愈合。
难治型GPA需要大剂量激素冲击,两种或两种以上免疫抑制剂联合治疗。
该患另一特点为合并HCP和颅神经受累。HCP为一种以硬脑膜弥漫性增厚为特点的慢性纤维素性炎症,主要表现为头痛、共济失调及多发颅神经麻痹,头颅核磁可见硬脑膜多部位条带状或斑块状增厚,增强后可明显强化,常以硬脑膜侧的蛛网膜强化最明显[3]。GPA患者出现HCP的原因有:(1)头面部位(如中耳、鼻窦等)迁延不愈的肉芽肿炎性病变侵犯脑膜及脑神经,(2)肉芽肿或血管炎性病变原发于中枢神经系统。GPA相关的HCP可出现于病程各阶段,甚至可以HCP为首发表现就诊于神经内科[4]。GPA导致的HCP脑脊液检查可有压力增高,白细胞数目正常或稍高,以单个核细胞为主,蛋白含量正常或升高,糖及氯化物正常,脑脊液中ANCA可为阳性;硬脑膜活体组织病理学检查可见肉芽肿性炎症和组织坏死[5]。治疗以大剂量糖皮质激素和CTX(2 mg/kg口服)为主,甚至需冲击治疗(甲泼尼龙1 g/d冲击3~5 d,在监测白细胞无显著降低的前提下CTX 15 mg/kg[6],冲击每1~2周1次以尽快累积至有效剂量),对难治型患者可考虑利妥昔单抗治疗[7],早期、及时的治疗可减少神经损害后遗症发生。针对该患,因有肺、肾、中枢神经系统等多个重要脏器受累,皮肤病变严重,全身炎症突出,持续高热,在充分抗感染后使用了甲泼尼龙冲击、CTX及来氟米特联合免疫抑制及人免疫球蛋白等治疗,同时针对HCP行鞘内注射地塞米松治疗。治疗后患者症状缓解,炎症指标及ANCA滴度下降明显,好转出院。
通过该例分析总结,可获得以下经验:(1)长期发热、抗生素无效患者,出现皮肤、肺部等多发脓肿时,除特殊感染外还应考虑血管炎可能,及时筛查ANCA有助于早期诊断、治疗;(2)GPA并不全以典型三联征亮相,严重皮肤病变或HCP可成为主角,需引起临床医师重视;(3)对难治型GPA,临床医师应不拘泥于常规治疗,必要时可予糖皮质激素冲击、大剂量CTX或联用多种免疫抑制剂、利妥昔单抗等加强治疗,以尽快控制疾病进展;(4)对血管炎导致的皮肤深大破溃,易合并感染,原发病和抗感染治疗需双管齐下,同时需规范的局部换药;(5)GPA出现HCP多提示病情活动,可在全身用药基础上行鞘内注射地塞米松治疗,协助改善神经系统症状,减少永久性神经损害。


























