
总结经病理证实的58例颅内肿瘤样脱髓鞘病(TDL)发病不同时期的临床、影像及病理特点以减少误诊率。
收集2005—2013年在海军总医院就诊,并经病理证实的58例TDL的临床、影像及病理资料进行回顾性分析,病理切片采用苏木精伊红染色(HE)、髓鞘染色[神经髓鞘固蓝染色法(LFB)、过碘酸-雪夫染色(PAS)或髓磷脂碱性蛋白(MBP)的免疫组织化学染色]和吞噬细胞特异抗体染色(KiM1P或CD68免疫组织化学染色)以及轴索染色[神经微丝蛋白(NF)免疫组化染色],综合对TDL病灶组织进行病理观察。
58例病例中男31例,女27例,发病年龄6~56(36±13)岁。急性期21例(36%),亚急性期27例(46.5%),慢性期10例(17.5%)。2例患者为2次活检证实(3.4%)。急性期病理特点为大量神经髓鞘脱失而轴索相对保留,炎细胞(以吞噬细胞为主)大量浸润,反应性星形胶质细胞增多;慢性活动期病灶病理特点为相对的轴索保留,病灶与周围组织界限清楚。吞噬了髓鞘的吞噬细胞主要集中在病灶边缘,其细胞数较急性期减少,且处于非活动期,纤维型星形胶质细胞增多。
TDL为特殊类型的脱髓鞘病,虽影像上貌似肿瘤,但其病灶多为双侧且彼此孤立,急性期与慢性期病理特点改变有差异。其病理演变特点对TDL早期诊断与鉴别诊断的临床价值显著,有助于与脑肿瘤或中枢神经系统血管炎相鉴别。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肿瘤样脱髓鞘病(TDL)是一种特殊类型的中枢神经系统炎性脱髓鞘疾病,因其影像学具有占位效应,临床表现又常以头痛起病,故与脑肿瘤性疾病容易混淆,又称为脱髓鞘假瘤(DPT)或瘤样炎性脱髓鞘病(TIDD)[1,2]。尽管随着影像学发展,许多诸如"开环样"强化等诊断TDL特异性相对较高的影像学特点被发现[3],但仍有部分TDL受不同临床分期等因素的影响,影像学缺乏典型特征,临床诊断困难,因此,脑活检病理学手段仍然是不可替代的。当然,病理学诊断有时也较困难,如除因脑肿瘤早期或取材位于病灶边缘等所致的病理不典型因素外,最易被忽视的就是,不同分期的TDL,其病理学表现各异,而不能简单地将TDL的病理学特征归结为"血管周围淋巴套袖、大量髓鞘脱失而轴索相对保留",目前,国内尚罕见对TDL不同分期的病理特点进行系统性研究。本研究拟对海军总医院收治并活检的58例颅内TDL的病理学资料进行总结,结合临床与影像学,探讨不同分期的TDL病理学特点,以促进对TDL的病理学特点的掌握,并与其他相关疾病进行鉴别。
收集2005—2013年在海军总医院就诊,并经病理证实的58例TDL患者临床症候、影像及病理学资料,其中47例行脑立体定向活检术(其中2例行2次活检术),11例开颅活检,含院外手术的患者。
对所有TDL的发病年龄、起病形式、临床症候、影像学及病理学特点等进行回顾性研究。影像采用CT、MRI平扫增强及FLAIR扫描,病理切片采用苏木精伊红染色(HE)、髓鞘染色[神经髓鞘固蓝染色法(LFB)、过碘酸-雪夫染色(PAS)或髓磷脂碱性蛋白(MBP)的免疫组织化学染色]和吞噬细胞特异抗体染色(KiM1P或CD68免疫组织化学染色)以及轴索染色[Bielschowski银染或神经微丝蛋白(NF)免疫组化染色]。
采用SPSS 16.0软件包对数据进行统计学分析,对所有计量资料应用Kollomogorov-Smirnoff单样本检验进行正态性检验,所有计量资料均符合正态分布,其集中趋势采用 ±s表示。
±s表示。
TDL 58例,男31例,女27例,发病年龄6~56(36±13)岁。急性期21例(36%),亚急性期27例(46.5%),慢性期10例(17.5%)。2例患者为2次活检证实(3.4%)。58例TDL中,绝大多数为单时相病程,仅2例发病2次,可见复发-缓解现象。
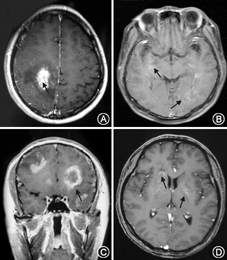
单纯脑干受累的TDL 2例,大脑半球受累56例。病变单侧受累24例(41.3%),双侧受累34例(58.7%);单发病灶22例(37.9%),多发病灶36例(62.1%)。TDL急性期以斑片样或结节样强化为主(图1A),[在超急性期或急性早期(≤7~10 d)增强扫描仅见线状或小片状强化(图1B)];亚急性期以周边强化明显为特点,呈现出环形或"C"形强化(图1C),但有时因其处于炎症反应的不同阶段或病灶大小的不同,其影像学表现不尽相同,也可呈现出急性期的斑片样或结节样强化;慢性期病灶呈轻度线性、小片状环形浅淡强化(图1D),部分病灶强化消退。

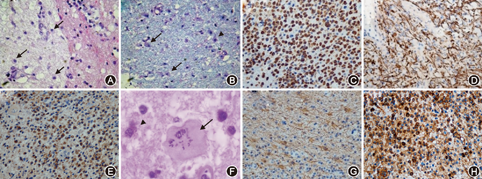
采用HE、髓鞘染色( LFB、PAS或抗MBP)和吞噬细胞特异抗体染色(KiM1P或CD68免疫组织化学染色)以及轴索染色(NF免疫组化染色)综合对TDL病灶组织进行病理观察[4]。58例患者均进行了HE、CD68、GFAP(glial fibrillary acidic protein)、NF染色,LFB染色的48例(82.7%),抗MBP染色的20例(34.5%),KiM1P染色5例(8.6%)。病理表现急性期18例(31%),慢性活动期20例(34.5%),慢性亚急性活动期10例(17.25%),慢性非活动期10例(17.25%)。
急性期可见大量的吞噬细胞及炎细胞浸润,主要以淋巴细胞(CD3、CD4、CD8)为主,并多见淋巴细胞套袖形成,仅见散在少量浆细胞,可见肥胖型星形胶质细胞(图2)。

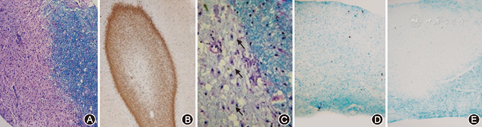
慢性期病灶与周围组织界限清楚,吞噬了髓鞘的吞噬细胞主要集中在病灶边缘,其细胞数较急性期减少,且处于非活动期,纤维型星形胶质细胞增多,可见浆细胞(CD79a、CD38、CD138)浸润,髓鞘再生逐渐形成(图3)。

本院收集了8年来临床中病理确诊的58例TDL患者资料进行回顾性分析发现,TDL具有占位性效应,其疾病不同时期影像学表现不同。还有些病灶MRI表现为胶质瘤样的蝴蝶型病灶横跨胼胝体[5],极易与肿瘤特别是胶质瘤和PCNSL相混淆[6],也与中枢神经系统血管炎极其相似[7],因此病理学检查作为"金标准"显得尤为重要。临床中也可见因病灶取材部位靠边缘或经糖皮质激素、γ刀治疗后的肿瘤病理切片中极难观察到异形细胞,仅表现为无特异性的炎性细胞浸润,甚至存在少量髓鞘脱失,使得病理鉴别难度增大,这就需要结合临床、影像进行全面分析,以达到鉴别诊断的目的。
结合本组病理,急性期病理特点为:(1)大量髓鞘脱失而轴索相对保留。(2)镜下满视野可见泡沫样吞噬细胞(经典的吞噬细胞反应)。(3)少突胶质细胞不同程度缺失,少突胶质细胞通常在髓鞘再生过程中出现。(4)血管周围和脑实质以淋巴细胞(CD3、CD4、CD8)为主的浸润,也有少量B细胞浸润,并多见淋巴细胞套袖形成,仅见少量浆细胞浸润。(5)另有一个关键特征是反应性星形胶质细胞显著增多,可见到双核或多核肥胖型星形胶质细胞、处于有丝分裂状态的星形胶质细胞和Creutzfeldt-Peters细胞(含有破碎核包涵体的星形胶质细胞)[8],这种特征是诊断脱髓鞘病的佐证之一。急性期病灶尽管轴索保留,但镜下可见轴索肿胀及β-淀粉样前体蛋白聚集,说明轴索存在损伤,故只能说明轴索相对保留,而非保留。轴索相对保留并伴有髓鞘脱失是诊断脱髓鞘病的必要点。如果轴索也出现同等程度的缺失,那么更应该考虑病灶坏死,对于中枢神经系统血管炎的提示意义更大[9]。
慢性活动期病灶病理特点为:(1)轴索相对保留,病灶与周围组织界限清楚。(2)吞噬了髓鞘的吞噬细胞主要集中在病灶边缘,其细胞数较急性期减少,且处于相对的非活动期。(3)纤维型星形胶质细胞开始出现。(4)可见浆细胞(CD79a、CD38、CD138)浸润。
慢性亚急性活动期病灶特征性病理表现:病灶中间为非活动期的细胞中心,周围包绕着少量激活的胞内含有髓鞘降解碎片的吞噬细胞,以及小胶质细胞。
慢性非活动期特征性病理表现:病灶中间完全是髓鞘脱失的细胞减少的中心,可见显著的轴索损害;少突胶质细胞及星形胶质细胞增多;吞噬细胞、小胶质细胞和淋巴细胞的少量浸润。镜下所见影斑区(Shadow plaques)是髓鞘再生区域。
临床中将疾病分期分为急性期、亚急性期和慢性期(急性期为发病2~3周内,亚急性期为发病3周至1.5个月,慢性期为1.5个月以后),病理分期通常分急性期、慢性活动期、慢性亚急性活动期和慢性非活动期。临床分期和病理分期不尽相同,是因为从微观髓鞘脱失到宏观临床症状显现之间时间差难以评估。本研究观察到的TDL特征性病理特点概括起来是髓鞘脱失而轴索相对保留,急性期以肥胖型星形胶质细胞为主,慢性期亚急性和非活动期以纤维型星形胶质细胞逐渐增多为表现。
TDL病灶宏观观察可为质地较软的灰色病变,亦可是质地较硬的白色病变,这取决于病灶中炎性细胞和星形胶质细胞种类的相对比例,而与病灶部位无关。典型的炎性细胞浸润成分由淋巴细胞、成熟浆细胞和吞噬细胞组成。淋巴细胞通常包含Russell小体,表现出类浆细胞特征。在一些病例病理染色中可见生发中心显著增多,不同程度地胶质细胞增生,以及与肉芽肿不相关的多核巨细胞。TDL主要病理特点是灰白质均可受累的髓鞘脱失及血管周围的炎性浸润。急性期髓鞘脱失区域其病灶边界不清,质软(病灶周围有水肿带),呈白色或粉黄色;而慢性期病灶边界清楚,质硬(轻度萎缩),呈灰褐色[10]。
由于TDL急性期和慢性期其病理特点不同,典型的TDL病理诊断标准还存在很大的争议,只有结合病史、神经系统查体、脑脊液检查、神经系统影像学及神经生理检查等手段全面分析,才能提高确诊率。病理始终是诊断疾病的"金标准",通过病理观察与以下疾病相鉴别:(1)与胶质瘤相鉴别:TDL慢性期非活动期往往易与胶质瘤等相混淆。TDL病理可见显著的轴索损害;少突胶质细胞及星形胶质细胞增多;吞噬细胞、小胶质细胞和淋巴细胞少量浸润。胶质瘤病灶也可见胶质细胞增生,病灶边缘有时也会出现少量髓鞘脱失现象,极少见到炎性细胞,但胶质瘤病理通常能够找到异形细胞与TDL相鉴别。(2)与PCNSL相鉴别:PCNSL病理特点是特异性的,肿瘤细胞弥漫性密集排列、呈片状分布,无明显边界,肿瘤细胞在血管周围间隙聚集形成"套袖状"结构,绝大多数B细胞标记阳性[11],这与TDL不难鉴别。但部分PCNSL影像学表现因与TDL极其相似,临床未经病理证实即进行糖皮质激素试验性治疗。在取得短暂疗效后停用激素,病情反复,此时进行活检,病理切片中通常见不到肿瘤细胞,可观察到大量吞噬细胞,炎性细胞浸润也以T淋巴细胞为主伴少量的B细胞浸润,其镜下表现与TDL极其相似,很容易造成误诊。往往在停用激素治疗后新病灶出现,再次活检取证病理才观察到典型的PCNSL肿瘤细胞。(3)与中枢神经系统血管炎相鉴别:中枢神经系统血管炎病理特点是血管壁及血管周围以淋巴细胞为主的炎症反应,血管壁可见到局部纤维素样坏死,部分管腔狭窄、甚至闭塞,在未看到血管壁浸润破坏时往往容易与TDL急性期病理相混淆。即便是病理科资深专家有时对TDL及中枢神经系统血管炎的鉴别也有一定困难。本院神经内科就收治过几例病理诊断存在争议的患者。其中一例患者因颅内占位性病变就诊,影像学表现为病灶有不均匀强化,与脑胶质瘤极其相似,行病理活检提示:镜下组织高度水肿,皮质及白质内大量胶质细胞增生,血管周围淋巴细胞套袖状浸润,部分区域白质疏松软化呈海绵状结构,并伴大量吞噬细胞分布,病变以白质为主。免疫组织化学染色见GFAP(+),Olig-2(+),Vimentin(+),S-100(+),NF(+),抗MBP(+),CD68(+),LCA(+),PAS(部分组织+)。两位资深病理学专家对该病理表现产生争议,一位认为是TDL而另一位认为是中枢神经系统血管炎。之后通过再次取材病理染色,观察到血管壁的淋巴细胞浸润,血管壁基底膜破坏出血,从而明确诊断为中枢神经系统血管炎。另一例同样因颅内占位就诊的患者病理活检提示:脑组织胶质细胞增生,大量组织细胞反应,脑组织内可见淋巴细胞散在浸润,血管周可见淋巴细胞套装浸润,并可见浆细胞及少许中性粒细胞浸润,免疫组织化学染色见:GFAP(++),Olig-2(++),S-100(+),NF(+),CD68(+),CD20(++),CD3(++),CD138(++),LCA(+++),CD34(+),其同样如上存在TDL与中枢神经系统血管炎诊断的争议,后补充对病灶进行髓鞘染色可见吞噬细胞内的髓鞘碎片,两位专家一致确诊为TDL。通过上述病例分析表明临床上需要对影像学及病理学进行综合判断,全面考虑才能避免漏诊误诊发生。
总之,TDL在临床、影像及病理学方面与脑肿瘤或中枢神经系统血管炎等有些许相似,临床中需注意临床分期与影像学的关系,需要明确发病时间,以便临床影像与病理相吻合,提高确诊率;病理学方面TDL急性期或早期脱髓鞘病常见大量的吞噬细胞,其是造成髓鞘脱失的责任细胞,但同时炎细胞浸润,特别是CD4+及CD8+ T淋巴细胞的浸润,也是引起急性病变的关键细胞。急性期炎细胞浸润主要以淋巴细胞(CD3、CD4、CD8)为主,并多见淋巴细胞套袖形成,仅见少量浆细胞浸润。浆细胞(CD79a、CD38、CD138)更多见于慢性期病变时。随着病灶炎性反应的演变,水肿带逐渐消失,炎性浸润程度减轻,肥胖型星形胶质细胞逐渐演变为纤维型星形胶质细胞,髓鞘再生区域增大,病灶逐渐出现修复状态。虽然TDL与颅内肿瘤及中枢神经系统血管炎有难以鉴别之处,但综合TDL影像学及病理学特点,能够明确诊断。



























