
探讨甲状腺乳头状癌(PTC)临床病理学特征与淋巴结转移的相关性。
收集首都医科大学附属北京同仁医院病理科2006年1月1日至2013年12月31日153例PTC患者的手术切除标本;在HE染色下观察PTC临床病理特点、生长模式(浸润性肿瘤边界、侧支、叶内播散及腺外浸润)及特殊组织形态学特点[鞋钉特点、缺乏黏附性/极性(LOCP)及微乳头结构],分析其与淋巴结转移的关系。
在153例PTC中,浸润性肿瘤边界128例、侧支34例、叶内播散30例、腺外浸润53例;有鞋钉特点37例、LOCP 59例、有微乳头结构70例。单变量分析,发现年龄<45岁、肿物直径>10 mm、浸润性边界、侧支、叶内播散、鞋钉特点、LOCP和微乳头结构与淋巴结转移相关(均P<0.05)。而性别、双侧、多灶和腺外浸润与淋巴结转移无关(均P>0.05)。进一步多因素分析发现:年龄<45岁、肿物直径>10 mm、浸润性边界、鞋钉特点、LOCP和微乳头结构是PTC淋巴结转移的独立危险因子(均P<0.05)。在随访82例病例中,局部肿瘤复发4例,5年局部复发率为4.88%,其中淋巴结肿瘤复发3例,甲状腺肿瘤复发1例,淋巴结复发病例中有鞋钉特点1例、LOCP 2例、微乳头1例,其中一例中可见LOCP及微乳头结构,甲状腺肿瘤复发病例中未见上述三种结构。
鞋钉特点、LOCP、微乳头结构与PTC淋巴结转移有关,是PTC淋巴结转移有效预测因子,有利于改善PTC患者治疗方法及随访方案。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
甲状腺癌是内分泌系统最常见的恶性肿瘤,甲状腺乳头状癌(papillary thyroid carcinomas, PTC)占所有甲状腺肿瘤的80%~85%,发病率呈全球性增加趋势[1]。其颈部淋巴结转移(lymph node metastasis, LNM)常见,大约有40%的患者在初诊时已发生颈部LNM[2]。
最近研究显示LNM与PTC患者的存活时间减少、肿瘤局部复发风险增加和远处转移有关,伴LNM的PTC疾病相关死亡率是不伴转移的3倍[3]。因此,寻找预测LNM的可靠指标有重要意义[4]。
鞋钉亚型是最近报道的一种高侵袭的、中分化的PTC病理学亚型,患者LNM及病死率高,主要标准为≥30%的肿瘤细胞具有鞋钉特点,即细胞核位于胞质中上方,突向腔缘,似鞋钉,并常见微乳头结构及细胞缺乏黏附性/极性(LOCP),此亚型罕见[5]。而在日常病理诊断中,在PTC肿瘤组织内及边缘经常可见<30%的肿瘤细胞,呈鞋钉样结构、LOCP、微乳头结构,而这些病理学特点与LNM的关系仍不明确。最近有文献报道PTC某些生长模式(如肿瘤边缘侧方单个癌性腺体等)与LNM明显相关,且为其独立危险因子[6]。本研究通过评估PTC生长模式(肿瘤边界、侧支、叶内播散及叶外浸润)及组织形态学特点(鞋钉特点和LOCP≥5%及微乳头结构≥20%),探讨上述指标与LNM的相关关系,以期筛选可靠预测指标,为临床治疗方法的选择和预后的判断提供可靠病理依据。
连续收集首都医科大学附属北京同仁医院病理科2006年1月至2013年12月PTC腺叶全切或近全切+颈部淋巴结清扫标本153例。清扫的淋巴结至少为6个,转移组依照2006版美国癌症联合委员会(AJCC)癌症分期手册[7]中pN(区域淋巴结)的条件:选择性颈部淋巴结清扫标本包含淋巴结至少为6个,改良根治颈部淋巴结清扫标本包含淋巴结至少为10个。
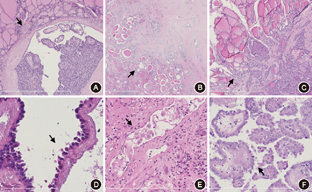
所有标本经4%中性甲醛固定、常规脱水、石蜡包埋、切片,HE染色镜下观察。所有标本进行以下临床病理学评估:年龄(≥45或<45岁)、性别、肿物直径(>1或1 cm)、肿瘤生长方式(肿瘤边界、侧支、叶内播散及叶外浸润)、特殊组织形态学特点(鞋钉特点、LOCP及微乳头结构)、多灶。其中肿瘤生长模式及组织形态特点评估标准如下:肿瘤边界分为膨胀性和浸润性。前者肿瘤境界清楚、平滑未侵及周围正常滤泡,有或无纤维包膜;相反,若肿瘤边界不规则,锐利,或有3个以上浸润周围正常组织的肿瘤性滤泡结构,则归为后者。侧支是指位于肿瘤边缘,垂直于侵袭面的、伸长的管状滤泡,横向长入甲状腺非肿瘤组织内[6]。叶内播散指远离原发肿瘤至少5 μm以上,由PTC细胞组成的滤泡岛,直径<1 mm,而最大直径≥1 mm的则归为多灶组。腺外浸润依据美国病理学家协会定义分类,即甲状腺癌组织侵及甲状腺外组织包括脂肪组织、横纹肌组织、大的血管或神经[8]。鞋钉特点:(1)非PTC的实性型;(2)高细胞型/柱状细胞型或弥漫性硬化的特点所占比例≤10%;(3)≥5%的肿瘤细胞具有鞋钉特点[5]。LOCP是指肿瘤细胞呈单个、松散排列,类似泡沫样组织细胞;或肿瘤核位置上移,位于细胞的中部或顶部[9],无明显鞋钉样或乳头状结构,其所占比例≥5%[10]。微乳头结构是指乳头结构<200 μm、有或无纤维血管轴心;或不规则的无纤维血管蒂的管状结构,其所占比例≥20%[11]。
随访手术时间在2006年1月1日至2013年6月30日的患者82例。全部随访病例通过电话随访,随访电话来自患者住院病历随访资料登记页。
采用SPSS 13.0统计软件进行分析,先用χ2检验对病理学参数进行与淋巴结转移相关的单因素分析,筛选有统计学意义的变量纳入二项分类成组资料非条件Logistic回归模型,进行多因素分析,以P<0.05为差异有统计学意义。
本研究随访病例共82例,随访时间16~106个月,中位随访时间为42个月;局部肿瘤复发4例,其中淋巴结肿瘤复发3例(淋巴结无瘤生存时间分别为18、24、34个月),甲状腺肿瘤复发1例(甲状腺无瘤生存时间为25个月),无远处转移及疾病相关死亡病例。淋巴结复发病例中可见鞋钉特点1例、LOCP 2例、微乳头1例,其中1例中可见LOCP及微乳头结构。甲状腺肿瘤复发病例中未见鞋钉特点、LOCP及微乳头结构。
在153例PTC中,浸润性肿瘤边界(图1A)128例、膨胀性边界(图1B)35例、侧支(图1C)34例、叶内播散30例、腺叶外浸润53例;有鞋钉特点(图1D)37例、LOCP(图1E)59例、有微乳头结构(图1F)70例。对84例有LNM与69例无LNM的PTC各临床病理参数单变量分析,发现年龄<45岁、肿物直径>10 mm、浸润性边界、叶内播散、侧支、鞋钉特点、LOCP(P<0.01)、微乳头结构与LNM相关(P<0.05);而性别、双侧、多灶、出现腺外浸润四项临床病理学参数之间的差异无统计学意义(P>0.05)(表1)。

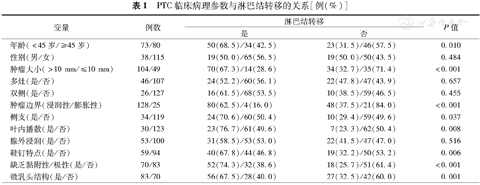
PTC临床病理参数与淋巴结转移的关系[例(%)]
PTC临床病理参数与淋巴结转移的关系[例(%)]
| 变量 | 例数 | 淋巴结转移 | P值 | |||
|---|---|---|---|---|---|---|
| 是 | 否 | |||||
| 年龄(<45岁/≥45岁) | 73/80 | 50(68.5)/34(42.5) | 23(31.5)/46(57.5) | 0.010 | ||
| 性别(男/女) | 38/115 | 19(50.0)/65(56.5) | 19(50.0)/50(43.5) | 0.484 | ||
| 肿瘤大小(>10 mm/≤10 mm) | 104/49 | 70(67.3)/14(28.6) | 34(32.7)/35(71.4) | <0.001 | ||
| 多灶(是/否) | 46/107 | 24(52.2)/60(56.1) | 22(47.8)/47(43.9) | 0.657 | ||
| 双侧(是/否) | 26/127 | 16(61.5)/68(53.5) | 10(38.5)/59(46.5) | 0.455 | ||
| 肿瘤边界(浸润性/膨胀性) | 128/25 | 80(62.5)/4(16.0) | 48(37.5)/21(84.0) | <0.001 | ||
| 侧支(是/否) | 34/119 | 24(70.6)/60(50.4) | 10(29.4)/59(49.6) | 0.037 | ||
| 叶内播散(是/否) | 30/123 | 23(76.7)/61(49.6) | 7(23.3)/62(50.4) | 0.008 | ||
| 腺外浸润(是/否) | 53/100 | 31(58.5)/53(53.0) | 22(41.5)/47(47.0) | 0.516 | ||
| 鞋钉特点(是/否) | 59/94 | 40(67.8)/44(46.8) | 19(32.2)/50(53.2) | 0.006 | ||
| 缺乏黏附性/极性(是/否) | 70/83 | 52(74.3)/32(38.6) | 18(25.7)/51(61.4) | <0.001 | ||
| 微乳头结构(是/否) | 83/70 | 56(67.5)/28(40.0) | 27(32.5)/42(60.0) | 0.001 | ||
单因素分析中有意义的变量纳入二项分类成组资料非条件Logistic回归模型进行多因素分析,分析显示LNM的独立性相关危险因子为:年龄<45岁、肿物直径>10 mm、浸润性边界、鞋钉特点、LOCP、微乳头结构(P<0.05)(表2)。
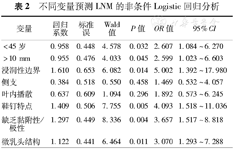
不同变量预测LNM的非条件Logistic回归分析
不同变量预测LNM的非条件Logistic回归分析
| 变量 | 回归系数 | 标准误 | Wald值 | P值 | OR值 | 95%CI |
|---|---|---|---|---|---|---|
| <45岁 | 0.958 | 0.448 | 4.578 | 0.032 | 2.607 | 1.084~6.270 |
| >10 mm | 0.955 | 0.476 | 4.033 | 0.045 | 2.599 | 1.023~6.603 |
| 浸润性边界 | 1.610 | 0.653 | 6.082 | 0.014 | 5.002 | 1.392~17.980 |
| 侧支 | 0.384 | 0.518 | 0.550 | 0.458 | 1.469 | 0.532~4.057 |
| 叶内播散 | 0.637 | 0.609 | 1.094 | 0.296 | 1.892 | 0.573~6.245 |
| 鞋钉特点 | 1.409 | 0.506 | 7.755 | 0.005 | 4.093 | 1.518~11.036 |
| 缺乏黏附性/极性 | 1.297 | 0.449 | 8.336 | 0.004 | 3.657 | 1.517~8.818 |
| 微乳头结构 | 1.122 | 0.441 | 6.464 | 0.011 | 3.070 | 1.293~7.288 |
PTC是一种预后相对较好的恶性肿瘤,恰当的治疗能使患者获得长期的生存和良好的生活质量,颈部LNM是其主要的转移方式。目前国内外对所有PTC患者是否均常规进行颈部淋巴结清扫及清扫范围一直存在争议。而术前无任何临床或影像学LNM证据的病人,其LNM率(隐匿性转移)可高达50%~60%[12]。可见对于PTC患者无论常规清扫淋巴结与否都存在一定问题:未进行淋巴结清扫的患者,无法评估其淋巴结情况,从而影响肿瘤分期、治疗及预后;相反,过于积极的治疗增加手术风险,影响患者术后生活质量且并不被推荐[13]。因此,对于临床没有发现LNM的PTC患者,是否行清扫术以及如何筛选出易出现颈部LNM的患者尚无统一的意见。故寻找PTCLNM的预测指标具有较大的临床意义。
PTC肿瘤边界很早就被提出可能与LNM有关,但不同研究结果差异很大,可能与尚无统一定义有关。依据本研究中采纳的肿瘤边界标准分组,结果显示浸润性边缘与LNM独立相关。2010年有文献首次提出侧支、叶内播散与LNM相关,虽然边缘为浸润性的病例显示具有较多的侧支结构,但并不表明侧支是一种侵袭性生长模式,在有纤维包膜的PTC中也可见到侧支[6]。在本研究单因素分析中,侧叶、叶内播散与LNM相关,而多因素分析中则无关。可见与之相比,LOCP、鞋钉特点和微乳头结构对预测LNM的价值更具有统计学意义。
LOCP和鞋钉特点在PTC中常伴随出现,其定义标准在不同研究中略有不同,但均与PTC增殖指数高、预后差有关[5,9,14]。通常LOCP是诊断上皮性恶性肿瘤的一个病理指标,但很少用于PTC中[4]。2003年有文献最先将LOCP和鞋钉特点用于描述PTC,并提出LOCP标准[9];2004年又增加了细胞所占比例(>20%)及一些形态结构(如不规则腺管、乳头结构)[14]。PTC鞋钉亚型是在2010年最先报道并给出明确定义[5]。鞋钉细胞见于全身许多器官包括卵巢在内的肿瘤中,多与LOCP有关。有作者认为具有鞋钉细胞必须同时具备鞋钉特点及LOCP[5],这一观点仍有争议[15],但研究结果均一致显示:鞋钉特点和LOCP在肿瘤中常相伴出现,并有重叠[5,15]。本研究中分别对此二组织学变量进行评估,发现LOCP较鞋钉特点常见(45.8%比38.6%),鞋钉特点多伴有LOCP,不伴有鞋钉特点的LOCP多见于肿瘤边界。因此推测鞋钉特点可能是LOCP的不同表现形式。本研究中具有两者特点的肿瘤细胞数≥5%即具有预测意义,提示两者均是PTC具有侵袭性表现的病理组织学特点,因此完全区分二者的意义不大。研究显示LOCP是癌浸润边缘处于上皮-间质转化(EMT)的典型形态学改变,是E-钙黏附蛋白或膜β-联蛋白丢失的结果[16,17]。最近,有文献报道EMT调节因子Slug和Twist表达在间变性甲状腺癌中,并与E-钙黏附蛋白缺乏有关,支持EMT在PTC中的作用[18]。
微乳头结构被公认为是任何部位腺癌中预后差的一种表现或组织学类型。与肿瘤的脉管侵犯、淋巴结转移和存活时间缩短2~5年有关[19]。其特点是小乳头状肿瘤细胞簇漂浮在边界清楚的、类似淋巴管腔的间隙内,结构具有反极性(即肿瘤细胞基底或间质面朝向外侧)[20]。对于PTC微乳头结构的定义,有文献在上述特点的基础上增加了:乳头结构无纤维血管轴心,未见鞋钉结构;具有微乳头结构的细胞所占比例>5%[21]。而文章结果显示此类型预后极差,死亡率及LNM率高,但病例罕见(7/496),平时很难遇到,对于LNM常见的肿瘤来说,此标准对预测LNM的临床意义不大。其他文献则定义PTC微乳头结构为小的乳头状结构伴或不伴有纤维血管轴心[5,11,15]。因此本研究采纳后者,并增加乳头直径大小限定。结果显示伴有纤维血管轴心的微乳头结构多见,常与LOCP相伴出现,提示其形成机制可能与LOCP及EMT有关;无纤维血管轴心的微乳头结构少见,多位于肿瘤边界。目前认为微乳头结构的反极性,与基底面获得顶浆分泌功能有关,并被电镜所证实(在肿瘤基底面出现大量微绒毛)[22]。推测这些反极性可促进肿瘤细胞分泌有关间质血管浸润的相关分子(即金属蛋白酶类),从而促进肿瘤的播散。另外,与LOCP不同,反极性的癌细胞间表达E-钙黏附蛋白和细胞黏附因子,但同时也表达波形蛋白[23],推测其形成机制与LOCP同样,可能都与EMT有关,明确机制还有待于进一步研究与证实。
本研究显示PTC5年局部复发率为4.88%(4/82),与文献相近(5年局部复发率5%,10年局部复发率6.1%[24]),且4例复发病例中,3例淋巴结复发病例组织学形态具有鞋钉特点、LOCP、微乳头结构,提示三者与淋巴结复发有关。因随访时间短及病例数限制,三者与PTC预后的相关关系,有待于大宗病例及长期随访研究证实。
总之,鞋钉特点、微乳头结构、LOCP均可作为LNM的独立预测指标。结合其他临床病理参数可有效地预测PTC的LNM情况,从而有助于调整随访策略,优化治疗方案,改善患者预后。特别是在仅行腺叶切除的PTC病例中,出现鞋钉特点、LOCP、微乳头结构提示LNM的风险大,而淋巴结的肿瘤转移情况可影响病人的辅助性治疗方案(如放射性碘治疗及促甲状腺素抑制治疗等)[24]及复查频率的制定,从而影响患者预后。



























