
制作2型糖尿病大鼠模型,观察肾小管间质损伤是否为2型糖尿病的早期肾脏病理改变并探讨其干预方法及可能的机制。
采用高糖高脂饮食诱导联合小剂量链脲佐菌素(STZ)的方法建立2型糖尿病模型,同时设立正常对照组,采用肾康注射液(SKI)进行治疗,观察大鼠的一般状态、生化指标、尿微量白蛋白及尿N–乙酰–β–氨基葡萄糖苷酶(NAG)的改变;应用高胰岛素–正葡萄糖钳夹实验评估大鼠的胰岛素抵抗情况,肾组织高碘酸–雪夫染色(PAS染色)反应观察其病理变化;应用免疫组化方法检测肾组织Toll样受体4(TLR4)表达及肾间质CD68+细胞数。
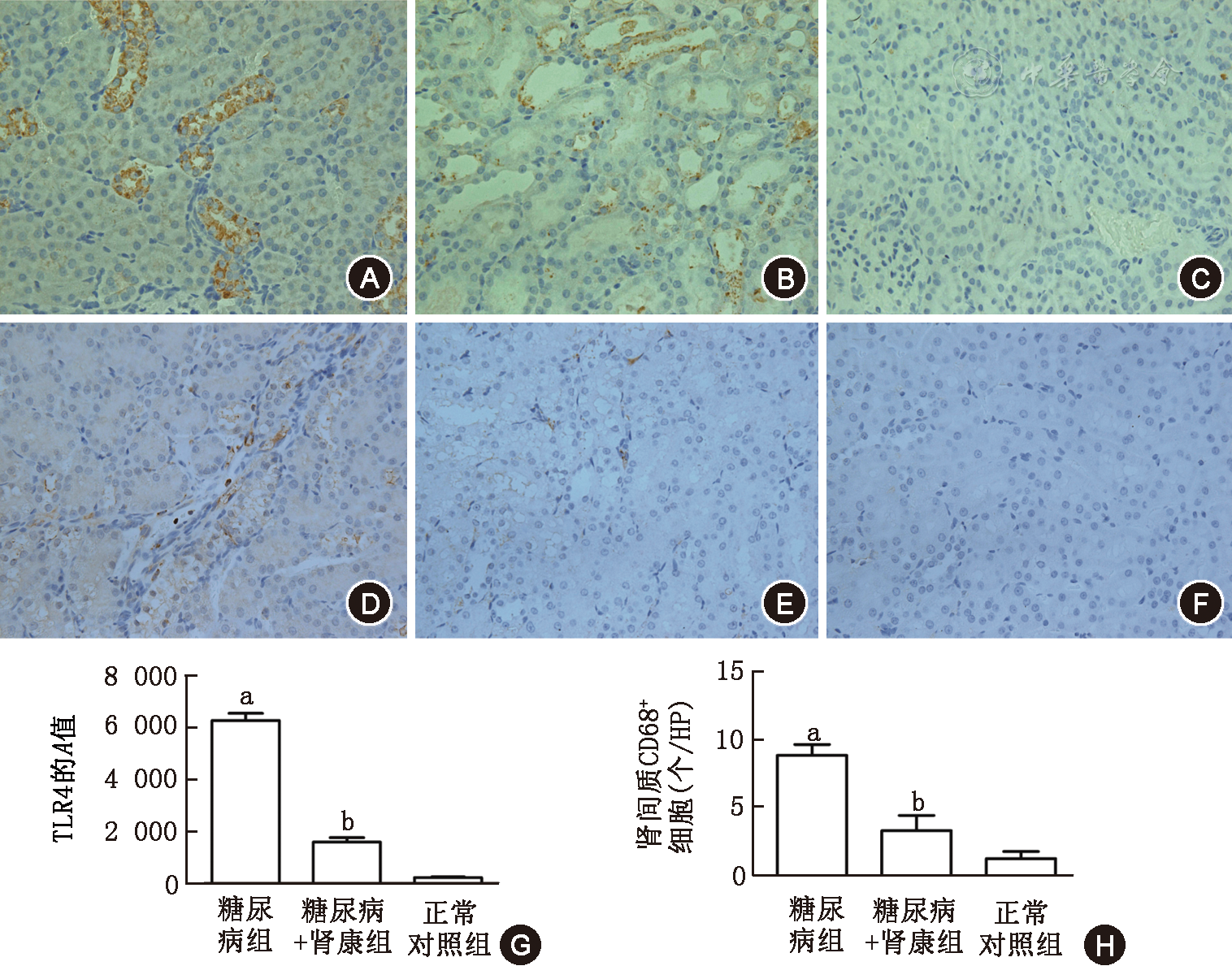
糖尿病大鼠体质量减轻,尿微量白蛋白和尿NAG明显升高,胰岛素抵抗明显,肾小球体积增大,肾小管广泛空泡样变性,肾组织TLR4表达及肾间质CD68+细胞数明显增加[TLR4的累积吸光度(A)值:6 289.86±272.45与207.14±22.37,CD68+细胞数:8.79±0.79与1.23±0.52],SKI治疗后上述情况均有不同程度改善(均P<0.05)。
肾小管间质病变是2型糖尿病早期肾损害表现,SKI可以减轻肾脏的损伤,其机制可能与减少肾组织TLR4表达,抑制炎症介导的巨噬细胞浸润有关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
流行病学调查显示我国糖尿病(DM)的患病率已高达9.7%[1],糖尿病肾病(DN)是DM最常见和最严重的微血管并发症。过去的研究认为肾小球病变是DN的早期病变,肾小管间质损伤继发于肾小球病变,近期研究表明DM肾小管病变对蛋白尿、肾间质纤维化和肾功能改变的影响较肾小球病变更为明显[2],但肾小管间质病变是否早于肾小球病变,是否可以作为治疗糖尿病肾病的早期靶点及其病变机制尚不清楚。本研究拟应用2型糖尿病大鼠模型,观察DN早期的病理生理变化并探讨其治疗方法及可能的机制,现报道如下。
SPF级雌性SD大鼠30只,4周龄,体质量80~100 g,购自北京维通利华实验动物技术有限公司,于解放军总医院实验动物中心清洁级动物室饲养,饲养条件:温度(23±2)℃,湿度(65~70)%,12/12 h明暗交替光照,自由摄食饮水。
链脲佐菌素(STZ,美国Sigma公司);ACCU–Chek血糖仪和血糖试纸(德国Roche公司);大鼠尿微量白蛋白酶联免疫吸附分析(ELISA)试剂盒、大鼠N–乙酰–β–氨基葡萄糖苷酶(NAG)测定试剂盒(南京建成生物工程研究所);Toll样受体4抗体(anti–TLR4)、anti–CD68+(武汉博士德生物工程有限公司);兔超敏二步法免疫组化检测试剂盒(PV–9001,北京中杉金桥生物技术有限公司)。
肾康注射液(SKI)为原液的4倍浓缩液,由西安世纪盛康药业有限公司提供,主要成分为大黄、丹参、红花、黄芪等4种中药的提取物。
4周龄SD大鼠按体质量随机分为造模组和正常对照组(NC组),造模组给予高糖高脂饲料(常规饲料+10%蔗糖+10%猪油+10%蛋黄粉)喂养4周后,禁食过夜,一次性腹腔注射STZ 35 mg/kg(用pH 4.2,浓度1%的枸橼酸/枸橼酸钠缓冲液溶解),1周后尾静脉采血测血糖>16.67 mmol/L并持续1周为糖尿病造模成功。NC组注射等量枸橼酸/枸橼酸钠缓冲液。糖尿病造模成功大鼠按体质量随机分为糖尿病组(DM组)和糖尿病+SKI组(DMSK组),每组10只。糖尿病造模成功后,DMSK组每天腹腔注射SKI浓缩液(6.0 g/kg),DM组和NC组腹腔注射等量生理盐水作为对照,共干预8周。
实验开始后,每2周测量大鼠的体质量,观察记录大鼠的饮食量、饮水量、尿量、毛色及活动情况。
实验方法参照杜英臻等[3],即用60~120 min的稳态葡萄糖输注率(GIR)来反映胰岛素的敏感性;用血糖变异系数(CVBG)反映钳夹技术的准确性,GIR变异系数(CVGIR)反映钳夹技术的可靠性。在SKI给药前、后每组随机选取3只大鼠各行1次钳夹实验。
造模成功后,每2周收集大鼠随机尿,用ELISA法测大鼠尿mALB,分光光度计比浊法检测尿NAG。
SKI给药结束后,各组大鼠均以1%戊巴比妥钠麻醉(30 mg/kg),腹主动脉取血3~5 ml,分离血清,7150全自动生化测定仪(日本日立公司)检测血肌酐(SCr)、血尿素氮(BUN)、血糖(GLU)和甘油三酯(TG)、总胆固醇(TC)水平。
实验结束后,处死大鼠,留取肾脏标本,双侧肾脏称重,计算肾指数(肾质量/体质量×100),取各大鼠同部位肾组织置入4%多聚甲醛磷酸盐缓冲溶液中固定过夜,常规脱水、石蜡包埋,2 μm切片,PAS染色,光镜(日本OLYMPUS公司)下观察肾组织病理学变化。
在400倍视野下随机选取10个正切的肾小球,采用Image–pro plus 5.0图像分析系统(美国Media Cybernetics公司),测量肾小球面积(S小球)、系膜区面积(S系膜),计算S系膜/S小球并用公式V小球=β/κ·S小球3/2(β为形状系数=1.38;κ为体积分布系数=1.1)计算肾小球体积[4]。肾小管损害程度按Paller氏肾小管损伤评分系统记录[5],即每高倍视野随机选择10个肾小管观察,肾小管明显扩张、细胞扁平或肿胀计1分、出现刷状缘损伤或脱落计1分或2分,管型计2分,小管腔内有脱落的坏死细胞(未形成管形或碎片)计1分。每张病理切片共选取10个视野(即100个肾小管)计算平均分。
采用PV二步法免疫组化技术:2 μm切片常规脱蜡至水,微波热修复抗原,3%双氧水封闭内源性过氧化物酶,分别滴加兔抗大鼠TLR4抗体(1∶100)、兔抗大鼠CD68+抗体(1∶100) 4 ℃过夜。磷酸盐缓冲液(PBS)冲洗后滴加聚合物增强剂,室温下20 min孵育,PBS冲洗后滴加辣根酶标记抗兔IgG多聚体,室温30 min,PBS冲洗后二氨基联苯胺(DAB)显色,显微镜下控制显色时间。中止反应后,苏木素复染,1%盐酸乙醇分化,氨水返蓝,常规脱水、透明、封片。每张切片随机选取20个高倍视野,采用Image–pro plus 5.0图像分析系统,分别计算肾小管TLR4的累积吸光度(A)值和肾小管间质的CD68+细胞数,取平均值。
用SPSS 13.0进行数据分析,数据用 ±s表示,所有定量数据资料均经过正态性检验,定量数据的组间比较采用单因素方差分析或秩和检验,P<0.05为差异有统计学意义。
±s表示,所有定量数据资料均经过正态性检验,定量数据的组间比较采用单因素方差分析或秩和检验,P<0.05为差异有统计学意义。
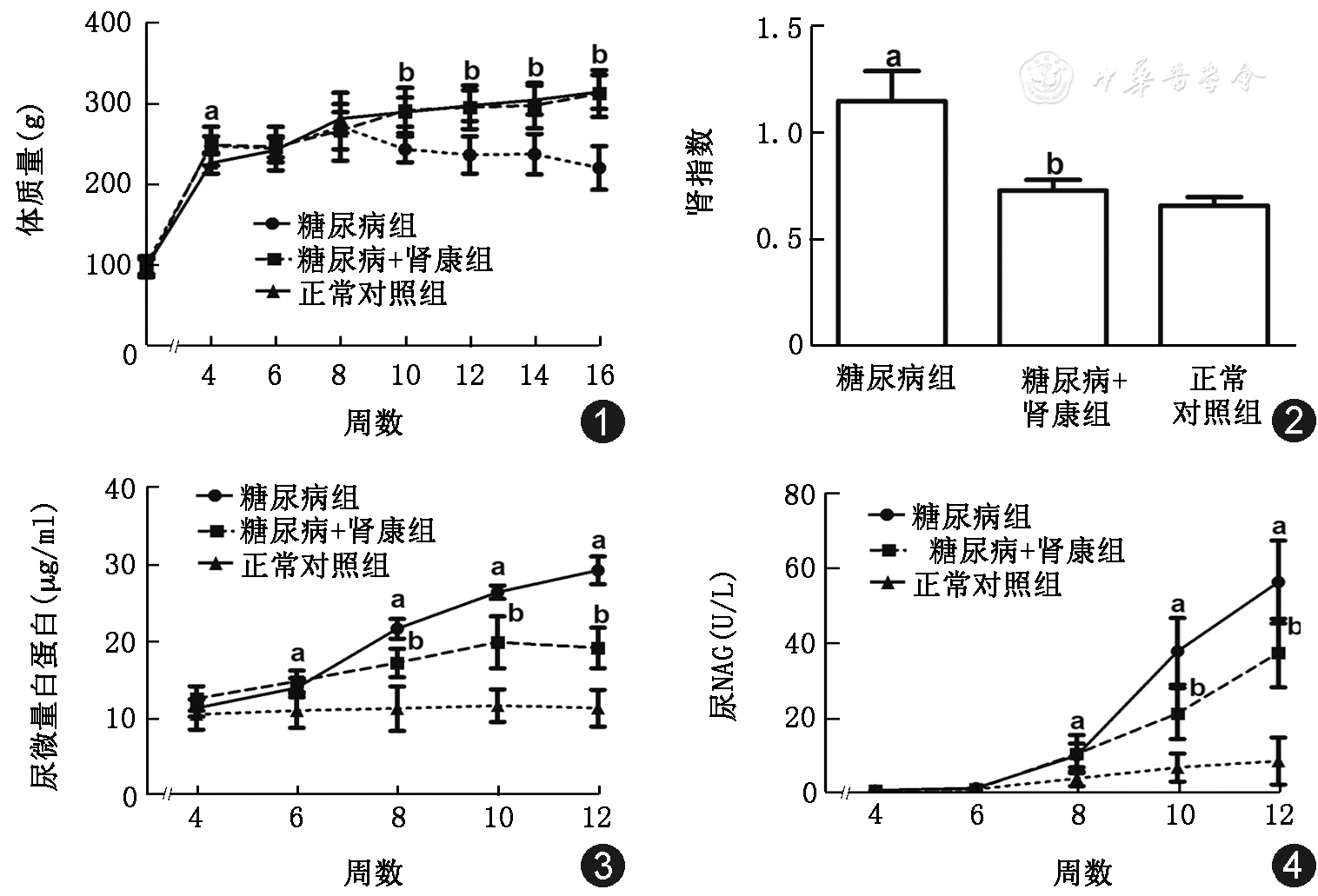
在STZ注射1周后,DM组大鼠的饮水量、尿量明显增多,活动迟缓,体质量下降,体毛干枯萎黄无光泽,部分大鼠可见白内障表现。SKI治疗后上述情况均有不同程度的改善,其中体质量(图1)和肾指数(图2)改善明显。

DM组BUN、GLU高于NC组(P<0.01);SKI治疗后BUN、 GLU水平显著降低(P<0.01);TG、TC在三组大鼠之间差异无统计学意义;DM组SCr较NC组低(P<0.01),可能与DM组大鼠体质量减轻,肌肉含量较低及DN早期肾小球高滤过有关(表1)。
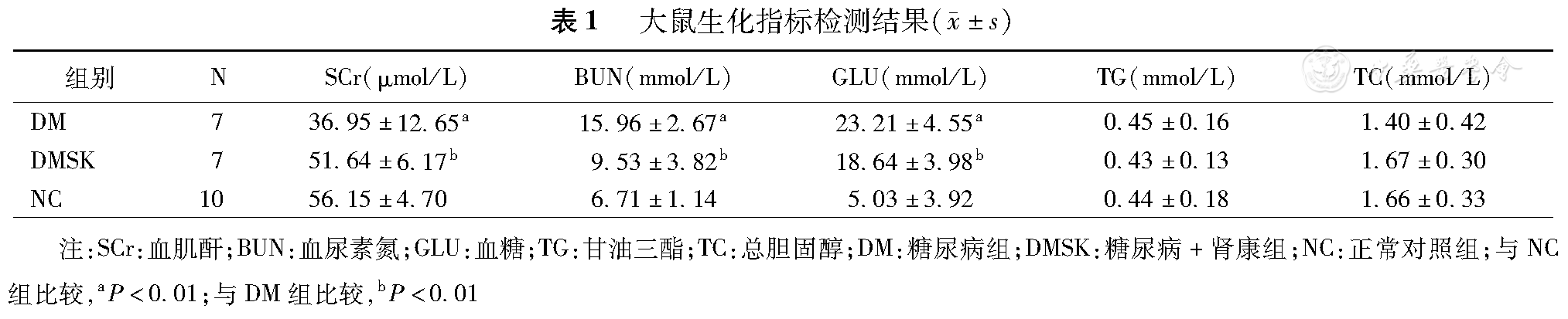
大鼠生化指标检测结果( ±s)
±s)
大鼠生化指标检测结果( ±s)
±s)
| 组别 | N | SCr(μmol/L) | BUN(mmol/L) | GLU(mmol/L) | TG(mmol/L) | TC(mmol/L) | |
|---|---|---|---|---|---|---|---|
| DM | 7 | 36.95±12.65a | 15.96±2.67a | 23.21±4.55a | 0.45±0.16 | 1.40±0.42 | |
| DMSK | 7 | 51.64±6.17b | 9.53±3.82b | 18.64±3.98b | 0.43±0.13 | 1.67±0.30 | |
| NC | 10 | 56.15±4.70 | 6.71±1.14 | 5.03±3.92 | 0.44±0.18 | 1.66±0.33 | |
注:SCr:血肌酐;BUN:血尿素氮;GLU:血糖;TG:甘油三酯;TC:总胆固醇;DM:糖尿病组;DMSK:糖尿病+肾康组;NC:正常对照组;与NC组比较,aP<0.01;与DM组比较,bP<0.01
糖尿病造模成功后第6周,DM组尿mALB开始持续升高,与NC组比较差异有统计学意义(P<0.01),经SKI治疗后,在第8、10、12周各时间点尿mALB均显著降低(P<0.01,图3);造模成功后第8周,DM组尿NAG开始升高,第10、12周明显高于NC组(P<0.01),SKI治疗后,上述各时间点尿NAG均明显下降(P<0.05,图4)。
与NC组比较,DM组的GIR明显降低(P<0.01),提示出现胰岛素抵抗;经SKI治疗后,GIR明显升高,胰岛素抵抗改善(P<0.01,表2)。
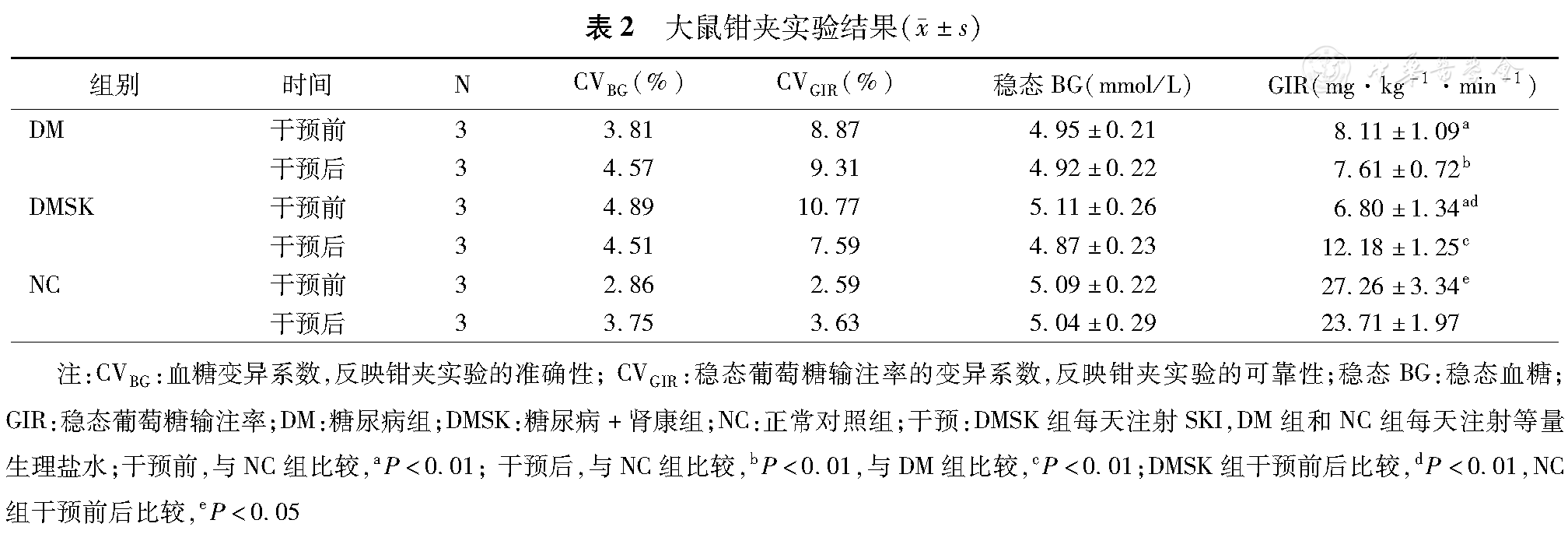
大鼠钳夹实验结果( ±s)
±s)
大鼠钳夹实验结果( ±s)
±s)
| 组别 | 时间 | N | CVBG(%) | CVGIR(%) | 稳态BG(mmol/L) | GIR(mg·kg–1·min–1) |
|---|---|---|---|---|---|---|
| DM | 干预前 | 3 | 3.81 | 8.87 | 4.95±0.21 | 8.11±1.09a |
| 干预后 | 3 | 4.57 | 9.31 | 4.92±0.22 | 7.61±0.72b | |
| DMSK | 干预前 | 3 | 4.89 | 10.77 | 5.11±0.26 | 6.80±1.34ad |
| 干预后 | 3 | 4.51 | 7.59 | 4.87±0.23 | 12.18±1.25c | |
| NC | 干预前 | 3 | 2.86 | 2.59 | 5.09±0.22 | 27.26±3.34e |
| 干预后 | 3 | 3.75 | 3.63 | 5.04±0.29 | 23.71±1.97 |
注:CVBG:血糖变异系数,反映钳夹实验的准确性;CVGIR:稳态葡萄糖输注率的变异系数,反映钳夹实验的可靠性;稳态BG:稳态血糖;GIR:稳态葡萄糖输注率;DM:糖尿病组;DMSK:糖尿病+肾康组;NC:正常对照组;干预:DMSK组每天注射SKI,DM组和NC组每天注射等量生理盐水;干预前,与NC组比较,aP<0.01;干预后,与NC组比较,bP<0.01,与DM组比较,cP<0.01;DMSK组干预前后比较,dP<0.01,NC组干预前后比较,eP<0.05
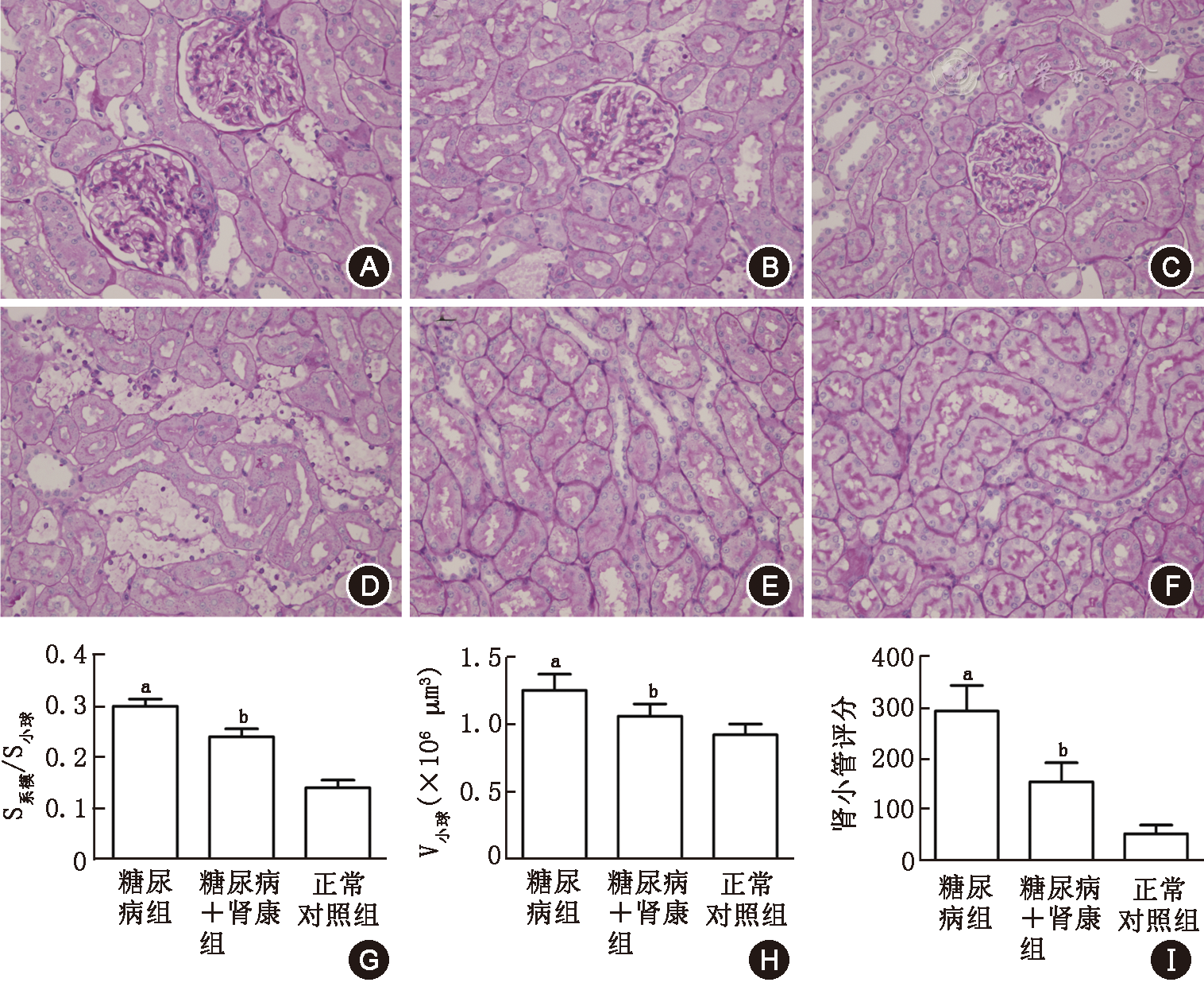
DM组大鼠肾小球体积明显增大,系膜细胞轻度增殖,系膜基质增多,但肾小管广泛空泡样变性和间质炎细胞浸润的病变更为明显,肾小管损伤评分明显增高。SKI治疗后,DMSK组上述情况均有较大改善,S系膜/S小球、V小球、肾小管评分均低于DM组(P<0.01,图5)。

DM组TLR4的表达和肾小管间质的CD68+细胞数明显多于NC组(P<0.01);SKI治疗后,肾小管的TLR4表达和间质的CD68+细胞数明显减少(P<0.01,图6)。

本研究采用高糖高脂饮食联合小剂量STZ法成功复制了2型DM大鼠模型,并采用国际上公认的金标准,即高胰岛素–正葡萄糖钳夹实验来判定胰岛素抵抗情况,结果显示造模成功,DM大鼠胰岛素抵抗明显。
近年研究认为,DM肾小管病变并非继发于肾小球病变,而是DN的原始特征[6,7],肾小管间质的免疫炎症反应在DN发生发展过程中发挥着极为重要的作用[8,9]。Toll样受体(TLR)是参与非特异性免疫的一类重要的跨膜非催化性蛋白质分子,TLR通过识别其配体激活MyD88–NF–κB信号转导途径而介导天然免疫应答与炎症反应,TLR2和TLR4在DM肾组织中表达增加[10]。研究发现高糖可诱导人近端小管上皮细胞中TLR4的表达上调,在DM患者肾组织中也发现TLR4表达增加,且与CD68+单核巨噬细胞浸润的程度一致,提示TLR4可能在介导DN肾脏组织巨噬细胞的募集反应和肾小管间质炎症中发挥了重要作用[11]。本研究发现,在诱导2型DM成功8周后,尿NAG明显增高,12周后肾脏病理发生明显改变,相对于肾小球病变,DM组大鼠的肾小管病变更为严重和广泛,免疫组化显示DM组大鼠肾小管TLR4表达和间质CD68+细胞明显增高,提示DN早期即存在肾小管病变,这些病变可能与TLR4高表达和CD68+细胞浸润有关。
SKI是由大黄、丹参、红花、黄芪四味中药经现代工艺制备而成,对肾康注射液的大黄蒽醌成分进行测定,发现其蒽醌类成分主要为芦荟大黄素、大黄素、大黄酸等[12]。研究表明,大黄素和大黄酸具有改善胰岛素抵抗、改善脂代谢紊乱、降尿蛋白、抗炎和肾功能保护作用[13,14,15,16,17]。本研究发现经SKI治疗8周后,DM大鼠的一般状况和胰岛素抵抗情况明显改善,大鼠血GLU、尿mALB、尿NAG明显降低,肾小球体积和肾小管病变显著改善,免疫组化显示DMSK组大鼠肾小管TLR4表达和间质CD68+细胞数也明显降低。
总之,肾小管间质损伤是2型DM大鼠的肾脏早期病变,SKI在DN早期具有减少尿微量蛋白、改善胰岛素抵抗、抑制肾小球肥大、减轻肾小管损伤的治疗作用,其作用机制可能与抑制肾小管TLR4表达,减轻肾间质巨噬细胞的浸润有关。



























