
调查深圳市人民医院近8年耐碳青霉烯鲍曼不动杆菌(CRAB)感染临床特征、耐药机制及其克隆变迁。
收集2002至2009年深圳市人民医院院内感染患者分离鲍曼不动杆菌;琼脂稀释法检测亚胺培南等抗菌药对鲍曼不动杆菌最低抑菌浓度(MICs);聚合酶链反应(PCR)和DNA测序分析CRAB碳青霉烯酶基因型;脉冲场凝胶电泳(PFGE)分析菌株同源性;依据中国鲍曼不动杆菌感染诊治与防控专家共识,回顾性调查CRAB感染患者病历资料。
2002至2009年共收集到87例CRAB院内感染患者,以呼吸道感染最常见,占69.0% (60/87),其次为血流感染占8.0% (7/87)、伤口感染占8.0% (7/87)和腹腔感染占6.9% (6/87)。80.5% (70/87) CRAB来源于重症监护病房(ICU)。2009年CRAB感染迅速增多,占48.3% (42/87),以呼吸道感染为主(34/42)。87株CRAB共获8种PFGE型别。2002至2006年,CRAB感染主要流行携带blaOXA–58–like基因的CRAB克隆A;2007至2008年主要流行CRAB克隆A和携带blaOXA–23–like基因的CRAB克隆C;2009年携带blaOXA–23–like基因对碳青霉烯高度耐药的CRAB克隆D取代克隆A和C,成为深圳市人民医院CRAB病原菌的主要克隆。
携带blaOXA–23–like基因的CRAB高耐药克隆D造成深圳市人民医院2009年CRAB感染迅速流行。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
鲍曼不动杆菌是我国院内感染主要致病菌之一,可引起免疫力低下及危重患者医院获得性呼吸道感染、血流感染、伤口感染、腹腔感染、中枢神经系统感染和泌尿系感染等,尤以呼吸道感染最常见[1,2],病死率达20%~60%。随着各类抗菌药在临床上的广泛使用,鲍曼不动杆菌的耐药性不断增强。耐碳青霉烯鲍曼不动杆菌(CRAB)常多重耐药,广泛耐药,甚至全耐药,且以克隆方式在医院内甚至地区间播散,对临床抗感染治疗构成了重大威胁。本研究调查了2002至2009年深圳市人民医院87例CRAB感染患者的临床特征、耐药机制及其分子流行病学,以期为CRAB感染的有效诊治和防控提供依据。
2002至2009年深圳市人民医院院内感染患者分离鲍曼不动杆菌,除外同一患者同一部位重复分离的菌株。菌株鉴定采用Vitek–2系统(法国BioMerieux公司),手工生化试验,并使用多重聚合酶链反应(PCR)将菌株鉴定至菌种[3]。
采用琼脂稀释法检测包括亚胺培南等抗菌药物对鲍曼不动杆菌的最低抑菌浓度(MICs)。结果按美国临床实验室标准协会(CLSI) 2014年版推荐的标准判定敏感(S)、中介(I)和耐药(R)。多重耐药(MDR)的定义参照中国鲍曼不动杆菌感染诊治与防控专家共识[1]。
采用煮沸法制备模板。多重PCR检测CRAB的OXA型碳青霉烯酶(OXA–51–like、OXA–23–like、OXA–24–like、OXA–58–like、OXA–143–like)基因[4];参考文献[5]的方法检测blaOXA–51–like及其上游插入序列ISAba1。多重PCR检测金属酶(IMP、VIM、GIM、SPM、SIM)基因[6];PCR检测KPC酶基因[7]。将PCR产物送华大基因公司纯化,并使用扩增引物进行双向测序,测序结果在GenBank经BLAST系统与已知的碳青霉烯酶基因序列比对,确定其基因型。
参考Seifert等[8]推荐的标准化鲍曼不动杆菌PFGE分型方案,并略加调整。参考美国疾病控制和预防中心(CDC)推荐的标准化PulseNet分子分型方案[9],使用沙门菌Braenderup血清型菌株H9812作为PFGE相对分子质量标准。获得的脉冲场电泳图谱使用Fingerprinting II软件进行处理,聚类分析菌株间DNA电泳图谱的相似性,不同菌株的电泳条带的相似性系数用Dice系数表示,范围在0%~100%之间,0%表示完全不相关,100%表示完全相同。根据Tenover等[10]推荐的细菌PFGE分型标准,菌株间带型完全一致视为同一型别,1~3个DNA条带差异视为相同PFGE型别不同亚型。
回顾性调查2002至2009年深圳市人民医院临床诊断CRAB院内感染患者病历资料。患者入院48 h后发生的感染定义为院内感染,CRAB感染的诊断依据中国鲍曼不动杆菌感染诊治与防控专家共识[1]。病历资料调查的内容包括患者人口统计学资料、入住重症监护病房(ICU)的时间和CRAB分离前住院时间、患者基础病和CRAB分离前患者接受的各种侵袭性操作,包括深静脉导管、各种引流管、导尿管、鼻胃管和气管侵袭性操作(如气管插管、气管切开和使用呼吸机),治疗CRAB感染使用的抗菌药,CRAB分离前30 d内曾使用的抗菌药,患者的预后等。
CRAB呼吸道感染的诊断应符合以下条件:(1)细菌感染的一般表现,如发热,白细胞及(或)中性粒细胞分类、C–反应蛋白增高;(2)与肺炎相符合的临床症状、体征和影像学出现新的或持续加重的肺部渗出、浸润和实变;(3)正在接受抗菌药物治疗的患者如果一度好转,复又加重,在时间上与CRAB的出现相符合;(4)呼吸道标本应采用气管镜防污染毛刷采样,或来自肺泡灌洗液,或为高质量的咳痰标本(痰标本革兰染色镜检白细胞>25个/低倍视野,且上皮细胞<10个/低倍视野);(5)2次以上呼吸道标本CRAB半定量培养3+或4+,CRAB为纯培养或为优势菌;(6)存在宿主易感因素,包括基础疾病、免疫低下、先期抗菌药物使用、其他与发病相关的危险因素如机械通气时间等。CRAB血流感染常继发于肺部、静脉导管及腹腔感染,其诊断应符合以下条件:(1)患者有血流感染的临床表现和体征;(2)≥2次不同部位采集的血标本CRAB培养阳性。CRAB伤口感染的诊断应符合以下条件:(1)患者有伤口感染的临床表现和体征;(2)≥伤口分泌物CRAB培养阳性;(3)存在宿主易感因素,包括外伤或手术等致皮肤屏障破坏或患者免疫功能低下,如糖尿病、中性粒细胞减少、药瘾者、艾滋病、长期住院的重症患者。CRAB腹腔感染的诊断应符合以下条件:(1)患者有腹腔感染的临床表现和体征,常见的临床表现包括腹膜透析相关性腹膜炎、胆道感染、腹腔脓肿、胰腺炎、肝脓肿等,常见的症状包括畏寒发热、腹痛、恶心呕吐等;(2)腹水常规检查白细胞升高;(3)腹腔穿刺液CRAB培养阳性,或≥2次腹腔引流液CRAB培养阳性;(4)存在宿主易感因素,包括腹腔置管、器官移植、腹膜透析等。CRAB中枢神经系统感染的诊断应符合以下条件:(1)患者有中枢神经系统感染的临床表现和体征;(2)脑脊液常规检查白细胞升高;(3)脑脊液CRAB培养阳性;(4)存在宿主易感因素,包括外伤或手术导致血脑屏障破坏及术后留置引流管,术后大剂量糖皮质激素应用、术后脑脊液漏、广谱抗菌药物使用等。CRAB泌尿系感染的诊断应符合以下条件:(1)患者有泌尿系感染的临床表现和体征,常见的临床表现包括急性肾盂肾炎、急性膀胱炎等,常见的症状同一般细菌性尿路感染;(2)尿常规检查白细胞升高;(3)中段尿CRAB培养阳性,菌落计数≥105 cfu/ml;(4)存在宿主易感因素,包括手术治疗、留置导尿管、局部用药、尿路梗阻性疾病(如前列腺增生、尿路结石、尿道狭窄)、全身长期使用抗菌药物、放疗与化疗、机体免疫功能受损、长期卧床等。
仅从临床标本中分离培养出CRAB,缺乏感染的临床症状和体征,缺乏其他实验室检查的支持,无宿主易感因素,不能诊断CRAB感染,应视为CRAB定植。
使用SPSS 18.0软件,计数资料的比较使用χ2检验,以P<0.05为差异有统计学意义。
2002至2009年期间,共87例患者满足CRAB感染的诊断标准,其中12例患者(13.8%)为多种病原菌混合感染。以呼吸道感染最常见,占69.0%(60/87),呼吸机相关性肺炎(VAP)占11.5%(10/87);其次为血流感染、伤口感染和腹腔感染,分别占8.0%(7/87)、8.0%(7/87)和6.9%(6/87);3例患者存在多系统感染,均存在呼吸道感染。2009年CRAB感染迅速增多,占48.3%(42/87),以呼吸道感染为主(34/42)。87例CRAB感染患者分别来自ICU(56例)、脑外科(10例)、心胸外科(7例)、老年病科(6例)、其他科室(8例)。CRAB感染患者平均年龄58.5岁,男性多见(73.6%),CRAB分离前患者平均住院时间17 d,80.5%(70/87)CRAB来源于ICU(CRAB分离前48 h内患者曾入住ICU),56.3%(49/87)患者近期接受过外科手术,47.1%(41/87)患者CRAB感染前接受过气管侵袭性操作,50.6%(44/87)患者感染前使用了碳青霉烯类抗菌药,97.7%(85/87)CRAB多重耐药。
87株CRAB扩增blaOXA–51–like均阳性,证实均为鲍曼不动杆菌。87株CRAB共获8种(A~H型)PFGE型别(图1)。由表1可知,43.7%(38/87)CRAB携带blaOXA–58–like基因,且主要为克隆A(37/38),这类菌对亚胺培南和美罗培南低水平或中度耐药(MIC为1~16 μg/ml);51.7%(45/87)CRAB携带blaOXA–23–like基因,且主要为克隆D(34/45)和C(10/45),这类菌对亚胺培南和美罗培南中度或高度耐药(MIC为8~128 μg/ml);1株CRAB携带ISAba1–blaOXA–51–like基因,PFGE型别为F型,对亚胺培南和美罗培南中度耐药(MIC分别为16 μg/ml和32 μg/ml);3株CRAB碳青霉烯酶基因检测阴性,PFGE型别分别为G和H型,对亚胺培南和美罗培南低水平耐药(MIC为2~4 μg/ml)。不同类型CRAB感染中,均发现了携带blaOXA–58–like基因的克隆A和携带blaOXA–23–like基因的克隆C和D。87株CRAB扩增blaOXA–24–like、blaOXA–143–like、金属酶基因及KPC酶基因均阴性。3例CRAB多系统感染分离的7株CRAB均携带blaOXA–51–like和blaOXA–58–like基因,PFGE分型证实均来自克隆A。表2显示,2002至2006年,深圳市人民医院CRAB病原菌主要为携带blaOXA–58–like基因的克隆A,2006年出现携带blaOXA–23–like基因的克隆C,2007年和2008年以克隆A和克隆C为主,2009年出现携带blaOXA–23–like基因的克隆D,并取代克隆A和C成为该院CRAB病原菌的主要克隆。2002至2006年,克隆A主要分布在ICU,散在分布于其他临床科室;2007年和2008年克隆A和克隆C散在分布于该院ICU、脑外科、心胸外科、老年病科;2009年克隆D在ICU流行,且散在分布于全院其他各临床科室。


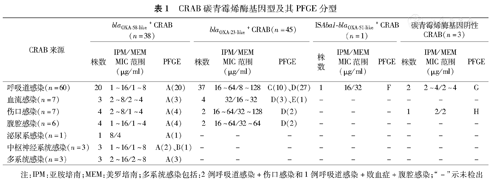
CRAB碳青霉烯酶基因型及其PFGE分型
CRAB碳青霉烯酶基因型及其PFGE分型
| CRAB来源 | blaOXA–58–like+ CRAB(n=38) | blaOXA–23–like+ CRAB(n=45) | ISAba1–blaOXA–51–like+ CRAB(n=1) | 碳青霉烯酶基因阴性CRAB(n=3) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 株数 | IPM/MEM MIC范围(μg/ml) | PFGE | 株数 | IPM/MEM MIC范围(μg/ml) | PFGE | 株数 | IPM/MEM MIC范围(μg/ml) | PFGE | 株数 | IPM/MEM MIC范围(μg/ml) | PFGE | |
| 呼吸道感染(n=60) | 20 | 1~16/1~8 | A(20) | 37 | 16~64/8~128 | C(10)、D(27) | 1 | 16/32 | F | 2 | 2~4/2~4 | G |
| 血流感染(n=7) | 3 | 2~8/2~4 | A(3) | 4 | 32/16~32 | D(3)、E(1) | – | – | – | – | – | – |
| 伤口感染(n=7) | 4 | 2~8/1~4 | A(4) | 2 | 16~64/32~128 | D(2) | – | – | – | 1 | 2/2 | H |
| 腹腔感染(n=6) | 4 | 1~16/1~4 | A(4) | 2 | 16~64/32~64 | D(2) | – | – | – | – | – | – |
| 泌尿系感染(n=1) | 1 | 8/4 | A(1) | – | – | – | – | – | – | – | – | – |
| 中枢神经系统感染(n=3) | 3 | 1~16/1~8 | A(2)、B(1) | – | – | – | – | – | – | – | – | – |
| 多系统感染(n=3) | 3 | 2~16/2~8 | A(3) | – | – | – | – | – | – | – | – | – |
注:IPM:亚胺培南;MEM:美罗培南;多系统感染包括:2例呼吸道感染+伤口感染和1例呼吸道感染+败血症+腹腔感染;"–"示未检出

2002至2009年87例CRAB感染病原菌克隆变迁及PFGE分型(株)
2002至2009年87例CRAB感染病原菌克隆变迁及PFGE分型(株)
| 年份 | blaOXA–58–like+ CRAB(n=38) | blaOXA–23–like+ CRAB(n=45) | ISAba1–blaOXA–51–like+ CRAB(n=1) | 碳青霉烯酶基因阴性CRAB(n=3) |
|---|---|---|---|---|
| 2002(n=3) | A(2) | – | – | H(1) |
| 2003(n=15) | A(14)、B(1) | – | – | – |
| 2004(n=10) | A(10) | – | – | – |
| 2005(n=0) | – | – | – | – |
| 2006(n=6) | A(4) | C(1) | – | G(1) |
| 2007(n=9) | A(4) | C(4) | – | G(1) |
| 2008(n=2) | A(1) | C(1) | – | – |
| 2009(n=42) | A(2) | C(4)、D(34)、E(1) | F(1) | – |
注:"–"示未检出
87例CRAB感染患者中,84例患者接受了抗菌治疗(3例blaOXA–58–like+ CRAB感染患者分离出CRAB当日死亡),82.1%(69/84)患者使用含舒巴坦复合制剂、碳青霉烯类或四环素类治疗。35例blaOXA–58–like+ CRAB感染患者中,77.1%(27/35)患者使用含舒巴坦复合制剂和(或)碳青霉烯类治疗,其中12例用含舒巴坦复合制剂单药治疗,6例用碳青霉烯类单药治疗,9例用含舒巴坦复合制剂联合碳青霉烯类或这两类药分别联合其他抗菌药物治疗;45例blaOXA–23–like+ CRAB感染患者中,86.7%(39/45)患者使用含舒巴坦复合制剂、碳青霉烯类或四环素类治疗,其中6例含舒巴坦复合制剂单药治疗,2例碳青霉烯类单药治疗,5例四环素类(米诺环素或多西环素)单药治疗,26例使用这3类抗菌药间的联合或与其他抗菌药物治疗;1例ISAba1–blaOXA–51–like+ CRAB感染患者使用含舒巴坦复合制剂单药治疗;3例碳青霉烯酶基因阴性CRAB感染患者中,2例患者使用含舒巴坦复合制剂单药治疗,1例患者使用碳青霉烯类联合其他抗菌药物治疗。表3显示,CRAB克隆A、C和D感染患者治愈好转率分别为67.6%、50.0%和55.9%;病死率分别为29.7%、40.0%和38.2%,3个CRAB克隆感染患者病死率差异无统计学意义(χ2=0.719,P>0.05)。
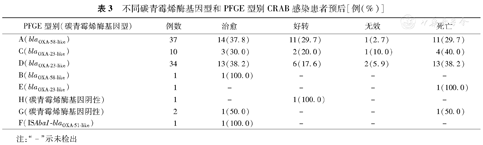
不同碳青霉烯酶基因型和PFGE型别CRAB感染患者预后[例(%)]
不同碳青霉烯酶基因型和PFGE型别CRAB感染患者预后[例(%)]
| PFGE型别(碳青霉烯酶基因型) | 例数 | 治愈 | 好转 | 无效 | 死亡 |
|---|---|---|---|---|---|
| A(blaOXA–58–like) | 37 | 14(37.8) | 11(29.7) | 1(2.7) | 11(29.7) |
| C(blaOXA–23–like) | 10 | 3(30.0) | 2(20.0) | 1(10.0) | 4(40.0) |
| D(blaOXA–23–like) | 34 | 13(38.2) | 6(17.6) | 2(5.9) | 13(38.2) |
| B(blaOXA–58–like) | 1 | 1(100.0) | – | – | – |
| E(blaOXA–23–like) | 1 | – | – | – | 1(100.0) |
| H(碳青霉烯酶基因阴性) | 1 | – | 1(100.0) | – | – |
| G(碳青霉烯酶基因阴性) | 2 | 1(50.0) | – | – | 1(50.0) |
| F(ISAba1–blaOXA–51–like) | 1 | 1(100.0) | – | – | – |
注:"–"示未检出
目前欧洲约9%院内感染由鲍曼不动杆菌引起,以呼吸道感染最常见[2]。研究显示[11],来自呼吸道病原菌占32%,伤口占19.5%,尿道占19%,血液占16%,无菌体液和导管尖端占13.5%。根据深圳市人民医院内部连续多年细菌耐药监测报告,2002至2008年全院临床各类标本(除外重复分离菌株)CRAB的年分离率分别为16.7%、34.8%、28.8%、14.5%、39.1%、43.3%、24.1%,2009至2013年迅速上升至69.3%、73.6%、75.1%、70.2%、83.3%,由此推测2009年全院内出现了CRAB新耐药克隆的流行。为查明该院2009年CRAB迅速增多的原因,分析CRAB感染的临床特点,启动了针对该院CRAB感染临床特征和分子流行病学的研究计划。本研究共诊断87例CRAB院内感染,以呼吸道感染最常见69.0%(60/87),高于国外文献报道[11],其次血流感染8.0%(7/87)、伤口感染8.0%(7/87)和腹腔感染6.9%(6/87)。
Joly–Guillou[2]研究认为,鲍曼不动杆菌感染与近期外科手术和长期使用人工装置密切相关,鲍曼不动杆菌血流感染患者年龄通常>50岁,大多为男性,54%患者来自ICU。一些研究者发现碳青霉烯类的使用是CRAB定植和感染的危险因素[12,13]。本研究中80.5%(70/87)CRAB病原菌来源于ICU,患者平均年龄58.5岁,男性多见(73.6%),CRAB分离前患者平均住院时间17 d,56.3%(49/87)患者近期接受过外科手术,47.1%(41/87)患者CRAB感染前接受过气管侵袭性操作,50.6%(44/87)患者感染前使用了碳青霉烯类抗菌药,与文献报道一致。
碳青霉烯酶是鲍曼不动杆菌对碳青霉烯类耐药的主要机制,包括金属酶、KPC酶和D类酶,以D类酶最常见,如OXA–23组、OXA–24组、OXA–58组、OXA–143组[3,4]。OXA–51组为鲍曼不动杆菌天然的染色体介导OXA型酶。研究发现,尽管鲍曼不动杆菌OXA–51组酶对碳青霉烯类水解活性较弱,然而当该基因上游存在插入序列ISAba1时,可明显增强OXA–51组酶基因表达水平,导致对碳青霉烯类耐药[5]。鲍曼不动杆菌对碳青霉烯类耐药的机制还包括外膜蛋白通透性降低、外排泵的激活以及青霉素结合蛋白改变等[14]。近年来国内学者报道的临床分离CRAB主要携带blaOXA–23–like基因,且以寡克隆形式在国内流行。Wang等[15]调查了1999至2005年国内11家教学医院221株亚胺培南耐药不动杆菌(其中187株CRAB,分属7个克隆)的碳青霉烯酶耐药基因和分子流行病学,发现国内多家医院的亚胺培南耐药不动杆菌主要携带(97.7%)blaOXA–23–like基因,仅浙江杭州医院发现极少菌株携带blaOXA–58–like基因。Zhou等[16]调查了2005年国内16个城市医院临床分离的342株CRAB,证实94.2%(322/342)CRAB携带blaOXA–23–like基因,主要以6个克隆在国内流行,未发现携带blaOXA–58–like、blaOXA–24–like基因或金属酶基因的CRAB。本研究发现,2002至2006年深圳市人民医院CRAB感染主要流行携带blaOXA–58–like基因的克隆A,这类菌对亚胺培南和美罗培南低水平或中度耐药(MIC为1~16 μg/ml),临床实验室容易漏检;2006年开始出现携带blaOXA–23–like基因的对亚胺培南和美罗培南中度或高度耐药(MIC为8~128 μg/ml)克隆C,2007年和2008年以克隆A和克隆C流行为主,2009年出现携带blaOXA–23–like基因对亚胺培南和美罗培南中度或高度耐药(MIC为8~128 μg/ml)的克隆D,并取代克隆A和C成为该院CRAB病原菌的主要克隆,提示深圳市人民医院不同时期流行的CRAB克隆发生变化,导致菌株的耐药性发生改变,目前尚不清楚导致CRAB克隆改变的原因。
根据中国鲍曼不动杆菌感染诊治与防控专家共识[1],治疗多重耐药鲍曼不动杆菌感染,可选择舒巴坦或含舒巴坦复合制剂或碳青霉烯类抗菌药,可联合氨基糖苷类或氟喹诺酮类抗菌药。本研究中97.7%(85/87)CRAB多重耐药,82.1%(69/84)CRAB感染患者使用舒巴坦复合制剂、碳青霉烯类或四环素类治疗,3个CRAB流行克隆A、C和D感染患者病死率分别为29.7%、40.0%和38.2%,与国外文献报道一致[2]。
鉴于携带blaOXA–23–like基因的CRAB高耐药克隆已在深圳市人民医院流行,应切实积极采取有效措施,加强隔离消毒,预防和控制CRAB在医院内、医院间、地区间进一步传播。



























