
比较甲状腺相关性眼病(TAO)患者与健康人泪液中的溶菌酶C和乳铁蛋白的表达差异。
泪液样品采自TAO活跃期的患者25眼(病例组)和年龄、性别相匹配的健康志愿者25眼(对照组)。将泪液标本进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳,采用15%的凝胶分离两组样品的差异蛋白条带,收集标记的差异蛋白条带进行凝胶内胰蛋白酶消化,然后进行质谱分析,以确定在差异条带中的蛋白质组分。Scaffold搜索引擎分析质谱的结果,进行蛋白质的鉴定。
通过对差异蛋白条带的质谱分析,发现在TAO患者泪液中大多数蛋白表现为下调或者缺失,但是溶菌酶C和乳铁蛋白却发生了上调。鉴定蛋白的相对定量比值(病例/对照):溶菌酶C为4.88,乳铁蛋白为1.60。
TAO患者泪液中的溶菌酶C和乳铁蛋白均发生上调,说明两者可能参与了TAO的炎症过程。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
甲状腺相关性眼病(TAO)是一种器官特异性自身免疫性眼眶病,为成年人最常见的眼眶病[1]。在TAO患者,特别是活动期患者,常常有眼表面不适症状类似眼表炎症[2]。有研究证实在TAO患者泪液中细胞因子的平衡遭到破坏[3],但其泪液中具体蛋白质的变化乏见研究。有学者通过蛋白质组学分析(生物标志物相对分子质量为3 000~20 000)发现,在TAO患者绝大部分泪液蛋白下调,只有少部分泪液蛋白表现为上调[4]。溶菌酶C和乳铁蛋白是人类泪液蛋白的重要组成部分,也是维持泪液功能及眼表正常代谢的必要物质。本研究通过采用蛋白质组学研究技术比较TAO患者与健康人泪液中的溶菌酶C和乳铁蛋白的表达差异,现报道如下。
收集2011年11月至2012年8月入住上海长征医院眼科的甲状腺相关眼病活动期患者25例(25眼),其中男11例(11眼),女14例(14眼)。年龄18~65(42±2.21)岁。根据Bartalena标准的严重性分类,选择了中度到严重的甲状腺相关眼病。测量眼表面的相关指标,包括眼球突出,睑裂宽度,以及眼睑闭合不全等。眼科检查包括视力,裂隙灯检查,眼底检查,泪膜破裂时间,荧光素染色及Schimer测试,在TAO患者和正常对照组分别进行。患者如果出现以下情况:患有影响眼表功能的疾病如糖尿病等自身免疫性疾病,配戴隐形眼镜,眼外伤,眼睛手术,其他眼表疾病病史,妊娠期和哺乳期,6个月内曾服用避孕药、抗组胺药、抗抑郁药和抗胆碱能药等及3个月内曾使用人工泪液眼药水和其他一些药品的患者被排除在研究之外。TAO严重程度通过临床活动评分(CAS)确定,本研究纳入病例组的CAS评分均≥3分,共25名年龄和性别匹配的健康志愿者被纳入作为正常对照组。其中男11例(11眼),女14例(14眼),年龄20~65(42±2.15)岁。本研究经上海市杨浦区市东医院伦理委员会批准,所有研究对象均签署知情同意书。
所有泪液标本采集根据自愿的原则,通过10 μl毛细玻璃管在下睑结膜囊泪阜处虹吸法采集泪液,未使用表面麻醉药物或其他化学性药物,尽量不接触眼表,每个病例采集10 μl泪液,Ep管分装,置–80 ℃冰箱保存。
采用纳流高效液相色谱分离。先将泪液标本行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳(胶浓度15%),将电泳后的差异蛋白条带切成凝胶颗粒;凝胶颗粒经蛋白消化后,加高效液相色谱溶剂液体补足样品体积至20 μl;液相/液质联用多功能自动进样器取10 μl样品注入20 μl loop环,并通过自动进样器上的六通阀所连接的peek管将样品转载入Magic C18AQ反相柱(0.1 mm×150 mm,3 μm粒径,200 Å孔径,美国Michrom BioResources公司);高效液相使用带有氦除气管和4个纳流泵的Michrom BioResources高效液相色谱仪(Paradigm MDLC);质谱分析使用LTQ orbitrap "XL"质谱仪(赛默飞世尔科技,美国),液质接口使用带有提前喷射源的LC-MS接口(美国Michrom BioResources公司);质谱采用正离子模式,由Tune and Xcalibur 2.5.5控制软件根据数据依赖的自动模式实施一级和二级的切换。
Sorcerer engine(4.0.4 build,美国Sage-N Research公司)整合了Sequest(赛默飞世尔科技,美国)对所有质谱的RAW文件的MS2数据进行ipi.HUMAN.v3.65 database (86 379 entries)数据库搜索、匹配、打分;处理参数:固定修饰选择Carbamidomethyl C (+57.021 465),半酶切模式,质量范围600~4 600,对蛋白质组学设置2个酶错切位点,对磷酸化蛋白质组学设置3个酶错切位点,利用内建程序对原数据库做反转,并整合成新数据库。搜索参数的设置:MS1质量精度±10×10–6,MS2质量精度1,可变修饰:oxidized M(+15.994 92),蛋白质组学可允许4个可变动态修饰和每个修饰最多出现3次。
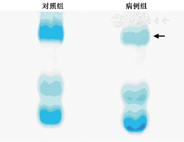
经过SDS-PAGE凝胶电泳后发现病例组和对照组的蛋白条带有显著差异(图1),将箭头所示的差异条带切取行蛋白质谱分析,分析结果发现大多数蛋白表现为下调或者缺失,但有几种蛋白呈上调的趋势,尤其是溶菌酶C和乳铁蛋白(表1)。
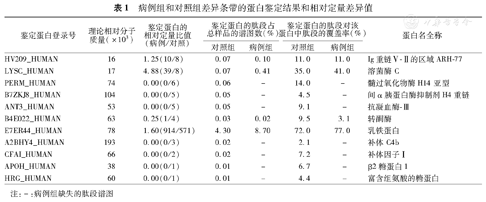
病例组和对照组差异条带的蛋白鉴定结果和相对定量差异值
病例组和对照组差异条带的蛋白鉴定结果和相对定量差异值
| 鉴定蛋白登录号 | 理论相对分子质量(×103) | 鉴定蛋白的相对定量比值(病例/对照) | 鉴定蛋白的肽段占总样品的谱图数(%) | 鉴定蛋白的肽段对该蛋白中肽段的覆盖率(%) | 蛋白名全称 | ||
|---|---|---|---|---|---|---|---|
| 对照组 | 病例组 | 对照组 | 病例组 | ||||
| HV209_HUMAN | 16 | 1.25(10/8) | 0.07 | 0.10 | 11.0 | 11.0 | Ig重链Ⅴ-Ⅱ的区域ARH-77 |
| LYSC_HUMAN | 17 | 4.88(39/8) | 0.07 | 0.41 | 35.0 | 41.0 | 溶菌酶C |
| PERM_HUMAN | 74 | 0.00(0/6) | 0.06 | – | 14.0 | – | 髓过氧化物酶H14亚型 |
| B7ZKJ8_HUMAN | 104 | 0.00(0/5) | 0.05 | – | 4.5 | – | 间α胰蛋白酶抑制剂H4重链 |
| ANT3_HUMAN | 53 | 0.00(0/5) | 0.05 | – | 9.1 | – | 抗凝血酶-Ⅲ |
| B4E022_HUMAN | 63 | 0.25(1/4) | 0.03 | 0.02 | 9.5 | 3.1 | 转酮酶 |
| E7ER44_HUMAN | 78 | 1.60(914/571) | 4.30 | 8.70 | 72.0 | 77.0 | 乳铁蛋白 |
| A2BHY4_HUMAN | 193 | 0.00(0/3) | 0.02 | – | 2.1 | – | 补体C4b |
| CFAI_HUMAN | 66 | 0.00(0/2) | 0.02 | – | 7.2 | – | 补体因子Ⅰ |
| APOH_HUMAN | 38 | 0.00(0/1) | 0.01 | – | 6.7 | – | β2糖蛋白1 |
| HRG_HUMAN | 60 | 0.00(0/1) | 0.01 | – | 4.4 | – | 富含组氨酸的糖蛋白 |
注:–:病例组缺失的肽段谱图

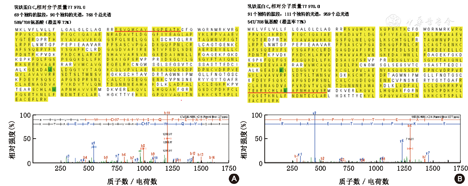
通过蛋白质谱鉴定,溶菌酶C的理论相对分子质量为16 536.9,图2A和图2B分别表示溶菌酶C对照组和病例组的肽段匹配图(黄色区域为经质谱鉴定所得到的肽段)及红线标示肽段的原始质谱图。鉴定蛋白的相对定量值病例组为39,对照组为8,鉴定蛋白的相对定量比值(病例/对照)为4.88。溶菌酶C在TAO患者泪液中呈现显著上调的趋势。


乳铁蛋白的理论相对分子质量为77 970.0,图3A和3B分别表示乳铁蛋白对照组和病例组的肽段匹配图(黄色区域为经质谱鉴定所得到的肽段)及红线标示肽段的原始质谱图。鉴定蛋白的相对定量值病例组为914,对照组为571,鉴定蛋白的相对定量比值(病例/对照)为1.60。乳铁蛋白在TAO患者泪液中的上调尽管没有溶菌酶C那么明显,但其上调的趋势是显而易见的。

溶菌酶是一种球形蛋白质,具有抗菌、抗感染、抗病毒的活性,在免疫和防御中起着相当重要的作用。既往的研究资料表明,许多眼部疾病会伴有泪液中溶菌酶C的改变。由于原发性开角型青光眼和剥脱综合征性青光眼炎症机制不同,溶菌酶C在二者泪液中的表达也不同[5]。又如相对于对照组干眼症患者泪液中的溶菌酶C出现显著下调[6],睑缘炎[7]患者的泪液中溶菌酶也呈下调的趋势,而在糖尿病性视网膜病变患者的泪液呈现上调[8]。本研究发现,与健康对照组相比,活跃期TAO患者的泪液中溶菌酶C表现为上调,这与Matheis等[9]的研究结果一致。由于溶菌酶C与单核细胞系统和巨噬细胞系统相关联,使其在免疫反应中起着相当重要的作用[10]。因此,在TAO患者泪液中溶菌酶C的上调可能预示着眼眶和泪腺的免疫性炎症的进程。
泪液乳铁蛋白是由泪腺的腺泡细胞产生的一种双凸起铁结合糖蛋白。它具有抗原非特异性防御机制,因而参与先天免疫。一旦感染发生,乳铁蛋白可以从血液和炎症组织中的嗜中性粒细胞中释放,调节免疫细胞的迁移、成熟和功能,因此,会影响免疫适应性和先天豁免[11],在伤口愈合过程中的炎症阶段,乳铁蛋白也增加促炎症细胞因子,刺激树突状细胞的成熟,促进各种白细胞的聚集[12]。乳铁蛋白是一种调节炎症,细胞生长和分化,并具有广泛的抗微生物活性的多功能蛋白。乳铁蛋白在圆锥角膜[13]和干眼症[14]患者泪液中出现显著下调,在糖尿病性视网膜病变[8]和真菌性角膜炎[15]的泪液中上调,本研究发现,乳铁蛋白在TAO患者泪液中同溶菌酶C一样呈现上调趋势。乳铁蛋白是免疫系统动态平衡的一部分,它可以降低分子的氧化应激,并控制过度的炎症反应。有大量的累积证据表明,氧化应激在TAO的病理机制中充当重要角色[16],而泪液中乳铁蛋白的上调很有可能说明了局部的细胞损伤促进了局部的氧化应激反应的发展。溶菌酶和乳铁蛋白在防止细菌入侵方面具有协同作用,从而增加免疫力[17]。而本研究中在TAO的泪液中溶菌酶C和乳铁蛋白均发生了上调,说明这两个因子均参与了TAO的炎症过程,在TAO发病的免疫机制中可能存在着协同的作用,其具体机制有待进一步研究。



























