
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者,男,34岁,因"皮肤变黑9年,反复腹水7年,右下肢肿胀4个月余"2014年4月入住北京协和医院普通内科。2005年11月起患者面部、牙龈、腋窝、乳晕、关节等处皮肤变黑,食欲稍差、乏力,2006年2月外院查血白蛋白(Alb)明显降低,结核菌素试验(PPD)阴性(–)、胸部CT未见异常;促肾上腺皮质激素(ACTH) 209.66 pmol/L,血皮质醇早8点127.1 nmol/L,下午4点94.0 nmol/L,0点116.1 nmol/L。肾上腺CT:双肾上腺区占位病变,脾梗死、脾大;垂体MRI未见明显异常。考虑"Addison病、结核病可能性大",予口服泼尼松10 mg每天1次替代治疗,异烟肼0.4 g+利福平0.45 g每天1次抗结核治疗。2年后自行停用激素及抗结核药,期间患者皮肤颜色略变浅、食欲及乏力好转。2007年患者因腹胀、腹围加大,外院检查示大量腹水,利尿治疗后腹水减少,此后患者无不适。2012年6月患者再次出现腹胀、腹围增大、腹部及双下肢可凹性水肿,检查示"Alb降低、血小板减少;凝血异常;大量腹水、脾大、门静脉栓塞(门静脉主干3.6 cm);双肾上腺内钙化灶",考虑为"门脉高压性腹水",予补充白蛋白及输血浆、利尿后腹水消失。2013年11月底患者右侧小腿红肿明显,伴活动后呼吸困难,2014年1月外院超声示右下肢各段静脉血栓形成(陈旧性)、门静脉血栓(陈旧性),建议上级医院就诊。2014年2月我院查血常规血小板90×109/L;凝血酶原时间(PT) 13.6 s,活化部分凝血活酶时间(APTT) 95.1 s,狼疮抗凝物(LA)阳性(+) 2.14 s; Alb 9 g/L;CT肺动脉造影(CTPA):双侧多发肺动脉可见充盈缺损,以线状及附壁血栓为主,右下肺动脉闭塞,内见再通表现,右下肺各基底段肺动脉明显纤细,右肺中叶肺动脉、左下肺动脉起始部狭窄,远端扩张;支气管动脉可见迂曲扩张;考虑慢性肺栓塞可能性大。予华法林1.5 mg每天1次抗凝,为进一步诊治收入院。患者近2年大便偏稀,2~3次/d,每次便量不多、无黑便。近3年来躯干部皮肤出现多发皮肤小结节及皮下质软肿物,无不适症状,未重视。无皮疹、光过敏、关节肿痛、雷诺现象、口眼干、口腔或外阴溃疡、脱发等表现。起病以来一般情况好,小便正常,体重较起病前无明显变化(病中有腹水时最重达100 kg以上)。既往史:有输血浆史。个人史:吸烟10余年×10支/d。家族史:父母、姐姐、子女均肥胖,父亲因"肺癌"于2000年去世,母亲患"高血压"。入院体格检查:全身皮肤偏黑,尤以面部、关节摩擦处、牙龈、腋窝为重,躯干部皮肤可见多个小球样隆起结节,最大者直径约7 cm,边界清,无压痛,质软。心肺听诊无特殊。腹膨隆,腹围112 cm,无腹壁静脉曲张,全腹无压痛、反跳痛及肌紧张。肝脾触诊不佳,移动性浊音(–),肠鸣音5次/min。右侧小腿明显可凹性水肿,皮肤稍红、皮温稍高。
入院后相关检查,血常规:白细胞(2.53~4.01)×109/L,中性粒细胞(1.41~2.8)×109/L,血红蛋白152 g/L,血小板(71~100)×109/L;生化:总蛋白52 g/L,Alb <10 g/L(免疫比浊法1.77 g/L),前白蛋白347 mg/L,丙氨酸氨基转移酶29 U/L,肌酐68 μmol/L;总胆固醇7.60 mmol/L,甘油三酯2.65 mmol/L,低密度脂蛋白5.18 mmol/L,载脂蛋白B 1.57 g/L,游离脂肪酸72 μmol/L。凝血PT 21.3 s,APTT 63.7~100 s,纤维蛋白原3.89 g/L,D-二聚体1.19 mg/L;APTT(1∶1)纠正试验:APTT 81.4 s,APTT(纠正) 58.1 s。尿常规+沉渣(–);24 h尿蛋白0.05 g。便潜血(+);便苏丹Ⅲ染色(–);D-木糖吸收试验1.7 g。血渗透压298 mOsm/kgH2O。尿渗透529 mOsm/kgH2O。PPD(–),淋巴细胞+干扰素A+B 0 SFC 106MC。肿瘤标志物:甲胎蛋白33.8 μg/L,CA125 40.3 kU/L,余正常。免疫方面:红细胞沉降率21 mm/1 h,超敏C反应蛋白1.97 mg/L;IgG 20.82 g/L(升高↑),IgM 3.09 g/L↑,IgA 2.69 g/L;蛋白电泳Alb%14.4%(降低↓),白蛋白球蛋白比0.2,余升高;C3、C4正常;抗核抗体(ANA)斑点型(S)1∶1 280(+),抗ds-DNA、抗Sm(–);抗可溶性核抗原抗体、抗中性粒细胞胞质抗体(–)。狼疮抗凝物(LA) 2.05 s;抗心磷脂抗体(ACL) >120 PL IgG-KU/L,抗β2糖蛋白1(β2GP1) >200 000 RU/L。内分泌方面:促甲状腺激素6.504 mU/L↑,三碘甲状腺原氨酸4.22 nmol/L↑,甲状腺素17.30 nmol/L↑,游离三碘甲状腺原氨酸55.22 pmol/L,游离甲状腺素16.73 pmol/L。甲状过氧化物酶抗体81.26 kU/L↑,甲状腺球蛋抗体1 054.00 kU/L↑,促甲状腺素受体抗体<1 U/L。甲状旁腺素9.07 pmol/L;游离钙:1.13 mmol/L。ACTH 87.12 pmol/L↑。血皮质醇584.0 nmol/L。24 h尿皮质醇64.94 μg。(立位)血管紧张素-肾素-醛固酮系统:醛固酮58.17 nmol/L↓,肾素活性0.01 μg·L–1·h–1↓,血管紧张素Ⅱ 89.86 ng/L。抗肾上腺抗体阴性。尿电解质:K 22.6 mmol/L,Na 176 mmol/L,Cl 188 mmol/L。肾上腺CT:双侧肾上腺形态欠规则伴钙化影(图1);鞍区CT:未见明显异常。影像学检查:下肢深静脉彩超:右侧股浅静脉下段、腘静脉血栓形成。胸部CT:双肺下叶点片影及索条影,未见肿大淋巴结,双侧局部胸膜粘连。腹盆增强CT+小肠重建:回肠末端肠壁略厚,强化欠均匀;脾大;双侧肾上腺多发钙化;腹腔内少量积液;门脉异常改变;肠系膜区脂肪间隙模糊;皮下水肿。门静脉CT三维重建:考虑门静脉海绵样变性可能;胆囊窝迂曲血管团;脾静脉细、充盈欠均匀,陈旧血栓不除外,侧支开放;脾大;胆囊显示不清。腹盆CT动脉造影未见明显异常。胃镜:距门齿约32 cm以下,可见曲张静脉,呈蛇形,灰蓝色,最大直径约0.3 cm,未见红色征,胃底未见曲张静脉,胃角、胃窦黏膜呈褐色花斑样(含铁血红素沉积?),余黏膜红白相间,略显水肿十二指肠球部、球后及降部黏膜轻度肿胀,未见明显淋巴管扩张样改变。活检病理:(十二指肠降部)小肠黏膜显慢性炎,固有层水肿;(胃窦)胃黏膜显慢性炎。钡灌肠造影:结肠气钡双对比造影未见明显异常。(外院)肠失蛋白显像:未见蛋白丢失征象。最终诊断:抗磷脂抗体综合征(APS)、门静脉血栓、门静脉海绵样变性、食管胃底静脉曲张、脾大、脾梗死、腹水、右下肢深静脉血栓形成、慢性肺栓塞、Addison病、部分性肾上腺功能低减;先天性无白蛋白血症(CAA)可能性大,皮肤脂肪瘤;亚临床甲状腺功能减退、桥本甲状腺炎。治疗:入院后予以依诺肝素钠6 000 U每12 h 1次皮下注射,后序贯华法林3 mg每天1次抗凝治疗,监测国际标准化比值(INR) 2.3~2.6。2014年10月状况:患者无明显不适主诉,大便3~4次/d,为黄色稀便。体格检查:皮肤结节无明显变化,心肺听诊正常,腹围113 cm,移动性浊音(–);右小腿无明显水肿。
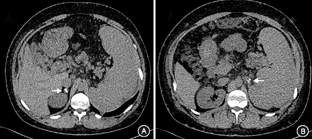

患者有Addison病,双侧肾上腺钙化,易误诊为肾上腺结核。
患者低白蛋白血症,有凝血功能异常,门静脉高压,易误诊为肝硬化,或诊断不明。
在Addison病,而无结核感染证据时,需考虑有无结缔组织病可能。
对于常规检查白蛋白<10 g/L,临床表现轻,无摄入、丢失及肝脏合成功能异常时,需考虑先天性无白蛋白血症(CAA)的可能。
原发性抗磷脂抗体综合征(APS),治疗仅需单纯抗凝;若明确为继发性APS,需对原发病进行治疗。
患者青壮年男性,病程9年,主要表现有肾上腺皮质功能不全、低白蛋白血症、多发静脉血栓。首先,患者有明确门静脉、右下肢深静脉血栓,实验室检查示APTT 80~100 s,LA升高,β2GPI、ACL均阳性,APS诊断明确。临床上诊断APS需区分其为原发性或继发性,患者多次查ANA(S)1∶1 280阳性,考虑系统性红斑狼疮(SLE)继发APS可能;但是,患者无发热、皮疹、关节肿痛、浆膜炎、肾脏损害、神经症状等SLE相关临床表现,亦无抗ds-DNA、抗Sm抗体,补体不低,血白细胞及血小板略低不除外与脾大脾亢有关,尚不满足SLE诊断标准。根据临床经验,男性SLE多病情重,治疗反应差,而本患者未使用激素及免疫抑制剂治疗,病情趋于缓和,与SLE表现不符,暂不宜行激素及免疫抑制剂治疗。
患者2006年发现皮肤变黑,有乏力、纳差,当地医院查血ACTH高,血皮质醇低,肾上腺占位,诊断Addison病。生理剂量糖皮质激素替代治疗有效,但是,患者近4年停药后无肾上腺皮质功能不全表现,与普通Addison病不同。患者2006年血ACTH达209.66 pmol/L,皮质醇降低;近期复查ACTH 87.12 pmol/L,血皮质醇及24 h尿游离皮质醇均正常,血钠、血糖为正常低限。Addison病在我国最常见病因为肾上腺结核,文献报道概率为60%~80%,多数起病隐匿,当肾上腺破坏>50%出现临床症状,随着肾上腺破坏加重,进一步出现肾上腺皮质功能不全、盐皮质激素分泌不足表现。本患者来自中国区县,肾上腺钙化明显,有Addison病,从概率上讲,需首先考虑肾上腺结核可能。但是,患者一般状况良好,无发热、盗汗、肺部病变等结核感染表现,PPD及淋巴细胞+干扰素均阴性,患者肾上腺破坏不明显,与结核不符,尚需考虑其他原因所致肾上腺钙化可能。西方国家Addison病最常见病因为结缔组织病(CTD),自身免疫性肾上腺炎肾上腺多萎缩少数钙化,且多伴有其他免疫性疾病。此患者亦有自身免疫性甲状腺炎、APS,考虑CTD可能。患者有多发静脉血栓形成,APS导致肾上腺血管血栓或出血梗死后机化可致肾上腺钙化,Pubmed数据库检索APS合并Addison病报道,文献中有部分、单侧、双侧肾上腺梗死等表现。复习文献,可知APS为Addison病的少见病因,Addison病可以为APS的首发表现[1],文献中,大部分患者肾上腺功能无恢复,少数可见肾上腺功能部分恢复,可能与肾上腺血供丰富有关。本患者临床表现及实验室检查均可诊断原发性肾上腺功能减退,但是,其肾上腺功能并无进行性下降,表现为部分性肾上腺皮质功能低减,病因考虑APS可能性大。目前尚不需激素替代治疗,随诊过程中应定期检测血皮质醇水平,嘱咐患者若遇应激事件,需及时补充皮质醇。
低蛋白原因可分为摄入不足、合成障碍、丢失过多;本患者饮食正常,无摄入不足表现,无肝脏合成功能障碍,丢失方面,24 h尿蛋白仅0.05 g,但患者近2年有大便次数增多,考虑为蛋白丢失性肠病可能。肠道失蛋白为非选择性,而此患者主要表现为低白蛋白,而IgG、脂蛋白、转铁蛋白均无减低,肠黏膜活检未见淋巴管扩张,核素标记肠失蛋白显像阴性,不能诊断为蛋白丢失性肠病。
通常,门静脉高压、严重低蛋白血症患者多有难治性腹水,而本患者血Alb仅8~9 g/L,胃镜见门脉高压食管下段静脉曲张表现,但其仅有极少量腹水,无全身水肿表现,病程中有2次腹水,均经补蛋白、利尿治疗后顺利消失,此临床表现难以解释,且临床罕见血白蛋白<10 g/L病例。诊疗过程中我们首先怀疑白蛋白测定是否准确,目前临床上最常用白蛋白检测经典方法为溴甲酚绿或溴甲酚紫染色法,多次检测患者Alb 8~9 g/L,但是,当Alb<15 g/L时,超出其检测线性范围,所得结果不准确。免疫比浊法在蛋白较低时检测结果可靠[2],多次免疫比浊法检测患者血Alb≤2 g/L。得以确证后,进一步寻找患者白蛋白究竟去了何方,查阅文献,CAA与患者情况较为相符,病因为编码白蛋白基因突变,特点即为白蛋白极低,临床表现却相当轻微,常规检测方法Alb<10 g/L,肝功能正常,没有肾脏、胃肠道白蛋白丢失证据。白蛋白基因位于4q13,3,含16 961核苷酸,14个外显子,文献报道基因突变点比较分散,多见于外显子部分,亦有内含子部分发生突变[3]。在www.albumin.org中目前已有62例CAA患者注册。此为常染色体隐性遗传,多数患者有家族史,杂合子携带者白蛋白水平可正常或偏低。文献报道近一半CAA患者无明显症状,部分患者出现不同程度水肿、易劳累,下半身肥胖,脂肪瘤等,患者其他检查结果亦有些特征:β球蛋白、γ球蛋白、血脂、脂蛋白、甲状腺结合球蛋白等均升高,可代偿维持血浆胶体渗透压,并可部分替代白蛋白功能。本患者临床表现及实验室检查均支持CAA的诊断,但是,检测本患者家族中母亲、姐姐、女儿血白蛋白均正常,与文献报道不甚相符,不确定是否为突变基因在携带者中无表达,有待基因检测结果。CAA目前报道较少,合并其他临床疾病报道更少。文献报道中有1例5岁儿童患者基因诊断CAA明确,合并微小病变性肾小球肾炎,激素治疗后好转,后随诊至11岁时尿蛋白仍为阴性[4]。而本患者合并临床疾病较多,目前,患者白蛋白基因已完成14个外显子基因测序,均未见突变,内含子测序尚未完成。
对本例思考:APS引起肾上腺钙化,导致Addison病在我国并不常见,如遇肾上腺钙化、Addison病,而无明确结核证据,需考虑包括APS在内的结缔组织病等其他病因。CAA为一种为常染色体阴性遗传性疾病,发病率约1/1 000 000,为4q11-13白蛋白基因突变,导致血白蛋白水平极低,用染色法检查<10 g/L,免疫比浊法检测白蛋白水平可更低。患病率无性别差异,患者围生期死亡率高,若为成人,代偿良好,病情相对轻,水肿等表现不重,可认为是一种良性疾病。患者其他蛋白可部分代偿白蛋白功能,多有高脂血症、脂肪代谢异常。患者白蛋白低,高凝状态,血管内皮损伤修复差,脂代谢异常,血栓事件及心脑血管病发病率高。但目前尚无合并APS病例报道。如遇白蛋白浓度极低而临床表现轻微者,除外蛋白摄入、合成、丢失后,需考虑CAA可能;基因检测示Alb-DNA位点突变可明确诊断。由于CAA发病率低,目前经验尚少,有待更多病例报道。


























