
探讨慢性间歇性低氧(CIH)对氧化应激和炎症反应的影响及脂联素的干预作用。
将45只雄性Wistar大鼠按随机数字表法随机分为:常氧对照组、CIH组和CIH–脂联素组各15只。常氧对照组呼吸正常空气,CIH组每天行8 h的CIH,CIH–脂联素组除每天8 h的CIH外,每周经尾静脉注射脂联素10 μg。35 d后采集所有大鼠的血液标本,比较三组间血清中脂联素、肿瘤坏死因子(TNF)–α、白细胞介素(IL)–1β、IL–6、C–反应蛋白(CRP)及颏舌肌组织中丙二醛、超氧化物歧化酶(SOD)、和髓过氧化物酶(MPO)、活性氧族和核因子(NF)–κB水平。
CIH组血清中脂联素水平均显著低于常氧对照组、CIH–脂联素组[(4 208±2 239)比(7 051±2 432)、(6 405±2 384)ng/ml,均P< 0.05],但与CIH–脂联素组(1.04± 0.27)差异无统计学意义。CIH组血清TNF–α和CPR水平均显著高于常氧对照组、CIH–脂联素组[(70.87±35.16)比(26.54±20.32)、(29.50±22.54)pg/ml和(31.84±11.48)比(22.68±9.63)、(25.32±8.34)mg/L](均P<0.05),而常氧对照组、CIH–脂联素组间差异均无统计学意义;CIH组、CIH–脂联素组IL–6水平均显著高于常氧对照组[(30.54±12.25)、(23.04±13.85)比(14.10±8.83)pg/ml,均P<0.05],而CIH组、CIH–脂联素组组间差异无统计学意义。CIH组颏舌肌组织中丙二醛含量均显著高于常氧对照组、CIH–脂联素组[(8.05±4.53)比(5.18±3.03)、(5.74±3.06)nmol/mg,均P<0.01],常氧对照组、CIH–脂联素组间差异无统计学意义;CIH–脂联素组SOD活力水平显著低于CIH组而高于常氧对照组[(42.42±23.17)比(61.77±36.38)、(18.62±11.67)U/mg,均P<0.05]; CIH组、CIH–脂联素组MPO含量均显著高于常氧对照组[(0.40±0.29)、(0.31±0.17)比(0.17±0.08)μU/mg,均P<0.01],而CIH组、CIH–脂联素组间差异无统计学意义;CIH–脂联素组活性氧族相对水平显著低于CIH组而高于常氧对照组(1.94±1.01比3.31±1.56、1.08±0.38,均P<0.05); CIH组NF–κB的mRNA相对量显著高于常氧对照组(2.24±0.34比0.78 ±0.21,P<0.05)但与CIH–脂联素组(1.04± 0.27)差异无统计学意义。
CIH可诱导体内产生显著的氧化应激和炎症反应,NF–κB通路参与其中,脂联素对其有抑制作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
阻塞性睡眠呼吸暂停低通气综合征(OSAHS)以慢性间歇性缺氧(CIH)为典型特征。研究显示,OSAHS患者普遍存在氧化应激,这是导致其容易罹患心血管并发症的重要原因之一[1,2]。有学者也指出,CIH可能与氧化应激以及炎症有关[3]。在氧化应激过程中,体内超氧化物歧化酶(SOD)和活性氧族水平可显著增高,而在炎症反应过程中炎症因子水平,如肿瘤坏死因子–α(TNF–α)、白细胞介素(IL)及C–反应蛋白(CRP)等也可显著增高[4]。研究发现,OSAHS患者可出现低脂联素血症,并且循环脂联素水平随着患者的呼吸暂停–低通气指数(AHI)升高而降低[5]。脂联素是一种由脂肪细胞特异性分泌的多肽类激素,其生理功能包括[6]:(1)增加胰岛素的敏感性;(2)抗炎;(3)抗动脉粥样硬化;(4)降低循环内葡萄糖、甘油三酯和游离脂肪酸水平等。研究显示,脂联素能减轻冠心病缺血–再灌注所引起的氧化应激性损伤[7]。
OSAH患者常伴有肥胖和心血管疾病等可能引起氧化应激和炎症反应的混杂因素。目前,对于作为OSAHS核心损伤机制之一的CIH是否能独立引发炎症仍存在争议,也不清楚脂联素对CIH可能引起的全身性氧化应激和炎症反应有无明确的保护机制。本研究通过动物实验探讨CIH对氧化应激和炎症反应的影响及脂联素的干预作用。
45只雄性Wistar大鼠,体质量160~200 g,由江苏省SPF级实验动物中心提供。
10%脂联素溶液(美国Linco公司);CIH舱(南京新飞分析仪器制造有限公司);YS–1型数字式测氧仪(南京新飞分析仪器制造有限公司);有机玻璃舱(南京新飞分析仪器制造有限公司);脂联素、TNF–α、CRP和IL酶联免疫吸附(ELISA)检测试剂盒(美国RD公司);丙二醛检测试剂盒(美国BioVision公司);SOD检测试剂盒(日本同仁化学研究所);髓过氧化物酶(MPO)检测试剂盒(上海信帆生物科技有限公司);活性氧族试剂盒(上海碧云天生物技术研究所)。
45只大鼠按随机数字表法分成三组各15只,分别为常氧对照组、CIH组和CIH–脂联素组。常氧对照组呼吸正常空气,CIH组每天行8 h的CIH,CIH–脂联素组同样的CIH外,每周的第1天给予一次尾静脉注射10 μg的脂联素。所有大鼠正常饮食喂养。35 d后处死,取血浆及颏舌肌标本用于检验。本实验通过南京医科大学实验动物学伦理委员会批准。
通过氮气稀释原理,将CIH、CIH+脂联素组大鼠置放在CIH舱中,向CIH舱中循环充入氮气和压缩空气,每循环周期90 s,45 s充入氮气,随之45 s充入压缩空气,并调节气体流量,使每一循环舱内最低氧浓度达5%,然后逐渐恢复至21%,其中氧浓度测定使用YS–1型数字式测氧仪。将常氧对照组大鼠放入相同的舱内,向舱内循环充入压缩空气。每天干预8 h(9:00~17:00),共35 d。
完成造模后,对所有大鼠采集心腔血。血标本抽取后立刻送本医院临床检验中心进行以下指标检测:以ELISA法分别检测血清脂联素、TNF–α、CRP和IL–6水平。
实验结束后,用水合氯醛麻醉大鼠后,体外心腔取血后以断颈法处死。然后采集所有大鼠的颏舌肌组织标本,采用以比色法为基本原理的实验技术分别检测了三组大鼠颏舌肌组织内丙二醛的含量和SOD的活力;MPO以ELISA法检测;以荧光探针法检测活性氧族含量,在荧光显微镜下观察大鼠颏舌肌组织中总活性氧族的相对水平,以常氧对照组为参照标准,进行标化换算比较。通过实时荧光定量(RT–q)聚合酶链式反应(PCR)技术检测大鼠颏舌肌组织中转录因子核因子(NF)–κB的mRNA水平。检测均按照试剂盒说明操作。
采用SPSS 13.0统计软件,计量资料以 ±s表示。三组间参数比较采用单因素方差分析,两两比较采用SNK法。以P<0.05为差异有统计学意义。
±s表示。三组间参数比较采用单因素方差分析,两两比较采用SNK法。以P<0.05为差异有统计学意义。
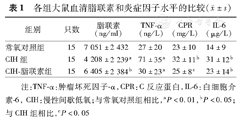
CIH组脂联素水平均显著低于常氧对照组、CIH–脂联素组(P=0.002、0.015),而常氧对照组、CIH–脂联素组间差异无统计学意义(P=0.468);CIH组TNF–α水平均显著高于常氧对照组、CIH–脂联素组(均P<0.01),而常氧对照组与CIH–脂联素组间差异无统计学意义(P=0.777);CIH组CPR水平均显著高于常氧对照组、CIH–脂联素组(P=0.040、0.048),常氧对照组与CIH–脂联素组间差异无统计学意义(P=0.569);CIH组、CIH–脂联素组IL–6水平均显著高于常氧对照组(P=0.002、0.045),但CIH组与CIH–脂联素组间差异无统计学意义(P=0.090)(表1)。
各组大鼠血清脂联素和炎症因子水平的比较( ±s)
±s)
各组大鼠血清脂联素和炎症因子水平的比较( ±s)
±s)
| 组别 | 只数 | 脂联素(ng/ml) | TNF–α(ng/L) | CPR(mg/L) | IL–6(μg/L) |
|---|---|---|---|---|---|
| 常氧对照组 | 15 | 7 051±2 432 | 27±20 | 23±10 | 14±9 |
| CIH组 | 15 | 4 208±2 239a | 71±35a | 32±11b | 31±12b |
| CIH–脂联素组 | 15 | 6 405±2 384b | 30±23a | 25±8c | 23±14b |
注:TNF–α:肿瘤坏死因子–α,CPR:C反应蛋白,IL–6:白细胞介素–6, CIH:慢性间歇低氧;与常氧对照组相比,aP<0.01,bP<0.05;与CIH组相比,cP<0.05
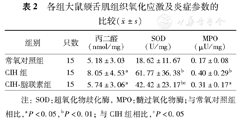
CIH组大鼠颏舌肌组织中MDA的含量均显著高于常氧对照组、CIH–脂联素组(P=0.001、0.002),而常氧对照组、CIH–脂联素组间差异无统计学意义(P=0.691);CIH–脂联素组SOD活力水平显著低于CIH组但高于常氧对照组(P=0.015、0.009);CIH组、CIH–脂联素组MPO含量均显著高于常氧对照组(P=0.002、0.047),但CIH组与CIH–脂联素组间差异无统计学意义(P=0.240)(表2)。
各组大鼠颏舌肌组织氧化应激及炎症参数的比较( ±s)
±s)
各组大鼠颏舌肌组织氧化应激及炎症参数的比较( ±s)
±s)
| 组别 | 只数 | 丙二醛(nmol/mg) | SOD(U/mg) | MPO(μU/mg) |
|---|---|---|---|---|
| 常氧对照组 | 15 | 5.18±3.03 | 18.62±11.67 | 0.17±0.08 |
| CIH组 | 15 | 8.05±4.53a | 61.77±36.38b | 0.40±0.29b |
| CIH–脂联素组 | 15 | 5.74±3.06a | 42.42±23.17bc | 0.31±0.17a |
注:SOD:超氧化物歧化酶,MPO:髓过氧化物酶;与常氧对照组相比,aP<0.05,bP<0.01;与CIH组相比,cP<0.05
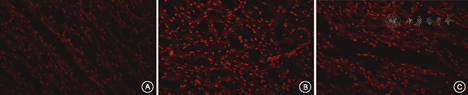
CIH–脂联素组大鼠颏舌肌组织中活性氧族相对表达水平显著低于CIH组但高于常氧对照组(1.94±1.01比3.31±1.56、1.08±0.38,P=0.001、0.038)(图1)。

CIH组NF–κB的mRNA相对量显著高于常氧对照组(2.24±0.34比0.78 ±0.21,P=0.014)但与CIH–脂联素组(1.04± 0.27)差异无统计学意义(P=0.062)。
本研究结果显示CIH可使血清脂联素水平下降,提示临床上OSAS患者低脂联素血症与CIH相关,其原因可能与缺氧导致脂肪细胞因子分泌不足有关。此外,过氧化物也可能抑制脂联素mRNA的转录,导致氧化应激状态时脂联素水平随ROS的增加而减少[9]。亦有报道TNF–α、IL–6以及IL–18等细胞因子能抑制脂联素基因的表达[10]。
本研究结果还显示,CIH可引起血中和颏舌肌肉组织中氧化应激和炎症因子水平升高,提示存在明显的氧化应激和炎症反应。CIH组颏舌肌丙二醛含量显著升高,提示CIH导致大量脂质发生过氧化,引起活性氧族生成。本实验明确发现CIH组总活性氧族显著增多,进一步证明CIH导致氧化应激状态被激活。SOD能有效催化分解超氧化物自由基,可侧面反映细胞内的活性氧族水平[11]。本研究中CIH组血清SOD活力异常升高,提示CIH造成了氧化–还原失衡。
MPO是一种含铁溶酶体,可作为反映中性粒细胞等髓系炎症细胞浸润活性的重要指标[12]。本研究中CIH组大鼠血MPO含量显著升高,提示CIH可能促进炎症反应。
作为炎症信号通路的核心,NF–κB对多种促炎性细胞因子(如TNF–α、IL–6等)的基因转录尤其关键[13]。本研究显示,CIH能导致促使血NF–κB水平升高,提示CIH能启动促炎性反应的信号传导通路;CIH组大鼠血清的TNF–α和IL–6水平均显著升高,提示CIH可引起血清中这两种炎症因子水平升高。
有研究都发现OSAHS患者的CRP水平升高,但都未排除肥胖、年龄、吸烟或心血管并发症等混杂因素的影响[13]。本研究中观察到CIH对血清CRP水平有明显影响,提示OSAHS患者的CIH本身是CPR增高的原因;因本实验使用的都是健康的成年非肥胖型大鼠,CIH后也未见其体重有显著增高。
本研究中选择颏舌肌组织观察是因为该组织在OSAHS发病中具有重要意义。该组织一旦损伤易于使OSAHS产生不断加重的恶性循环。上述结果提示CIH不但在颏舌肌局部组织中开启了以NF–κB为核心的炎症信号传导通路,造成炎症反应性损伤,还引起循环中多种炎症因子水平升高。
本研究结果显示CIH本身可引起全身氧化应激和炎症反应,其激活涉及NF–κB途径,补充脂联素可明显缓解上述反应。这提示干预性的补充脂联素,可能在一定程度上缓解OSAHS患者中由于CIH造成的组织器官损伤。



























