
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者,女,22岁,主因间断发热伴全血细胞减少1个月余于2013年6月30日入院。患者于妊娠12周时无明显诱因出现发热,体温波动于38.5~39.5 ℃,伴轻微畏寒,查血常规发现全血细胞减少,无咽痛、咳嗽、咳痰、腹痛、腹泻、尿频、尿急等不适。当地医院查血常规:白细胞2.9×109/L,血红蛋白74 g/L,血小板30×109/L。曾于当地医院多部位行骨髓穿刺检查:骨髓感染象改变,粒系、红系巨幼样改变,巨核系成熟障碍,偶见分类不明细胞,形态考虑淋系改变。血涂片、骨髓多次均未找到疟原虫、杜氏利曼原虫及其他寄生虫。骨髓流式细胞免疫分型:未见异常表达。检测常见29种白血病融合基因均阴性(-)。免疫球蛋白重链(IgH)、T细胞受体(TCR)基因重排(-)。自身免疫抗体系列均(-)。2次血培养均(-)。结核杆菌T细胞斑点试验(T-spot)(-),结核-DNA(-)。巨细胞病毒-DNA(-),EB病毒(EBV)抗体IgG阳性(+),IgM(-),EBV-DNA 6.04×105拷贝/ml。梅毒、HIV抗体(-),肥达反应(-)。PET-CT:(1)肝、脾肿大,其内未见异常密度影,双侧肱骨头、胸骨、部分椎体、髋骨头氟代脱氧葡萄糖(FDG)代谢弥漫性增高,考虑血液系统疾病。(2)部分空泡蝶鞍,双侧上颌窦炎。(3)双侧腮腺、颌下腺FDG代谢增高,考虑炎症,双侧腋窝淋巴结,较大者短径者约0.8 cm伴FDG代谢轻度增高,考虑淋巴结炎性反应性增生。(4)左肺下叶少许索条影,未见放射性摄取增高,考虑炎症后改变。(5)心包少许积液;心房室腔密度较低,提示贫血。(6)妊娠子宫。因全血细胞进行性下降,持续发热,当地医院怀疑"淋巴瘤",予环磷酰胺+长春新碱+阿霉素+泼尼松(CHOP)方案试验性化疗1疗程,体温曾正常2 d,后再次出现发热,后予积极抗感染、抗病毒治疗1周,症状仍无缓解,为进一步治疗来我院收入院。体格检查:体温37.4 ℃,中度贫血貌,巩膜黄染,双下肢少许出血点,双侧颈部、腋下可及数个淋巴结,最大直径1 cm,质软、活动、无压痛,肺部无异常,心率120次/min,腹膨隆如孕周,肝肿大,肋下7 cm,质中,无触痛,脾肿大,甲乙线15 cm,甲丙线15 cm,丁戊线3 cm,质中,无触痛。入院后血常规:白细胞2.98×109/L,血红蛋白74 g/L,血小板23×109/L。生化:总蛋白51.6 g/L,白蛋白26.5 g/L,天冬氨酸转氨酶(AST)94.2 U/L,总胆红素30.31 μmol/L,直接胆红素12.79 μmol/L,间接胆红素17.52 μmol/L,乳酸脱氢酶992.2 U/L,甘油三酯4.62 mmol/L,β2微球蛋白4.26 mg/L,C反应蛋白75.7 mg/L。出凝血时间:纤维蛋白原1.17 g/L,凝血酶时间23.0 s,D-二聚体4 004.16 mg/L,余正常。胸CT:右肺及左肺下叶炎症,脾大。骨髓涂片:红、巨增生,粒系增高,伴分类不明细胞,未见吞噬细胞。骨髓活检(图1):送检穿刺骨髓组织,造血组织容量:70 VOL%,呈骨髓增生较活跃。造血组织粒系增生占优势。粒系前体细胞可见,中、晚阶段细胞散在或成堆可见。红系增生稍低下,原、早阶段细胞可见,中、晚阶段细胞散在或小堆可见。巨核细胞4~6个/HPF,为多叶核。淋巴细胞、浆细胞可见。未见纤维化。免疫组化示:CD3(-)、CD5(个别细胞+)、CD20(-)、CD79a(-)、髓过氧化物酶(MPO)髓系细胞(+)(图2)、CD34(-)。EBV壳抗原IgG(+),EBV壳抗原IgM(+),EBV抗原IgG(+)。EBV DNA 4.63×105拷贝/ml。多次行血培养均(-)。咽拭子、痰细菌培养均(-)。予哌拉西林/他唑巴坦抗感染,膦甲酸钠抗病毒,输注红细胞纠正贫血,同时加用糖皮质激素(甲泼尼龙80 mg/d)治疗1周,患者体温正常,脾脏明显回缩,复查血常规:白细胞2.66×109/L,血红蛋白107 g/L,血小板149×109/L。复查胸CT:右肺及左肺下叶炎症消失。后转产科拟行引产术,激素减量过程中,患者再次出现发热,脾脏迅速增大,复查血常规:白细胞1.2×109/L,血红蛋白87 g/L,血小板12×109/L。复查生化:总蛋白46.2 g/L,白蛋白21.4 g/L,丙氨酸转氨酶(ALT)93.5 U/L,AST 144.3 U/L,总胆红素82.32 μmol/L,直接胆红素41.06 μmol/L,间接胆红素41.26 μmol/L,乳酸脱氢酶638.6 U/L。复查骨髓涂片:可见分类不明细胞,未见吞噬现象。再次予积极抗感染、抗病毒治疗,激素加量(甲泼尼龙80 mg/d),保肝、退黄等治疗,后患者体温正常,复查血常规:血小板升至(50~60)×109/L,生化:总蛋白51.0 g/L,白蛋白26.2 g/L,总胆红素39.78 μmol/L,直接胆红素17.54 μmol/L,间接胆红素21.24 μmol/L。此时患者妊娠23周,应尽快终止妊娠,因血小板低,手术引产或剖宫取胎出血风险大,故拟先行脾切除手术。后于2013年8月2日静脉复合麻醉下外科行脾脏切除手术。术后复查血常规:白细胞5.45×109/L,血红蛋白107 g/L,血小板382×109/L。生化:总蛋白72.5 g/L,白蛋白38.8 g/L,ALT 95.9 U/L,AST 71.3 U/L,总胆红素13.53 μmol/L,直接胆红素6.05 μmol/L,间接胆红素7.48 μmol/L,乳酸脱氢酶246.5 U/L,β2微球蛋白1.70 mg/L,铁蛋白3 800 μg/L。后患者转产科行引产术,后脾脏病理回报(图3):脾脏未见被膜组织,红髓脾窦扩张,窦内可见多量巨噬细胞、吞噬细胞有红细胞、粒细胞,脾索主要为淋巴细胞、组织细胞、中性粒细胞,巨核细胞偶见,未见红系造血岛,淋巴细胞分布相对稀疏,未见生发中心,主要为成熟小淋巴细胞,呈萎缩状态,未见扩张,未见坏死,未见异常大细胞,结合EBV感染病史,建议行TCRr基因重排排除T细胞淋巴瘤后,考虑EBV感染相关性噬血细胞综合征(HPS)。免疫组化:CD3散在(+);CD20残留滤泡(+);CD43散在多(+);CD56(-);CD38散在簇状(+);CD68组织细胞散在(+);MPO散在及簇状(+);CD235a成熟红细胞(+);有核细胞(-);CD61巨核细胞单个散在(+),PAS染色:索区及窦内均可见大量巨噬细胞吞噬红细胞、血小板及粒细胞现象。TCRr基因重排未检测到单克隆重排。复查EBV DNA 4.84×105拷贝/ml。酶联免疫吸附法(ELISA)检测可溶性CD25(sCD25)水平为12 364.8 ng /L,明显升高。患者再次于激素减量后出现发热,体温38.7 ℃,此时,结合脾脏病理回报,患者诊断明确为EBV感染相关性HPS。治疗予HLH-2004免疫化疗方案,地塞米松10 mg/m2,1~2周;5 mg/m2,3~4周;2.5 mg/m2,5~6周;1.25 mg/m2,7~8周;依托泊苷(VP-16)150 mg/m2,2次/周,1~2周;1次/周,3~8周;甲氨蝶呤(MTX)+泼尼松鞘注,1次/周,2~4周;暂未予环孢素治疗,继续膦甲酸钠抗病毒治疗。后患者体温正常,多次复查血常规正常,生化:正常,复查EBV DNA降至4.27×104拷贝/ml,后患者回当地医院继续治疗。1个月后患者再次出现间断发热,体温最高38.5 ℃,于我院治疗,血常规:白细胞5.42×109/L,血红蛋白133 g/L,血小板398×109/L。生化:甘油三酯4.1 mmol/L,余正常。EBV壳抗原IgG(+),EBV壳抗原IgM(-),EBV抗原IgG(+)。EBV DNA升高至5.84×105拷贝/ml,继续予抗病毒治疗,后患者体温逐渐下降至正常,后回当地医院间断行更昔洛韦及膦甲酸钠抗病毒治疗,病情稳定,随访1年病情稳定。
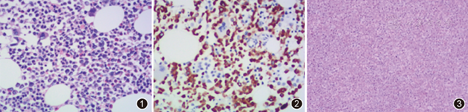

HPS可分为原发性和继发性两种类型,原发性HPS是一种少见病,是常染色体隐性遗传性疾病;继发性HPS可由感染、血液肿瘤、自身免疫性疾病、药物所致,继发于妊娠的少见,EBV检测通常阴性[1]。HPS病情凶险,诊断困难,如不经治疗,患者可很快死于感染和多器官功能衰竭[2]。本例患者妊娠期出现持续发热、全血细胞减少、脾肿大、血清甘油三酯升高、EBV DNA拷贝明显升高、铁蛋白升高、sCD25水平明显升高,脾脏可见噬血细胞现象,根据国际组织细胞协会2004年修订方案的诊断标准[3],诊断EBV相关性HPS明确。患者既往体健,妊娠期间可能因细胞免疫功能减低,容易合并病毒感染,EBV感染后,发生HPS,妊娠与HPS虽无直接相关性,可能存在间接相关性。因骨髓取材方便,且检出嗜血细胞阳性率高,故骨髓穿刺及骨髓活检成为诊断继发性HPS有力证据之一。但本例患者曾反复多次多部位行骨髓穿刺及骨髓活检,均未检出骨髓噬血细胞现象,最终行脾切除术病理确诊。该患者由于妊娠早期发病,如继续妊娠,疾病进展则可能发生胎死宫内,继而孕妇继发弥漫性血管内凝血而死亡,故应首先终止妊娠,术后规律化疗及抗病毒治疗,使疾病得到控制。


























